盐胁迫下表油菜素内酯对沟叶结缕草愈伤组织生长和再生的影响
2020-07-01宋靓苑林恬逸许静雯柴明良
宋靓苑 林恬逸 许静雯 柴明良
(浙江大学农业与生物技术学院园艺系,浙江杭州 310058)
随着人口数量及社会经济活动的急剧增加,盐碱地作为备用土地的主要资源,成为亟待开发的对象[1]。目前我国盐碱土总面积已有9 913 万hm2[2],主要分布在干旱及沿海地区[3]。研究表明,与物理、化学防治技术相比,从生物学角度入手,采用耐盐绿植可对盐碱土进行更有效的生态修复[4]。草坪作为主要陆地生态系统之一,对改善生态环境起着重要作用,选取抗盐草坪草种和采用杂交育种、诱导育种等生物手段提高其抗盐能力显得越发重要[5]。
沟叶结缕草[Zoysia matrella(L.)Merr.]是一种应用广泛的优良暖季型草坪草,其结实率极低,生产上通过匍匐茎无性繁殖,难于采用杂交育种对其进行遗传改良,且其耐盐分子作用机制尚不明确,需要通过人工诱导体细胞无性系变异等生物技术提高其抗逆性[6-7]。沟叶结缕草是愈伤组织及诱导维持异常困难的草坪草种[8]。浙江大学园林植物组织培养与生物技术实验室经过多年离体试验,已成熟掌握以匍匐茎段为外植体诱导愈伤组织并高效再生的技术,并在耐铜、耐盐、辐射诱变、激素调节等体细胞无性系变异的研究中取得阶段性成果[9-12]。沟叶结缕草是结缕草属最耐盐的种类[3]。研究表明,在盐胁迫下沟叶结缕草可通过叶片盐腺向外分泌Na+以减少其在体内的积累,具备较强的抗盐能力[13],是盐碱地改良中使用的重要绿植之一。沟叶结缕草正常生长可耐受的最高土壤含盐量为0.6%~0.8%[14],但实际盐碱地的可溶性盐含量为0.6%~1.0%或更高[2],所以仍然需要提高其耐盐性以适应在不同条件的盐碱地上种植。目前已有关于沟叶结缕草耐盐性的相关报道[15-16],但鲜有研究提出增强其耐盐性的相关技术措施。
植物激素在植物体内的含量虽然十分微量,但在植物的抗逆生理中起着重要作用[17]。油菜素甾醇(brassinosteroids,BRs)是近40年发现的广泛存在于植物体内的甾醇类激素,其中包括60 多种植物甾醇,具有较高的生理活性,参与植物生长发育及抗逆过程[18-20]。目前,BRs 中应用最广泛的包括油菜素内酯(brassinolide,BL)、高油菜素内酯(homobrassinolide,HBL)和表油菜素内酯(epibrassinolide,EBL)3 种[21]。其中,EBL 能通过增强光合效率和抗氧化酶系统,减轻高温对茄科植物的危害[22];对大麦施用EBL 能有效降低黄色镰刀菌(Fusarium culmorum)产生的赤霉病危害并减少谷物损失[23]。本试验首次以沟叶结缕草胚性愈伤组织为材料,在盐胁迫下对其进行不同浓度EBL 处理,旨在筛选出缓解愈伤组织盐胁迫伤害、促进愈伤组织生长和再生的EBL 最适浓度,为其在沟叶结缕草耐盐育种及植株水平上提高耐盐性提供基础数据。
1 材料与方法
1.1 试验材料
沟叶结缕草胚性愈伤组织,是本实验室以幼嫩匍匐茎诱导的并持续继代、离体保存10年的愈伤组织。
1.2 沟叶结缕草愈伤组织盐胁迫浓度的筛选
以MS +2.0 mg·L-12,4-二氯苯氧乙酸(2,4-dichlorphenoxyacetic acid,2,4-D)+1.15 g·L-1脯氨酸+40 g·L-1蔗糖+3.0 g·L-1植物凝胶(phytagel)为基本生长培养基,以1/2 MS+30 g·L-1蔗糖+3.0 g·L-1phtyagel为基本再生培养基,培养基在高压灭菌前用NaOH 调节pH 值至5.8[12]。愈伤组织经继代生长2 周后,取直径约2.5 mm 的小块,依次接种到NaCl 浓度分别为0%、0.2%、0.4%、0.6%、0.8%的生长或再生培养基上,每皿(瓶)接种16 小块,每个处理5 次重复。愈伤组织生长于25±2℃下暗培养并记录其初始愈伤组织直径和鲜重;愈伤组织再生于温度25±2℃、光强约12 μmol·m-2·s-1条件下培养,每天光照时长12 h。4 周后观察愈伤组织的生长情况,并记录愈伤组织直径和鲜重,以直径增长率[(4 周后直径-初始直径)/初始直径×100%]和鲜重增长率[(4 周后鲜重-初始鲜重)/初始鲜重×100%]作为衡量其生长状况的标准。愈伤组织再生过程中表面会产生绿色瘤状凸起,并陆续分化形成绿色小苗。培养13 周后观察愈伤组织再生生长情况,统计外植体中的成苗数和根长≥5 mm 的数量,衡量其再生能力[24]。以上述生长和再生数据指标综合衡量沟叶结缕草愈伤组织的耐盐能力及表现出生长受迫害的盐浓度。
1.3 EBL 处理盐胁迫下的愈伤组织
在NaCl 浓度为0.2%、0.4%、0.6%、0.8%的基础上,于每一盐浓度下的生长和再生培养基中分别加入浓度为0、0.01、0.02、0.05、0.1、0.5 mg·L-1的EBL(中国PERFEMIKER 公司)。愈伤组织经继代生长2 周后,取直径约2.5 mm 的小块,接种到同时添加NaCl和EBL 的生长或再生培养基中,每皿(瓶)接种16 小块,每个处理设置5 次重复。愈伤组织生长和再生培养条件及观察记录方法同1.2。
1.4 盐胁迫下加入EBL 处理后愈伤组织及再生植株叶片相关抗氧化酶活性和丙二醛含量的测定
培养4 周后,取不同处理下愈伤组织0.1 g,加入3 mL 50 mmol·L-1磷酸缓冲液,于冰浴中研磨,匀浆液于4℃下12 000 r·min-1离心20 min,保留上清液。培养13 周后,取不同处理下再生植株叶片0.1 g(0.8%盐浓度下因无再生植株取其愈伤组织代替),加入3 mL 50 mmol·L-1磷酸缓冲液,于冰浴中研磨,匀浆液于4℃下12 000 r·min-1离心20 min,保留上清液。上述所得上清液作为待测酶液用于过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量测定,每个处理设3 次重复。其中,CAT 活性测定采用过氧化氢比色法[25],向待测酶液中加入反应液(含25 mmol·L-1pH 值7.0 磷酸缓冲液、225 mmol·L-1H2O2),混匀后立即测定其在290 nm 波长处的吸光度值;SOD 活性测定采用NBT(氮蓝四唑)光还原法,向待测酶液中加入反应液(含13 mmol·L-1甲硫氨酸、63 μmol·L-1核黄素、0.1 mmol·L-1EDTA 及50 mmol·L-1pH 值7.8 磷酸缓冲液),混匀,在25℃、4 000 Lux 条件下均匀照光5 min 后使用黑布覆盖终止反应,并立即测定其在560 nm 波长处的吸光度值;POD 活性测定采用愈创木酚法[26],向待测酶液中加入反应液(含25 mmol·L-1pH 值7.0 磷酸缓冲液、1%愈创木酚溶液及20 mmol·L-1H2O2),混匀后立刻测定其在470 nm 波长处的吸光度值;MDA 含量采用硫代巴比妥酸(thiobarbituric acid,TBA)法[27],取待测酶液并加入TBA 反应液(含0.5%硫代巴比妥酸和20%三氯醋酸),在黑暗条件下煮沸10 min(自试管出现小气泡开始计时)后立即进行冰浴冷却至析出晶体,再于4℃下12 000 r·min-1离心5 min,取上清液,测定其在532、600 和450 nm 波长处的吸光度值。吸光度采用UV-2550 型分光光度计(日本SHIMADZU 公司)测定,根据所测数据计算各指标的含量。
1.5 数据处理
试验数据分析采用SPSS 19.0 分析软件,并应用LSD、Duncan 多重比较法对试验数据进行分析。
2 结果与分析
2.1 盐浓度对沟叶结缕草愈伤组织生长和再生的影响
不同盐浓度对沟叶结缕草愈伤组织的生长和再生影响显著。随着盐浓度的增加,沟叶结缕草愈伤组织生长和再生能力均先升高后降低(图1)。当NaCl 浓度为0.2%时,沟叶结缕草愈伤组织的直径增长率达到最大值;当NaCl 浓度为0.4%时,沟叶结缕草鲜重增长率达到最大值。当NaCl 浓度为0.2%时,沟叶结缕草外植体中根长≥5mm 数及成苗数均达到最大值;随着盐浓度的增加,沟叶结缕草愈伤组织再生能力呈明显下降趋势,当NaCl 浓度为0.8%时,无再生植株。即沟叶结缕草愈伤组织在低盐胁迫下可正常生长和再生,而随着盐浓度的增加,其生长和再生受到明显抑制。

图1 不同盐浓度下沟叶结缕草愈伤组织生长和再生状况Fig.1 Growth and regeneration of callus of Zoysia matrella under different salt concentrations
2.2 EBL 处理对沟叶结缕草愈伤组织耐盐性的影响
2.2.1 盐胁迫下EBL 对愈伤组织生长和再生的影响
添加EBL 后愈伤组织的耐盐能力显著加强。当NaCl 浓度≥0.6%时,沟叶结缕草愈伤组织生长出现受抑制现象(图1-A),而添加EBL 后,随着EBL 浓度的增加,愈伤组织生长的直径增长率和鲜重增长率先升高后降低(图2-A)。当EBL 浓度为0.05 mg·L-1时,沟叶结缕草愈伤组织直径增长率达到最大值(147.37%),为对照(0 mg·L-1EBL)的1.54 倍,且差异显著;此时,愈伤组织鲜重增长率也达到最大值(238.10%),为对照的1.26 倍,差异也显著。
当NaCl 浓度≥0.4%时,沟叶结缕草愈伤组织再生出现受抑制现象(图1-B),而添加EBL 后,随着EBL 浓度的增加,愈伤组织再生植株根长≥5 mm 数及成苗数先升高后降低(图2-B)。当EBL 浓度为0.02 mg·L-1时,根长≥5mm 的愈伤块数达到最大值(4块),为对照(0 mg·L-1EBL)的1.20 倍,且差异显著,成苗数也达到最大值(4.6 块),为对照的1.38 倍,差异也显著。
盐胁迫下,当EBL 浓度分别≥0.05 mg·L-1和≥0.10 mg·L-1时,与对照相比,沟叶结缕草愈伤组织的生长和再生分别受到抑制,这可能是因为较高浓度的EBL 会对其生长产生抑制作用。综上,添加适当浓度的EBL 可显著提高沟叶结缕草愈伤组织及再生植株的耐盐能力。
2.2.2 盐胁迫下EBL 对愈伤组织和再生植株叶片CAT、POD、SOD 活性及MDA 含量的影响 加入不同浓度EBL 会对盐胁迫下沟叶结缕草愈伤组织生长的生理活性起到显著影响(图3),其中CAT、POD、SOD活性随着EBL 浓度的增加呈先升高后降低的趋势,MDA 含量则呈先降低后升高的趋势。当EBL 浓度为0.05 mg·L-1时,不同NaCl 浓度处理下的愈伤组织CAT、POD、SOD 活性在显著水平上基本达到最大值,而MDA 含量降至最低值。其中,在0.6%NaCl 浓度下,与对照(0 mg·L-1EBL)相比,0.05 mg·L-1EBL 处理后愈伤组织的CAT、POD、SOD 活性分别增加了4.46%、24.07%、18.84%,而 MDA含量减少了48.29%;当EBL 浓度≥0.1 mg·L-1时,愈伤组织的CAT、POD、SOD 活性呈下降趋势,MDA 含量则呈现上升趋势,可能因为高浓度EBL 对保护酶活性起到了抑制作用,膜脂过氧化反应加剧。综上,适当浓度EBL处理可显著提高保护酶活性,有效缓解植物细胞所受盐迫害。
再生植株叶片中的保护酶活性和MDA 含量变化趋势与愈伤组织基本相同(图4),即CAT、POD、SOD活性随着EBL 浓度的增加呈先升高后降低的趋势,MDA 含量呈先降低后升高的趋势,但当EBL 浓度为0.02 mg·L-1时,不同NaCl 浓度处理下再生植株叶片中CAT、POD、SOD 活性在显著水平上基本达到最大值,MDA 含量则降低至最小值。与上述生理变化相对应的,当EBL 浓度小于0.02 mg·L-1时,再生植株长势随EBL 浓度的增加而增加(图5-A、B);当EBL 浓度为0.02 mg·L-1时生长状态最佳(图5-C);当EBL 浓度大于0.02 mg·L-1时,再生植株长势随EBL 浓度的增加逐渐下降(图5-D、E、F)。
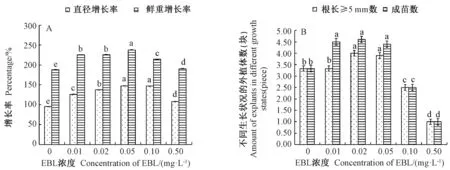
图2 0.6%NaCl胁迫下不同浓度EBL 处理后愈伤组织生长和再生状况Fig.2 Growth and regeneration of callus treated with different concentrations of EBL under 0.6%NaCl stress
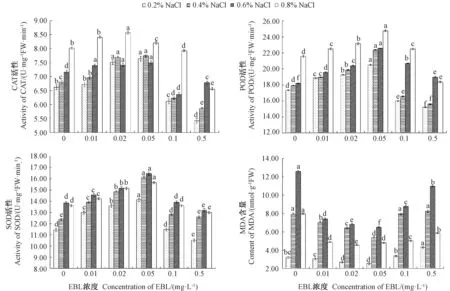
图3 NaCl胁迫下不同浓度EBL 处理后愈伤组织生理特性Fig.3 Physiological characteristics of callus treated with different concentrations of EBL under NaCl stress
3 讨论
3.1 盐胁迫对沟叶结缕草愈伤组织生长和再生的影响
本试验中,当NaCl 浓度为0.2%时,沟叶结缕草愈伤组织的生长和再生均高于对照(0%NaCl),表明其具备一定的抗盐能力,这与周兴元等[14]的研究结果一致,可能是因为对耐盐植物而言,NaCl 为其生长所需物质,少量的盐可以促进其生长[28]。当NaCl 浓度≥0.6%时,沟叶结缕草愈伤组织生长受到抑制;当NaCl浓度≥0.4%时,愈伤组织再生受到抑制,这与周兴元等[14]的研究结果不同,可能与离体组织和田间植株在生理特性上的差异有关。
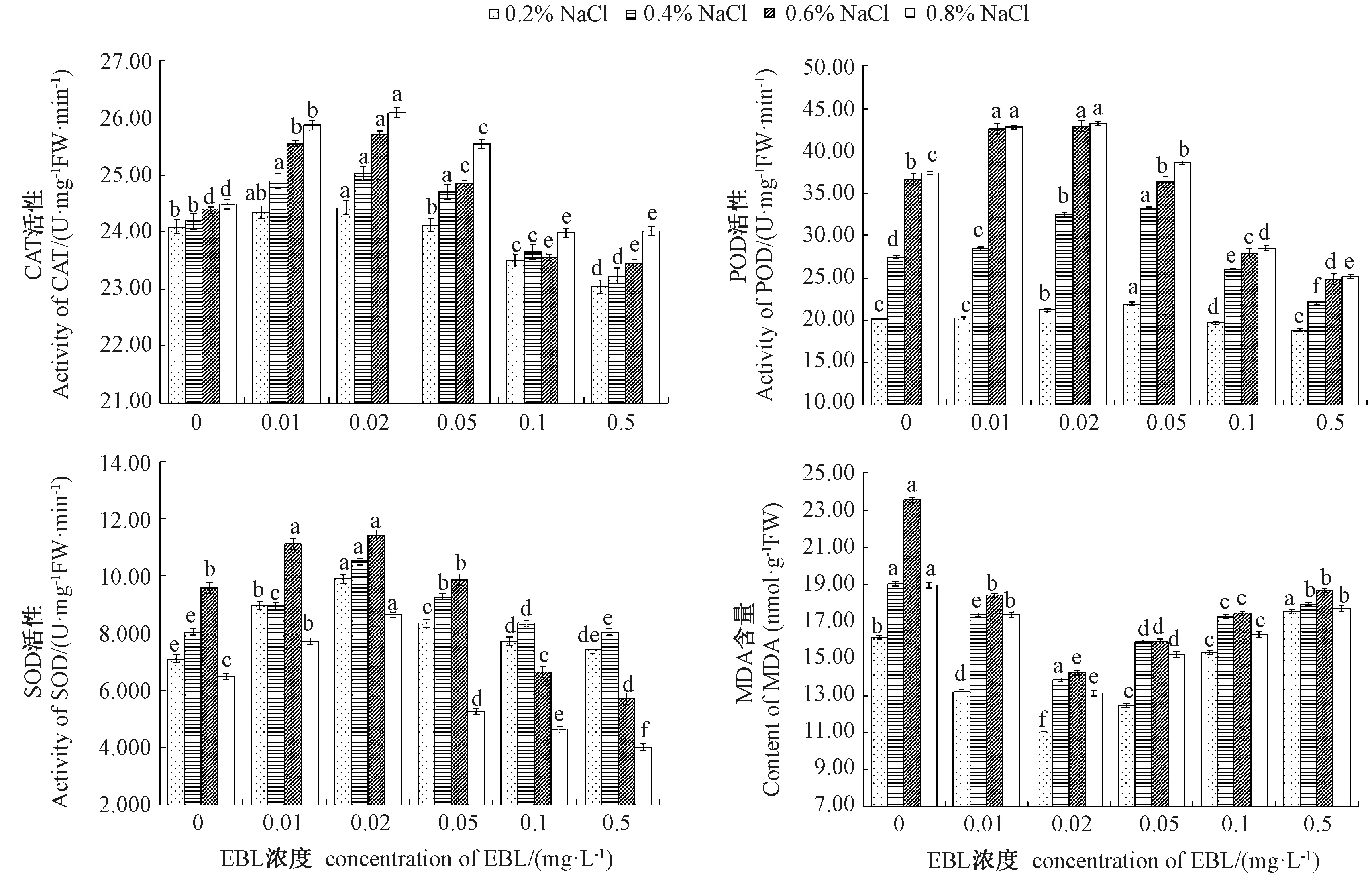
图4 NaCl胁迫下不同浓度EBL 处理后愈伤组织再生植株叶片的生理特性Fig.4 Physiological characteristics of leaves from the regenerated plantlets with different concentrations of EBL under NaCl stress

图5 0.2%NaCl胁迫下不同浓度EBL 处理后愈伤组织再生植株状况Fig.5 Regenerated plantlets treated with different concentrations of EBL under 0.2%NaCl stress
3.2 EBL 处理对沟叶结缕草愈伤组织耐盐性的影响
3.2.1 盐胁迫下EBL 对沟叶结缕草愈伤组织生长及再生的影响 BRs 提高植物抗病抗逆能力的机理已有报道[29]。在植物体内,BRs 参与激活抗病基因和光合途径基因的表达、增强抗氧化酶系统等[30],其中,与泛素介导的蛋白降解途径中的UBC32 蛋白相互作用,可有效提高植物的耐盐性[31]。研究表明,外施EBL 能显著减缓铜胁迫对番茄的伤害[30],施用BRs 后可有效减缓盐胁迫对叶用莴苣造成的生长受损[31]。本试验中,在盐胁迫下加入EBL 对沟叶结缕草愈伤组织生长及再生均有显著的促进作用,且不同浓度EBL 对其生长的作用效果不同,这与唐鑫华等[32]的研究结果一致。
3.2.2 盐胁迫下EBL 对沟叶结缕草愈伤组织及再生植株叶片中CAT、POD、SOD 活性的影响 植物在逆境条件下通常伴随大量活性氧的产生,如果不能及时清除会使得细胞膜及一些大分子物质遭到破坏,从而影响植物的生长[33]。CAT、POD 和SOD 等保护酶在感知盐胁迫时会提高活性,从而加快对活性氧的清除,具有维持活性氧代谢平衡、保护膜结构的功能[34-35]。研究表明,BRs 可以增强逆境下防御基因,如加强POD、SOD 等酶的合成或调解特定基因的转录与翻译进一步激活保护酶系统[36]。本试验中,在盐胁迫下加入EBL 可显著提升沟叶结缕草愈伤组织及再生植株CAT、POD、SOD 活性,与上述BRs 的相关研究结果一致,证实EBL 对沟叶结缕草耐盐生理机制具有促进作用。
3.2.3 EBL 对沟叶结缕草愈伤组织继代及再生植株叶片中MDA 含量的影响 当植物器官处于逆境条件时,通常会发生膜脂过氧化作用,MDA 为其产物之一。MDA 含量可以表示细胞膜脂过氧化程度,即植物受逆境作用伤害程度[37]。本试验发现,在盐胁迫下加入EBL 可显著降低愈伤组织及再生植株中的MDA 含量,这与康云艳等[38]施用BRs 后测得植物MDA 含量下降相一致,即EBL 可以显著缓解盐胁迫下沟叶结缕草愈伤组织及再生植株细胞膜的受害程度。本研究结果表明,盐胁迫条件下,0.05、0.02 mg·L-1EBL 处理可有效提高沟叶结缕草愈伤组织继代和再生的抗盐性,而当EBL 浓度增加到一定值时,会出现降低耐盐性的反作用,其原因可能是EBL 浓度超过阈值,对植物生长表现出抑制作用[39]。
4 结论
本研究结果表明,沟叶结缕草愈伤组织可在低盐浓度下正常生长和再生。盐胁迫下添加适当浓度EBL后,沟叶结缕草愈伤组织的CAT、POD 和SOD 活性显著升高,MDA 含量显著下降,同时愈伤组织和再生植株的生长也得到明显改善,证明EBL 可有效提升沟叶结缕草愈伤组织及再生植株的耐盐能力。本研究表明,EBL 处理结合离体筛选在沟叶结缕草耐盐育种方面具有可行性,同时也为EBL 提高沟叶结缕草植株水平耐盐性的研究提供了猜想和借鉴。
