一株产肠毒素大肠杆菌短尾噬菌体分离与鉴定
2020-07-01魏炳栋徐永平李纪彬李淑英
魏炳栋,丛 聪,于 维,徐永平,*,李纪彬,李淑英
(1.吉林省农业科学院畜牧分院,吉林 公主岭 136100;2.大连赛姆生物工程技术有限公司博士后科研工作站,辽宁 大连 116620;3.吉林省吉嘉饲料添加剂有限公司,吉林 公主岭 136100;4.大连理工大学生物工程学院,辽宁 大连 116024)
产肠毒素大肠杆菌(Enterotoxigenic Escherichia coli,ETEC)是动物腹泻的主要致病菌,ETEC可产生一种或几种肠毒素,肠毒素通过影响肠细胞壁通透性,使水和电解质流向肠腔,导致水样性腹泻[1]。其中以仔猪感染ETEC引发的腹泻尤为严重,发病率为20%~100%,死亡率为10%~60%,初次发病率高达100%,再次感染发病率则大幅降低[2]。目前,主要采用抗菌药物治疗ETEC。但抗菌药物大量使用,尤其作为饲料添加剂长期使用,致病性大肠杆菌产生耐药性,严重威胁人类健康和公共卫生安全。
噬菌体(Bacteriophage,简称phage)是一类可感染细菌、真菌、放线菌或螺旋菌等微生物的病毒总称,是自然界中多样性和数量最为丰富的生物。噬菌体最先由英国科学家Frederick Twort(1915年)[3]和加拿大微生物学家Felix D'Herelle(1917年)[4]发现,后者首次提出“噬菌体”概念。此后,科研和治疗机构研发商业化的噬菌体制剂对抗细菌感染。直至20世纪40年代,由于抗生素量产及噬菌体疗法存在缺陷,噬菌体研究一度陷入中断。20世纪80年代,由于多重耐药菌出现,噬菌体研究重新受到重视,以期寻求抗生素替代品。目前噬菌体应用研究范围较广,不仅针对人类疾病预防与治疗,还涉及动物、食品及饲料中病原菌清除、细菌生物被膜裂解等方面。
本研究以猪源ETEC为宿主菌,从养殖场污水中分离一株裂解性噬菌体,对其开展生物学特性及全基因组分析,旨在为防控ETEC感染提供新的技术手段。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
大肠杆菌 (Escherichia coli,E.coli) E5、E6、E8、E11和E13分离自吉林省农业科学院畜牧分院养猪场排泄物,由吉林省农业科学院畜牧分院抗生素替代品实验室保存,宿主菌ETEC K88及用于鉴定宿主谱所选大肠杆菌236、233、238和F18等菌种购自中国兽医微生物菌种保藏管理中心(CVCC),大肠杆菌12588购自北纳生物(BNCC),产志贺毒素大肠杆菌(Shiga toxin-producing E.coli,STEC)10668、志贺氏菌属(Shigella spp.)、沙门氏菌属(Salmonella spp.)和变形杆菌属(Proteus spp.)菌种均购自中国普通微生物菌种保藏管理中心(CGMCC)。采集猪场污水用于分离噬菌体。
1.1.2 培养基
LB液体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,溶于1 L纯净水中,pH 7.0,121℃灭菌20 min,常温保存备用。
LB固体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂粉18 g溶于1 L纯净水中,pH 7.0,121℃灭菌20 min,常温保存备用。
LB半固体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂粉9 g溶于1 L纯净水中,pH 7.0,121℃灭菌20 min,常温保存备用。
1.2 试验方法
1.2.1 噬菌体分离与鉴定
噬菌体分离与鉴定参照文献[5]。噬菌体分离:采集污水用滤纸过滤,去除固体杂质后,取污水样50 mL,12 000 r·min-1离心6 min,0.22 μm 滤膜过滤得上清液;取上清液30 mL加入30 mL LB液体培养基和5 mL处于对数期宿主菌液,混匀后于37℃,160 r·min-1恒温摇床培养过夜;取1 mL培养液,12 000 r·min-1离心6 min,0.22 μm滤膜过滤得上清液,即为噬菌体原液。取100 μL噬菌体原液与200 μL对数期宿主菌混合,加入约 8 mL半固体LB培养基中,混合均匀后倒入含有LB固体培养基平板,待上层凝固后,37℃恒温箱过夜培养。出现透明斑,则说明噬菌体存在。通过连续6次单斑分离,即获得纯化后噬菌体。
1.2.2 噬菌体感染复数(Multiplicity of infection,MOI)测定
噬菌体感染复数测定参照文献[5]。将已知效价的噬菌体与宿主菌各200 μL按照0.0001、0.001、0.01、0.1、1和10比例混合,37 ℃,160 r·min-1震荡培养5 h,12 000 r·min-1,离心6 min,收集上清后,0.22 μm滤膜过滤;取滤液梯度稀释后,利用双层平板法测噬菌体效价,所测得效价最高感染复数组即为最佳感染复数(Optimal muhiplieity of in⁃fection,OMOI)。每个试验重复3次。
1.2.3 噬菌体一步生长曲线(One-step growth curve)测定
噬菌体一步生长曲线参照文献[6]。按照最佳MOI将1 mL培养至对数期宿主菌与噬菌体混合,37 ℃孵育15 min,12 000 r·min-1离心10 min,弃上清;2 mL 37℃预热LB液体培养基洗涤两次;加入2 mL 37℃预热LB液体培养基重悬,加入10 mL 37℃预热LB液体培养,充分混匀,迅速置于37℃振荡培养,同时开始计时T0=0,每隔10 min采样,连续采样120 min,采用双层平板法测定效价,以时间为横坐标,效价为纵坐标,绘制噬菌体一步生长曲线。
1.2.4 噬菌体温度和pH敏感性测定
分别取1 mL噬菌体裂解液加入1.5 mL无菌离心管中,再将离心管分别置于40、50、60、70、80℃水浴锅中,按照20、40、60、80、100、120 min不同时间点从离心管中取出100 μL噬菌体裂解液,冷却至室温,双层平板法测其效价,每组3个重复。利用1 mol·L-1HCl和1 mol·L-1NaOH溶液将LB培养基pH调至2~12,分别取900 μL不同pH培养基加入1.5 mL离心管,加入100 μL上述噬菌体裂解液,37℃恒温培养1 h,利用双层平板法测噬菌体效价,每组3个平行。
1.2.5 噬菌体氯仿敏感性
取1 mL噬菌体,按1%体积加入氯仿溶液,充分混合后置于室温静置30 min,待分层后取上层溶液测定效价。
1.2.6 噬菌体宿主谱测定
噬菌体测定采用点滴法,具体过程如下:将宿主菌液均匀涂布于LB固体培养基,待其晾干后,吸取5 μL噬菌体裂解液滴于培养基,37℃倒置培养10~12 h,观察是否出现噬菌斑,若噬菌斑出现说明噬菌体对该菌株有裂解作用。
1.2.7 噬菌体透射电镜观察
首先将噬菌体制备成浓缩颗粒,制备噬菌体浓缩颗粒步骤如下:在噬菌体原液中加入NaCl,使其终浓度为1 mol·L-1,搅拌充分溶解后冰浴1 h,12 000 r·min-1离心5 min,得到上清液,然后加入PEG 8 000浓度达10%(w/v),玻璃棒缓慢搅拌使其充分溶解,冰浴过夜,10 000 r·min-1离心5 min,弃上清,将离心管倒置20 min至管内液体全部流干,然后5 mL SM缓冲液重悬,4℃保存。电镜观察步骤如下:将制备重悬液10 μL滴于铜网上,待其自然沉淀10 min,滤纸从侧面小心吸干多余液体,加少量2%磷钨酸到铜网上,染色3 min,待铜网干燥后电镜观察。
1.2.8 噬菌体基因组测序
噬菌体基因组提取采用苯酚-氯仿法[7]。将提取DNA沉淀室温干燥后,用适量双蒸水重悬,-20℃冷冻保存。
1.2.9 噬菌体全基因组测序及生物信息学分析
噬菌体基因组测序由上海派森诺生物公司完成。采用Illumina Hiseq测序平台,TruSeqTMDNA Sample Prep Kit构建DNA文库。基因组序列拼装结果由上海派森诺生物公司提供。利用NCBI在线工具BLASTp(http://blast.ncbi.nlm.nih.gov/)对噬菌体基因组开放阅读框作功能注释;利用tRNAscan-SE预测噬菌体全基因组tRNA[8];软件MEGA7.0对噬菌体末端酶大亚基序列构建进化树;利用CGView Serve(http://cgview.ca)对噬菌体全基因组作环状图[9]。利用在线软件(https://cge.cbs.dtu.dk/services/ResFinder/和 https://cge.cbs.dtu.dk/services/Virulence⁃Finder/)预测抗生素耐药基因和毒力因子。
2 结果与分析
2.1 噬菌体分离与鉴定
以产肠毒素大肠杆菌ETEC K88为宿主菌,从养殖场污水中分离噬菌体vB_EcoP_E21,经纯化6次后,在双层平板上产生直径1~2 mm噬菌斑。
2.2 噬菌体形态学特点
透射电镜照片显示,噬菌体vB_EcoP_E21具有典型二十面体结构和非收缩尾部,其头部直径约为50 nm,尾部长度约为10 nm,符合短尾噬菌体科(Podoviridae)特点(见图1)。
2.3 噬菌体最佳感染复数
由表1可知,当MOI=0.1时,噬菌体vB_EcoP_E21效价达到最大9.94 log PFU·mL-1,说明噬菌体vB_EcoP_E21最佳感染复数为0.1。

图1 噬菌体vB_EcoP_E21透射电镜图Fig.1 Transmission electron micrograph of phage vB_EcoP_E21

表1 噬菌体vB_EcoP_E21感染复数测定Table 1 Determination titer of phage vB_EcoP_E21 at different MOI
2.4 噬菌体一步生长曲线
由图2可知,噬菌体vB_EcoP_E21潜伏期约为20 min,随后效价急剧增加后趋于稳定,则噬菌体vB_EcoP_E21爆发期约为20 min,根据公式裂解量=裂解末期噬菌体效价/感染初期宿主菌浓度,计算裂解量为3.7×109/1×107=370 PFU · cell-1。
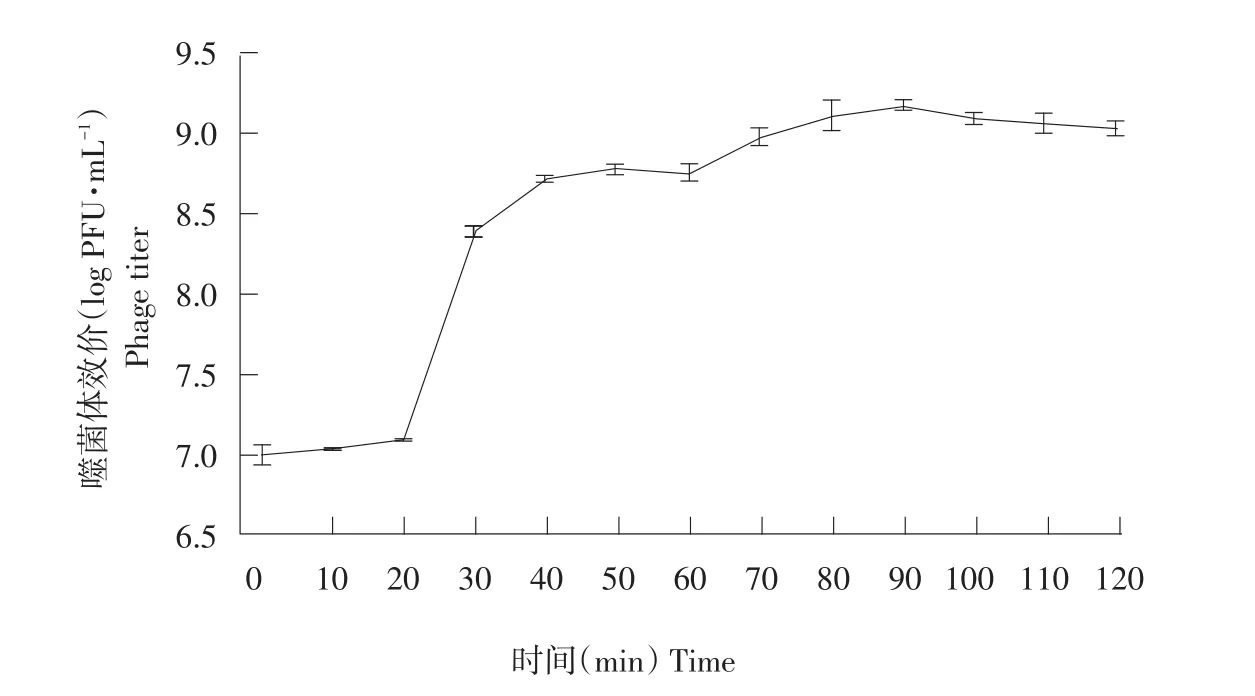
图2 噬菌体vB_EcoP_E21一步生长曲线Fig.2 One-step growth curve of phage vB_EcoP_E21
2.5 噬菌体温度和pH敏感性测定
由图3可知,噬菌体vB_EcoP_E21对温度有较强稳定性,40、50和60℃作用120 min效价基本保持稳定,70℃作用40 min后,效价开始下降,80℃作用40 min后,效价急剧下降,120 min时达到最低4.63 log PFU·mL-1;噬菌体vB_EcoP_E21在pH 4~10范围内保持较高效价,当pH为2或12时,效价为0。
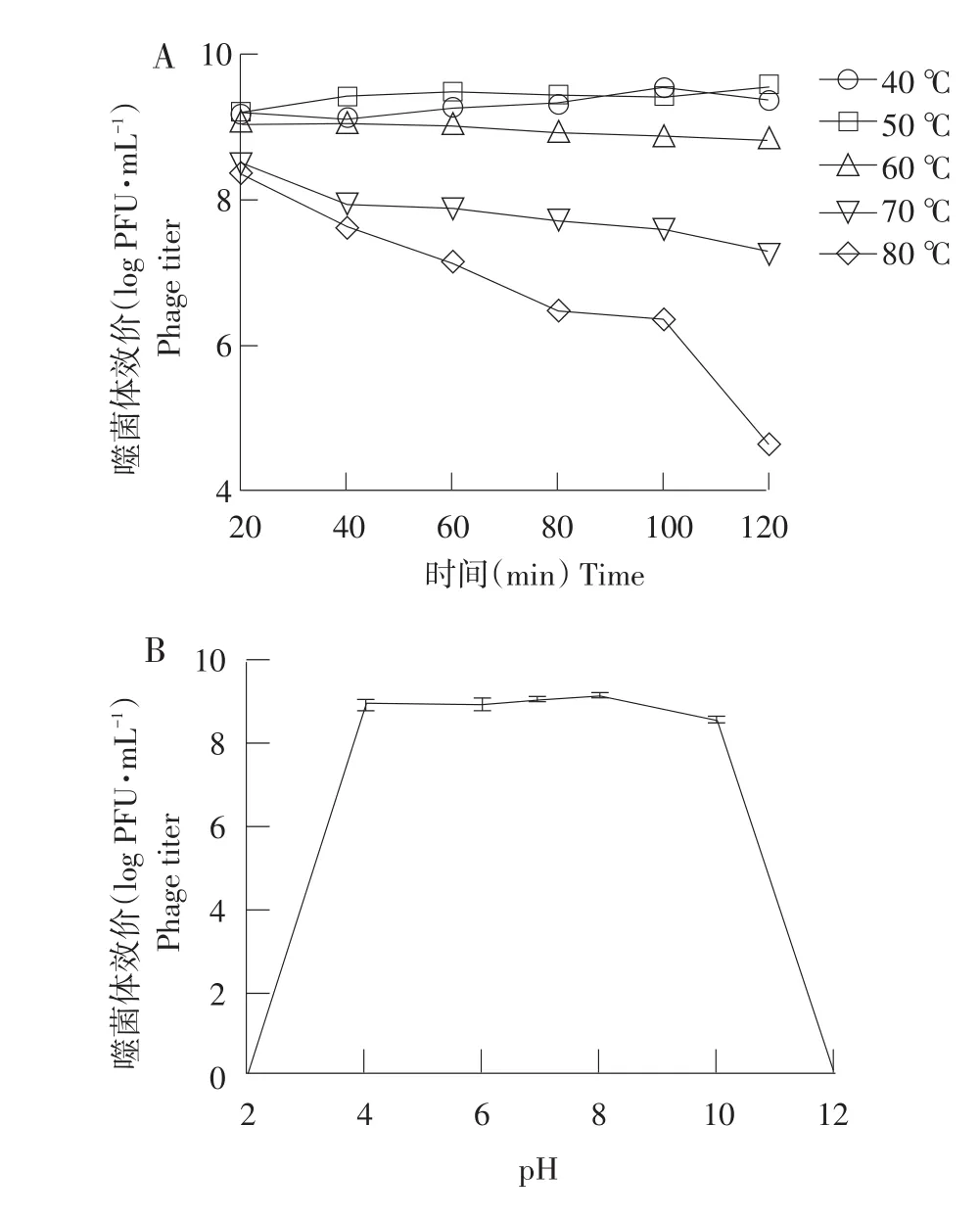
图3 噬菌体vB_EcoP_E21对温度(A)和pH(B)耐受性Fig.3 Temperature(A)and pH(B)tolerance of phage vB_EcoP_E21
2.6 噬菌体氯仿敏感性
由表2可知,氯仿处理前噬菌体效价为(9.84±0.05)log PFU·mL-1,处理后为(9.83±0.03)log PFU·mL-1。氯仿对噬菌体效价无明显影响,说明噬菌体vB_EcoP_E21衣壳或尾丝中不含脂类物质,对氯仿不敏感,后续试验操作中可加入氯仿处理。
2.7 噬菌体宿主谱测定
由表2可知,噬菌体vB_EcoP_E21裂解谱较广,对试验所选大肠杆菌有裂解作用,但对产志贺毒素大肠杆菌10668、志贺氏菌属、沙门氏菌属及变形杆菌属的菌株无裂解作用。

表2 噬菌体vB_EcoP_E21裂解谱Table 2 Host range of phage vB_EcoP_E21
2.8 噬菌体全基因组分析
2.8.1 噬菌体全基因组概况
噬菌体vB_EcoP_E21基因组为线性双链DNA,GeneBank登录号为MN604053。基因组长度为58 536 bp,(G+C)%含量为46.89%,基因组A、G、T和C碱基含量分别为25.13%、22.33%、24.56%和27.98%。通过与Rfam数据库比对[10],非编码RNA(ncRNA)为0,利用tRNAscan-SE在线软件预测,未检测到tRNA。未预测出已知相关抗生素耐药基因和毒力因子,表明噬菌体基因组安全性。
该基因组有66个开放阅读框,其中有23个为功能编码序列(Coding sequence,CDS),开放阅读框总长度51 627 bp,ORFs密度为1.128 Genes/kb,开放阅读框平均GC含量47.29%。根据基因不同功能可将已知功能基因分为4类,分别为噬菌体结构和包装基因、DNA复制及调控基因、宿主裂解功能基因及其他功能。功能编码序列注释与对比分析见表3。
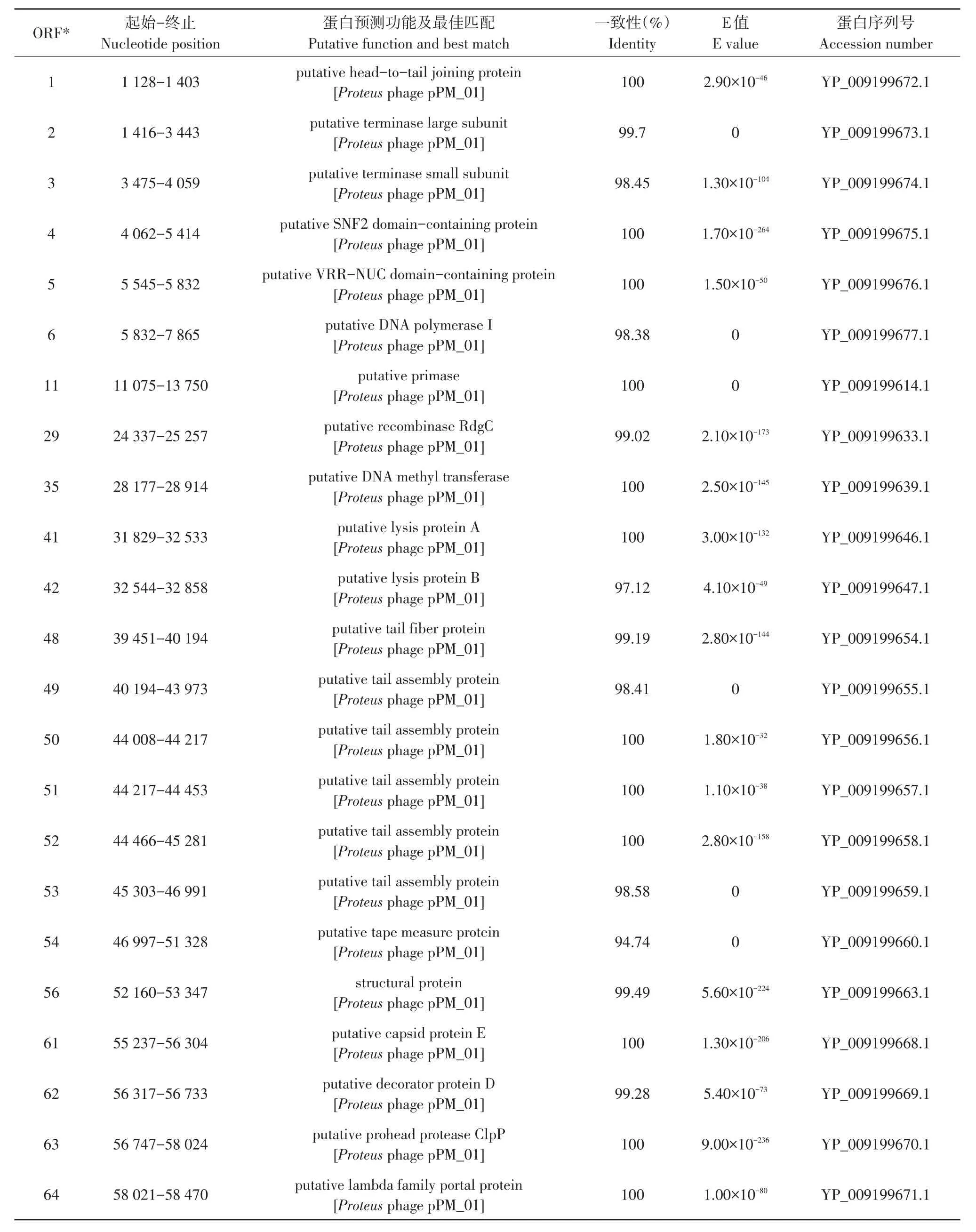
表3 噬菌体vB_EcoP_E21蛋白功能预测Table 3 Predicted protein function of phage vB_EcoP_E21
其中与噬菌体结构和包装功能相关的基因有头尾交联蛋白(ORF1),终末端大、小亚基(ORF2和3),结构域蛋白(ORF4和5),尾部蛋白(ORF48、49、50、51、52和53),卷尺蛋白(ORF54),结构蛋白(ORF56)和衣壳蛋白(ORF61);与DNA复制及调控相关基因有DNA聚合酶Ⅰ(ORF6),引物酶(ORF11),重组酶(ORF29),转移酶(ORF35),修饰蛋白(ORF62)及其他蛋白酶(ORF63和64);与噬菌体裂解相关有裂解酶A和B(ORF41和42),但未预测到穿孔素蛋白序列。
2.8.2 同源进化树
为了解噬菌体vB_EcoP_E21与其他噬菌体之间进化关系,选用噬菌体保守基因且具有进化意义末端酶大亚基(ORF2)和衣壳蛋白(ORF63)氨基酸序列,采用MEGA软件Neighbor-joining方法构建同源进化树(见图4和5)。由图4可知,噬菌体vB_EcoP_E21与变形杆菌噬菌体P16-2532、PM87和pPM 01亲缘关系较近,由图5可知,与变形杆菌噬菌体pPM 01和Saba亲缘关系较近,与大肠杆菌噬菌体lambda、T4、T1、T5和T7等亲缘关系较远,变形杆菌噬菌体P16-2532、PM87、pPM 01和Saba均属于长尾噬菌体科(Siphoviridae),而噬菌体vB_EcoP_E21属于短尾噬菌体,说明vB_EcoP_E21是一株新型产肠毒素大肠杆菌噬菌体。
2.8.3 噬菌体vB_EcoP_E21全基因图谱
采用在线软件CGView Server绘制噬菌体vB_EcoP_E21环状全基因图谱(见图6),功能基因分别用噬菌体结构蛋白(蓝色),宿主裂解(红色),DNA装配与复制(绿色)及假定蛋白(灰色)表示。
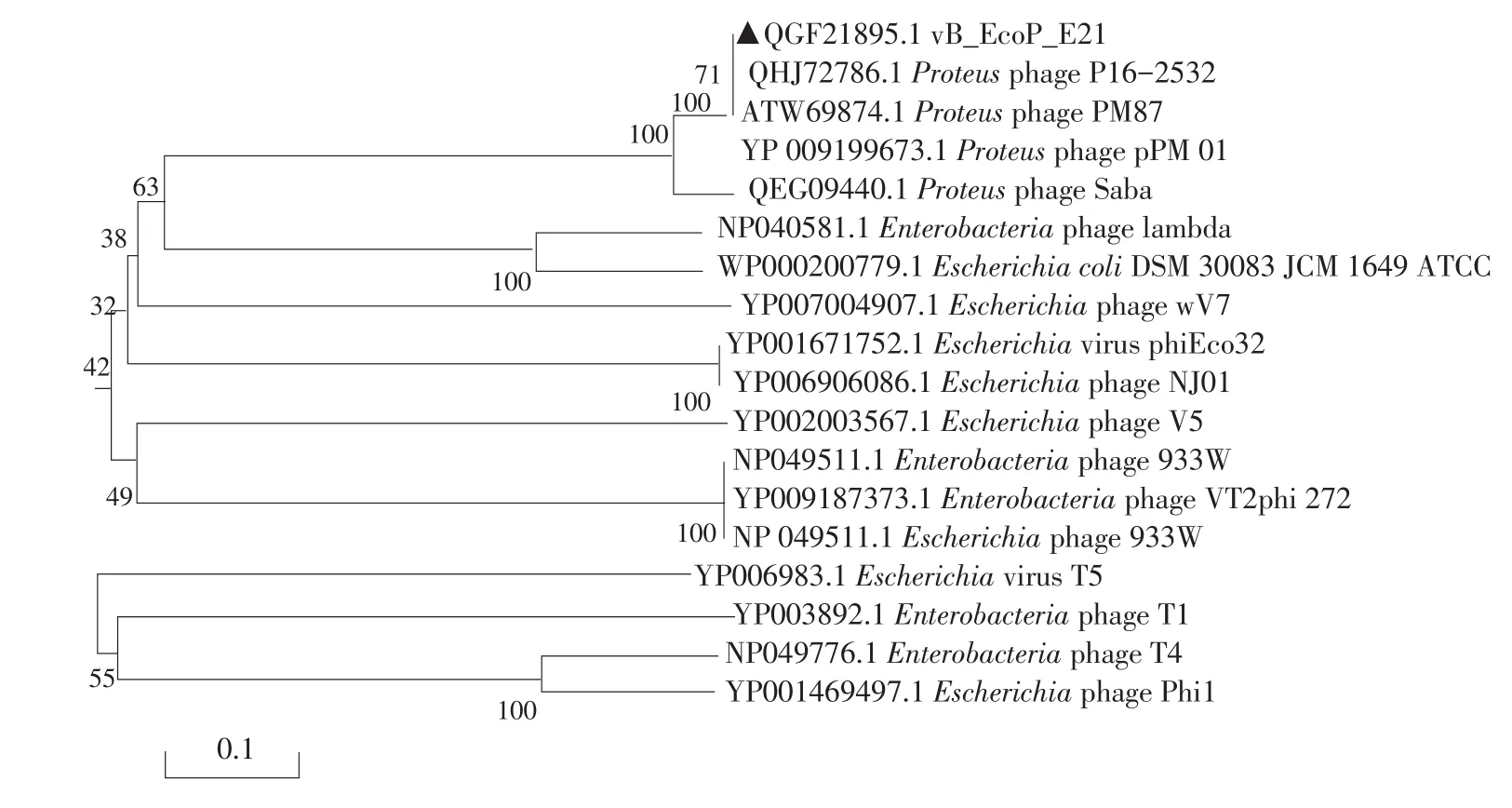
图4 基于噬菌体vB_EcoP_E21末端酶大亚基构建同源进化树Fig.4 Based on the terminase large subunit protein showing the neighbor-joining phylogenetic tree of phage vB_EcoP_E21
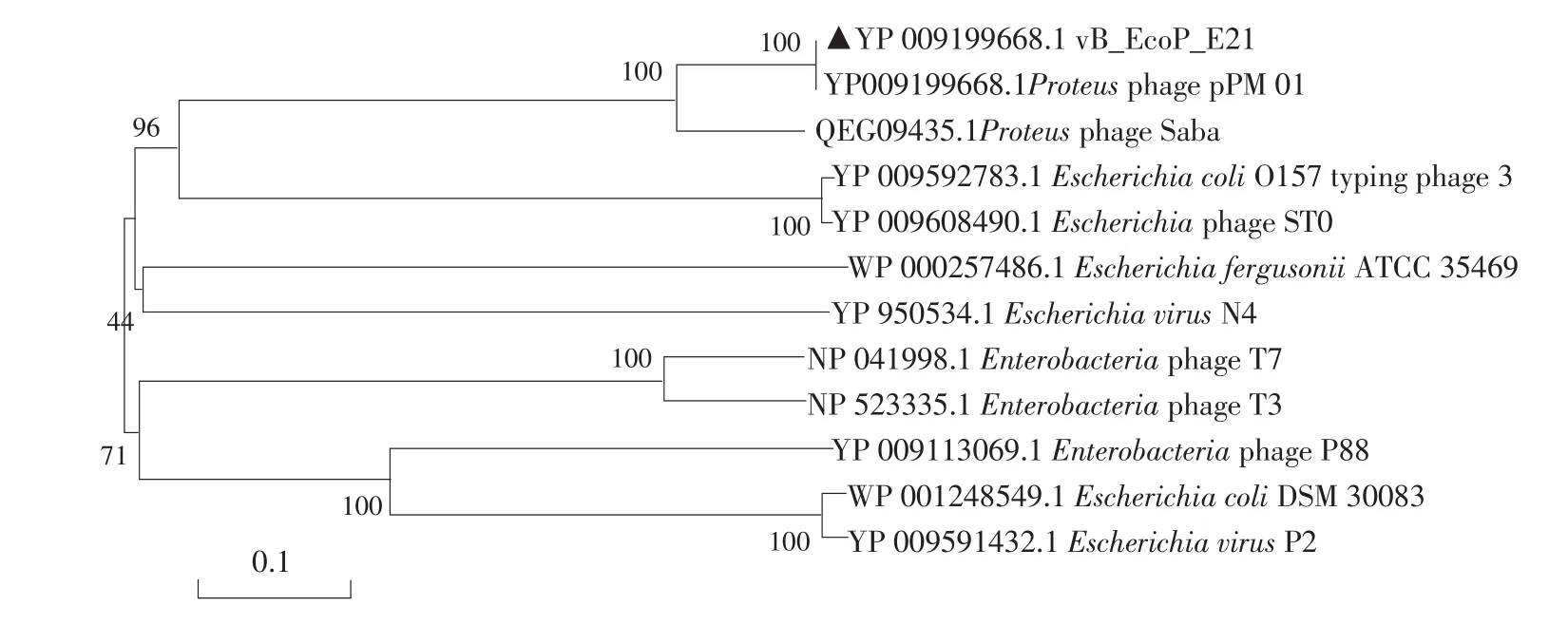
图5 基于噬菌体vB_EcoP_E21主要衣壳蛋白构建同源进化树Fig.5 Based on the major capsid protein showing the neighbor-joining phylogenetic tree of phage vB_EcoP_E21

3 讨论与结论
养殖场污水是目前分离动物致病菌噬菌体最佳来源,尤其是曾发生过宿主菌感染的养殖场,噬菌体分离成功率更高[11]。研究表明,噬菌体在污水中分离成功率(23.8%)高于粪便(2.7%),温暖季节(6~8月)分离成功率(32.1%)高于寒冷季节(未分离出)[12]。本研究在养殖场污水中分离一株裂解性噬菌体vB_EcoP_E21,根据透射电镜观察其头部直径约为50 nm,尾部长度约为10 nm,符合短尾噬菌体特点。短尾噬菌体(14%)、长尾噬菌体(61%)和肌尾噬菌体(25%)共同构成有尾噬菌体目,绝大多数噬菌体(96%)均属于有尾噬菌体。一般来说,所选宿主菌和噬菌体来源不同,可分离筛选出不同噬菌体。付丽娜以猪源ETEC为宿主菌,在大连养殖场污水中分离出2株长尾裂解性噬菌体[13];周艳等以禽源ETEC为宿主,分离出一株肌尾T4样裂解性噬菌体[14]。
噬菌体宿主特异性主要取决于其尾部专一性结合蛋白与细菌表面受体的结合,宿主菌细胞壁、荚膜、菌毛或鞭毛上存在特异性受体,这些受体以蛋白质、多糖或脂多糖形式存在,受体在细胞表面分布、密度对噬菌体特异性和裂解谱发挥重要作用。本研究噬菌体vB_EcoP_E21可裂解养殖场分离的大肠杆菌(6、8、11、F1、F2和13)临床分离株及大肠杆菌O157、12588和236等标准菌株,但对STEC 10668、志贺氏菌属、沙门氏菌属及变形杆菌属菌株无裂解作用,说明该噬菌体对大肠杆菌具有较宽裂解谱,同时也具有较强宿主专一性。
噬菌体和宿主菌浓度对噬菌体发挥裂解作用有重要影响。本研究中,噬菌体vB_EcoP_E21的OMOI为0.1,表明噬菌体在裂解细菌时所需数量较少,且实际应用中较低MOI会降低纯化及应用成本。一步生长曲线可揭示噬菌体在感染宿主菌时活动规律,还可计算潜伏期、爆发期、裂解量等参数,噬菌体vB_EcoP_E21潜伏期和爆发期均为20 min,裂解量为370 PFU·cell-1,表明该噬菌体与宿主菌吸附直至下一代噬菌体合成所需时间较短,增殖效率高。目前报道大肠杆菌噬菌体潜伏期为10~30 min,爆发期60~120 min,裂解量研究结果差异较大[15-17]。
噬菌体吸附宿主菌过程极易受外界因素影响,尤其是以水、空气、饲料等为媒介的复杂养殖环境。因此,研究噬菌体对环境温度及pH稳定性具有重要意义。大多数研究表明,噬菌体吸附最佳温度为30~45℃,当温度超过50℃,吸附受到抑制,也有研究结果显示,革兰氏阳性菌噬菌体特异性受体为细胞表面糖类,温度较低时也可吸附。本研究分离噬菌体vB_EcoP_E21对温度有较强稳定性,温度40~60℃活性基本保持稳定,当温度达70℃以上时,活性受到抑制。由于在酸性环境下蛋白质易变性,噬菌体活性受到抑制,断奶仔猪采食前胃pH 1~2,采食后快速升至4~5,要求噬菌体具有较高酸度耐受性。目前大多数研究表明,噬菌体最佳pH为5~7,而且大多数噬菌体可耐受pH 3~4或8~9,当pH 1~2或高于10时噬菌体失活[12],本文结果与上述研究一致,在pH 4~10内噬菌体活性保持不变,当pH为2或12时,噬菌体失活[12,18-19]。
在噬菌体浓缩或纯化时,需加入氯仿去除细菌碎片等杂质,某些噬菌体衣壳或尾丝中含有脂类物质,氯仿脂溶性破坏噬菌体结构,影响噬菌体活性。本研究分离噬菌体在氯仿处理前后效价无显著差异,说明噬菌体vB_EcoP_E21衣壳或尾丝中不含脂类物质,后续提取基因组试验操作可加入氯仿处理。
相对于细菌而言,噬菌体全基因组较小,且结构简单。截至2020年3月,NCBI上公开噬菌体基因组完整序列近33 000条(www.ncbi.nlm.nih.gov/genome/browse#!/overview/),其中大肠杆菌噬菌体833条,这些基因组序列长度集中在3.4~316 kb。噬菌体vB_EcoP_E21全基因组长度为58 536 bp,(G+C)%含量为46.89%,无明显GC偏向性,非编码RNA为0,不含tRNA,无相关抗生素耐药基因和毒力因子,代表该噬菌体在基因水平上的安全性。该噬菌体基因组有66个开放阅读框(ORFs),其中23个(占34.8%)为已知功能编码序列(CDS),其余均为未知功能假定蛋白(占65.2%),说明该噬菌体大部分基因组序列功能尚不清楚。通过噬菌体CDS序列比对分析,可将功能基因分为3部分,分别为噬菌体结构和包装基因、DNA复制及调控基因与宿主裂解功能基因。其中与噬菌体结构和包装功能相关基因有头尾连接蛋白,结构域蛋白,尾丝蛋白,卷尺蛋白,结构蛋白和衣壳蛋白等。噬菌体吸附主要发生在尾部特有结合蛋白与细菌表面特殊受体结合,本研究预测6个尾丝蛋白序列;噬菌体末端酶是由大、小亚基组成的异源寡聚体,编码大、小亚基的基因序列通常为相邻或为重叠基因,在噬菌体包装过程中发挥重要作用[20],末端酶大亚基是多功能酶,可特异性结合噬菌体衣壳孔蛋白、金属离子和ATP,在溶液中以单体形式存在,具有ATP酶、核酸内切酶和DNA解旋酶活性[21];小亚基可特异性识别与结合噬菌体核酸及ATP,在溶液中以寡聚体形式存在并呈双层环状排列,末端酶、噬菌体DNA及门蛋白共同构成噬菌体包装机制,在包装过程中相互协调,缺一不可[20]。本研究预测末端酶大、小亚基为相邻基因编码序列,其中大亚基由675个氨基酸组成,小亚基由194个氨基酸组成,但未预测到门蛋白序列;衣壳蛋白不仅保护噬菌体本身遗传信息的传递,且在噬菌体组装、感染等过程发挥重要作用,预测该噬菌体的衣壳蛋白由355个氨基酸组成。
有尾噬菌体可在复制晚期诱导宿主菌编码合成裂解酶,用于水解细胞壁肽聚糖层,但大部分噬菌体裂解酶由于缺少信号肽而无法穿透细胞膜,需穿孔素协同作用裂解宿主菌,形成穿孔素/裂解酶体系。穿孔素是一种在侵染晚期阶段合成的小分子极性跨膜蛋白,可在细胞膜上形成稳定跨膜孔,裂解酶可通过跨膜孔达到细胞壁水解肽聚糖层,达到释放子代噬菌体目的,该噬菌体预测出两个裂解酶基因,分别由234和104个氨基酸组成,但未预测出穿孔素蛋白序列,其作用机理需深入研究。
为进一步说明噬菌体进化关系,选用噬菌体保守且具有进化意义序列如末端酶大亚基、主要衣壳蛋白或尾丝蛋白构建同源进化树,本研究选用末端酶大亚基和主要衣壳蛋白序列构建同源进化树,且比较全基因组序列,结果发现噬菌体vB_EcoP_E21与变形杆菌噬菌体Proteus phage P16-2532、PM87、pPM 01和Saba亲缘关系较近,与大肠杆菌噬菌体lambda、T4、T1、T5和T7等亲缘关系较远,且变形杆菌噬菌体P16-2532、PM87、pPM 01和Saba均属于长尾噬菌体科,从宿主谱中也可见噬菌体vB_EcoP_E21无法侵染变形杆菌标准菌株,需进一步鉴定并开展机制机理研究。
与传统抗生素相比,噬菌体疗法存在特异性强、增殖能力强、研发周期短及成本低等优势,但实际应用存在一定局限性,如噬菌体裂解谱较窄、缺乏安全高效给药方式、难以确定最佳剂量等,因此深入研究噬菌体剂型、给药途径、安全性等问题是今后研究重点。本研究已对分离ETEC噬菌体作生物学特性和全基因组分析,将继续在动物应用、剂型选择及安全性等方面开展研究,使噬菌体成为理想抗生素替代品,在防控动物细菌性感染方面发挥作用。
