大豆玉米间作体系溶磷菌筛选及影响因素研究
2020-07-01朱思沅刘晓峰
王 浩,朱思沅,刘晓峰
(东北农业大学生命科学学院,哈尔滨 150030)
磷是植物生长发育必需的三大营养元素之一[1],是植物体内有机化合物重要组成,可提高植株抗逆性,在果实发育中具有重要作用[2]。我国土壤中含丰富磷素,但95%磷因与土壤中Fe3+、Ca2+、Al3+结合形成化合物而丧失有效性,导致施入磷肥当季利用率仅5%~25%[3]。为满足植物所需营养元素,往往长期施用过量化肥,由此造成土壤板结,且过量磷肥经雨水冲刷进入河流后引发水体富营养化等问题[4]。
“植物内生菌”是可在植物细胞内或细胞之间定植的微生物,且可与宿主植物建立稳定联系[5]。溶磷菌可将土壤中难溶磷通过一系列生理生化反应变成植物可利用磷。大多数植物内生菌具有促进宿主植物生长能力,并可溶解无机磷。黄静等从油菜和玉米中筛选得到多株具溶磷作用的植物内生促生细菌[6]。郑燕玲选用溶磷圈法从石斛兰中筛选出解磷菌,发现其中有两株真菌和10株细菌具有解磷能力[7]。
间作即为同一块土地上种植两种或多种作物[8],可利用有限土地资源获得更大产量。豆科与禾本科作物间作,由于种间促进及生态位互补作用,是一种理想间作模式。禾本科作物需氮量较大,可为豆科作物提供较低的氮素土壤环境,有利于促进豆科作物共生固氮作用,同时也提高禾本科作物氮素利用效率[9]。其中,大豆与玉米间作是常见间作模式[10],可提高玉米产量,虽然两种作物存在竞争关系,但在合适培养环境下,大豆产量并未降低。本研究拟从间作体系中分离得到内生溶磷菌,旨在探究大豆玉米间作体系中内生溶磷菌分布情况,进而分离对两种作物均有适用性的菌株,运用此菌种制作菌剂,有望代替部分普通化学肥料,通过开发以溶磷菌为功能菌种的生物缓释磷肥应用于大豆和玉米生产,为减少该体系中化肥施用量探索新途径。在作物不同组织部位分离内生菌,可为生物肥料施用部位提供新思路。
1 材料与方法
1.1 菌株来源
溶磷菌分离自东北农业大学实验实习与示范中心向阳基地3行大豆3行玉米间作体系(行距为60 cm),大豆品种为东富1号,玉米品种为吉农大。采样时期为大豆初花-玉米苗期,分别随机采集大豆及玉米植株各3株,置于冰上保鲜至实验室,样品根部经流水清洗表面泥土后用纸巾吸干表面水分。取大豆及玉米根、茎、叶组织,经95%酒精处理30 s后用次氯酸钠(3.5%)处理4 min,大量无菌水反复冲洗7次。组织样品经表面消毒后,研磨,生理盐水制成浓度系列梯度至10-6,取10-3、10-4、10-5和10-6等4个浓度梯度200 μL稀释液涂平板,每个浓度3个重复。
1.2 培养基
无机磷液体培养基:Glucose 10.0 g;(NH4)2SO40.5 g;MgSO4·7H2O 0.3 g;Ca3(PO4)210 g;NaCl 0.3 g;MnSO4(1%溶液)1 mL;FeSO4(1%溶液)1 mL;Agar 20 g;Deionized H2O 1 000 mL。
牛肉膏蛋白胨培养基:牛肉膏3 g;蛋白胨 10 g; NaCl 5 g; Agar 17.5 g; Deionized H2O 1 000 mL。
无机磷固体平板培养基:Glucose 10.0 g;(NH4)2SO40.5 g;MgSO4·7H2O 0.3 g;Ca3(PO4)210 g;NaCl 0.3 g;MnSO4(1%溶液)1 mL;FeSO4(1%溶液)1 mL;Agar 20 g;Deionized H2O 1 000 mL。
1.3 钼锑抗比色法
所用药品包含:浓硫酸、钼酸铵、0.5%酒石酸锑钾溶液、抗坏血酸、Tris、Na2EDTA·2H2O、纯乙酸、NaOH、1 mol·L-1Tris-HCl Buffer(pH 8.0)、0.5 mol·L-1EDTA(pH 8.0)、(NH4)2SO4、MnSO4、MgSO4· 7H2O、Ca3(PO4)2、 FeSO4、 NaCl、牛肉膏、蛋白胨、葡萄糖、琼脂、蔗糖、磷标准溶液等。
1.4 溶磷菌平板筛选
根据常规细菌分离法将菌悬液涂布在无机磷培养基中[11],待菌落长出后,挑取培养基上菌落较大、生长快、具有明显溶磷圈菌株,划线法涂布在新无机磷培养基中,直至得到纯单个菌落,用牛肉膏蛋白胨试管斜面4℃保存。
1.5 磷标准曲线测定
取7支50 mL容量瓶,编号0~6号,分别加入0、15、30、45、60、75和90 μL磷标准溶液,再加入2滴2,4-二硝基苯酚作指示剂,5 mL钼锑抗显色,最后去离子水定容至刻度,混匀。使用酶标仪(品牌Thermo,型号Multiskan Sky),在720 nm波长下,以0号溶液为对照,分别测定各管溶液吸光度值,且每个管重复操作3次,校正吸光值为吸光度测定值减去对照管测定值。
1.6 溶磷能力测定
在OD720=0.8,取菌悬液100 μL加入50 mL无机磷液体培养基中,摇床150 r·min-1,28℃培养15 d后4 000 r·min-1,28 ℃离心20 min,取上清液,利用钼蓝比色法在酶标仪OD=720 nm处测定吸光度。
1.7 菌株分子生物学鉴定
1.7.1 内生溶磷菌株培养与基因组DNA提取
将试验对象菌株培养至对数期,取300 μL菌液于1.5 mL离心管,12 000 r·min-1离心2 min,弃上清液,于沉淀中加入提取液300 μL(提取液:25%chelex-100,0.5%NP40,TE配制,pH 8.0~9.0),56℃孵育30 min,100℃水浴10 min,取出后12 000 r·min-1离心2 min,取上清液,即为DNA。取DNA样品1 μL,琼脂糖电泳检测合格后用于后续试验。
1.7.2 目标16S rDNA产物扩增和序列分析
本试验采用PCR引物27F(5'AGAGTTTGATC CTGGCTCAG 3')和 1492R(5'TACGGHTACCTTGT⁃TACGACTT 3')。PCR条件参考蒋国彪等方法[4]。
将PCR扩增产物作电泳检测,确定其是否为目标片段,将目标DNA片段溶液委托苏州泓迅生物科技有限公司测序,将序列提交NCBI GenBank数据库,在线比对,下载相近种属模式菌株序列,采用Mega 5.0软件Neighbor-joining算法构建系统发育树。
1.8 不同因素对内生菌溶磷效果的影响
1.8.1 不同碳源对细菌溶磷能力的影响
选用5种不同碳源:淀粉、乳糖、葡萄糖、蔗糖、麦芽糖,培养基中其他成分及含量不变。分别将上述培养基加入100 mL锥形瓶,装液量为50 mL。每份培养基中接入1.5 mL菌液,同一处理3个重复。置于摇床内,150 r·min-128℃条件下,培养96 h后将菌液10 000 r·min-1离心,取其上清液按照钼锑抗比色法测定样品中有效磷增量,取3次重复平均值。
1.8.2 不同氮源对细菌溶磷能力的影响
选用5种不同氮源:硝酸钠、氯化铵、碳酸氢铵、尿素、硫酸铵,培养基中其他成分及含量不变。分别将上述培养基加入到100 mL锥形瓶,装液量为50 mL。每份培养基中接入1.5 mL菌液,同一处理3个重复。置于摇床内,150 r·min-128℃条件下,培养96 h后将菌液10 000 r·min-1离心,取其上清液按照钼锑抗比色法测定样品中有效磷增量,取3次重复平均值。
1.8.3 pH对细菌溶磷能力的影响
改变液体培养基pH,设定5个不同值:5、6、7、8、9,且不改变培养基中其他成分及含量。将不同pH培养基分别添加到100 mL锥形瓶,装液量为50 mL,每份培养基中接入1.5 mL菌液,同一处理3个重复。置于摇床内,150 r·min-128℃条件下,培养96 h后将菌液10 000 r·min-1离心。钼锑抗比色法测定上清液样品中有效磷增量,取3次重复平均值。
1.8.4 温度对细菌溶磷能力的影响
在100 mL锥形瓶中,装入50 mL液体培养基,再接入1.5 mL菌液,同一处理设置3个重复。设置5种不同摇床温度:20、25、30、35和40℃,150 r·min-1摇床,培养96 h后将菌液10 000 r·min-1离心。钼锑抗比色法测定上清液样品中有效磷增量,取3次重复平均值。
1.8.5 培养时间对细菌溶磷能力的影响
在100 mL锥形瓶中,装入50 mL液体培养基,再接入1.5 mL菌液,同一处理设置3个重复。置于摇床内,选择5个不同培养时间(48、96、144、192和240 h)培养,完成后将菌液10 000 r·min-1离心。钼锑抗比色法测定上清液样品中有效磷增加量,取3次重复平均值。
1.8.6 磷酸盐浓度对细菌溶磷能力的影响
将培养基中磷酸钙含量分别设为:4~8 g·L-1,浓度间隔为1 g·L-1。培养基中其他成分及含量不变。分别将不同磷酸钙含量培养基加入100 mL锥形瓶,装液量为50 mL,每份培养基中接入1.5 mL菌液,同一处理3个重复。然后将其置于摇床内,选择150 r·min-1和28℃条件下培养,培养96 h后将菌液10 000 r·min-1离心。取其上清液按照钼锑抗比色法测定样品中有效磷增量,取3次重复平均值。
2 结果与分析
2.1 溶磷菌筛选
大豆根、茎、叶中分离的内生菌株溶磷圈不明显。玉米根、茎、叶中分离到35株具有溶磷效果的菌株。
2.2 各菌株对难溶性磷酸盐溶解能力测定结果
将初步筛选得到的35株菌株分别接入无机磷液体培养基中,28℃150 r·min-1摇床培养15 d后测定其有效磷含量,测得Y-18溶磷效果最强,为447.59 mg·L-1°
2.3 菌株Y-18鉴定
2.3.1 部分生理生化性状
鉴定Y-18菌株生理生化性状分析及遗传学,其部分生理生化性状见表1。

表1 Y-18生理生化鉴定结果Table 1 Physiological and biochemical identification results of strain Y-18
2.3.2 遗传学鉴定
Y-18测序比对结果为罗旺醋杆菌(Acetobacter lovaniensis),构建Acetobacter属内系统发育树,结果见图1。

图1 采用临近法构建Y-18与相近参比菌株16S rRNA基因系统发育树Fig.1 Neighbour-joining tree showing the phylogenetic relationships of strain Y-18 and phylogenetically related reference strains based upon the 16S rRNA gene
2.4 不同因素对菌株Y-18溶磷能力的影响
2.4.1 不同碳源对菌株Y-18溶磷能力的影响
由图2可知,当碳源为葡萄糖时,菌株Y-18具有最大溶磷能力,达411.40 mg·L-1,与其他碳源相比具有明显优势,初步表明碳源变化对菌株Y-18溶磷能力的影响尤为显著。

图2 不同碳源对Y-18溶磷能力的影响Fig.2 Effects of different carbon sources on the phosphorous solubility of Y-18
2.4.2 不同氮源对菌株Y-18溶磷能力的影响
结果见图3。
由图3可知,当氮源为硫酸铵时,菌株Y-18具有最大溶磷能力,达521.60 mg·L-1,且与其他氮源相比具有明显优势,初步表明氮源变化对菌株Y-18溶磷能力影响较为显著。

图3 不同氮源对Y-18溶磷能力的影响Fig.3 Effects of different nitrogen sources on the phosphorous soluble capacity of Y-18
2.4.3 不同温度对菌株Y-18溶磷能力的影响
由图4可知,培养温度为25℃时,菌株Y-18具有最大溶磷能力,达323.65 mg·L-1。当温度超过25℃,菌株Y-18溶磷能力明显下降,30℃后在一定范围内保持稳定。由此可初步判断,25℃条件下菌株Y-18溶磷能力最强。
2.4.4 不同磷酸盐含量对菌株Y-18溶磷能力的影响
由图5可知,培养基中难溶性磷酸盐含量为7g·L-1时,菌株具有最大溶磷能力,达378.14mg·L-1,与其他含量相比优势明显,初步表明培养基中难溶性磷酸盐含量变化对菌株Y-18溶磷能力影响显著。
2.4.5 不同培养时间对菌株Y-18溶磷能力的影响
由图6可知,培养时间为3 d时,菌株Y-18具有最大溶磷能力,达329.28 mg·L-1,但与5 d相比差异较小,初期随培养时间延续,菌株Y-18溶磷能力随之提高,幅度明显,而培养时间超过3 d后,菌株Y-18溶磷能力提高幅度有限,可初步判断3 d为菌株Y-18最佳培养时间,72 h后培养时间延续对于菌株Y-18溶磷能力的影响微弱。

图4 不同温度对Y-18溶磷能力的影响Fig.4 Effects of different temperatures on the phosphorous solubility of Y-18
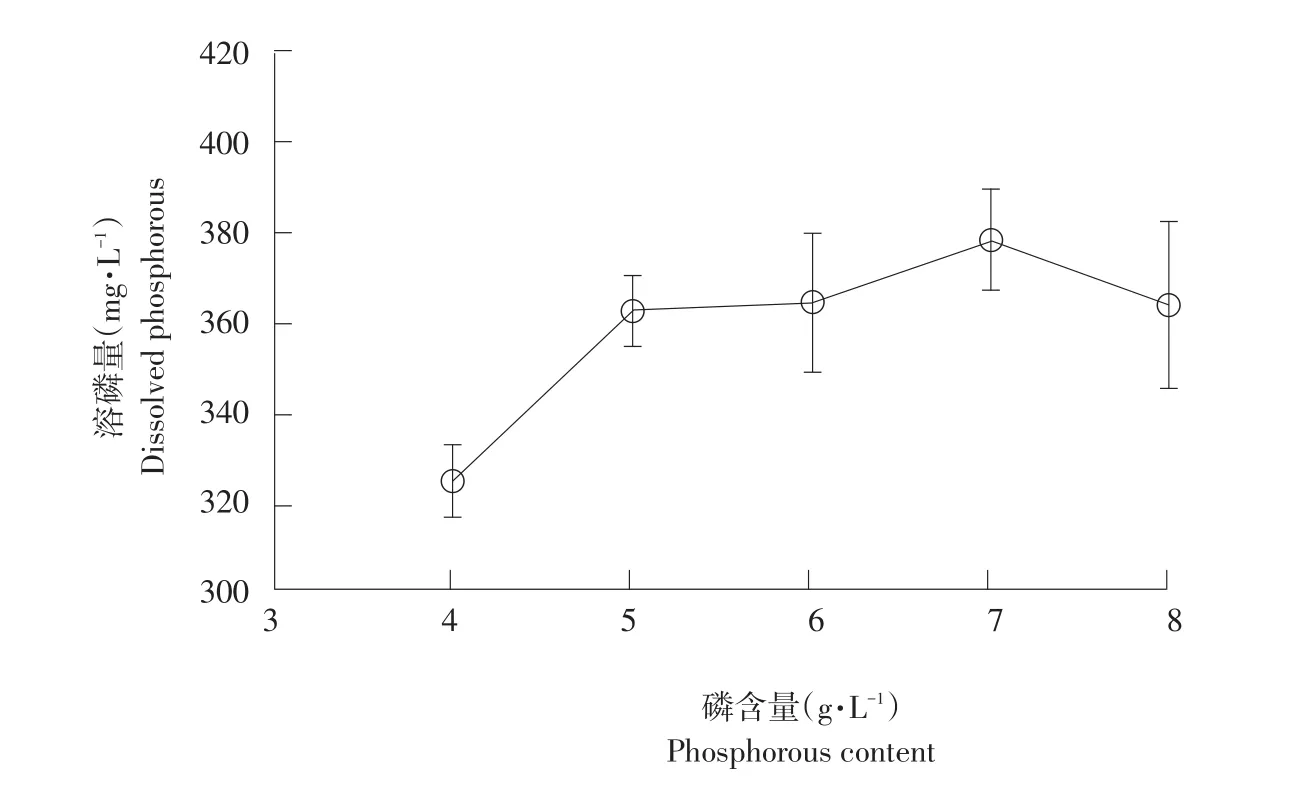
图5 不同磷酸盐含量对Y-18溶磷能力的影响Fig.5 Effects of different phosphate contents on the phosphorous solubility of Y-18

图6 不同培养时间对Y-18溶磷能力的影响Fig.6 Effect of different culture times on the phosphorous soluble capacity of Y-18
2.4.6 不同pH对菌株Y-18溶磷能力的影响
由图7可知,培养基pH为5时,菌株Y-18具有最大溶磷能力,达141.23 mg·L-1,随培养基pH升高,菌株Y-18溶磷能力随之降低,尤其是pH升至8时,下降幅度较大。而pH超过8后,菌株溶磷能力略上升。从图中可初步判断,即pH 5为菌株Y-18最佳培养pH,且pH变化对菌株Y-18溶磷能力影响较显著。

图7 不同pH对Y-18溶磷能力的影响Fig.7 Effects of different pH values on the phosphorous solubility of Y-18
3 讨论与结论
磷元素作为土壤中最难吸收营养元素之一[12],提高磷吸收转化率非常重要,本试验在大豆玉米间作体系中的玉米根、茎、叶中分离得到内生溶磷菌35株,并从中溶磷筛选得到1株溶磷效果最佳菌株Y-18,溶磷量可达447.59 mg·L-1。溶磷菌平均溶磷量8.88~575.3 mg·L-1[13-14],因此Y-18溶磷量属于较高水平。此株高效溶磷菌株为罗旺醋杆菌(Acetobacter lovaniensis)。姜晓芝研究表明,醋酸菌最适pH 3.5~6.5,最适温度30℃[15]。本试验结果Y-18溶磷效果最适pH 5,最适温度25℃,与其相符,且与王斌等革兰氏阴性菌鉴定结果一致[16]。溶磷菌鉴定结果为醋酸菌的研究较少,下一步将探究此类菌属溶磷机理。
本试验中,通过固体无机磷平板初筛溶磷圈直径与钼锑抗比色法测定的溶磷量具有不完全一致性,溶磷圈最大菌株在钼锑抗比色法测定中溶磷量并非最高。赵越等在解磷菌特性研究中指出可通过固体培养基观察溶磷圈,该定性分析方法具有一定局限性,液体培养下定量分析更合理[17]。培养时间超过3 d时,Y-18溶磷能力已呈下降趋势,即使有一定幅度上升但非峰值,由于培养时间过于紧密,且有下降再上升情况,应将培养时间延长,改善后续试验。在筛选溶磷菌时,本试验参考方志轩培养时间15 d[5],后期针对Y-18探究培养时间单因素时发现可适当减少培养时间;由于菌株种属特点,其溶磷能力在pH 5时最大,并随pH增加而减小;在磷酸钙含量7 g·L-1达到最大,含量过小无法有效激活Y-18溶磷力,过大时因磷酸钙是微溶物使培养基内沉淀过多。本试验在初步筛选高效溶磷菌时,采用培养条件为:碳源为葡萄糖,氮源为硫酸铵,pH 7,培养温度为28℃,磷酸盐含量为7.28 g·L-1,此时溶磷量达447.59 mg·L-1。在本试验研究基础上,优化培养条件,可进一步提高Y-18菌株溶磷量。
目前从作物根际土壤中分离到具有溶磷能力的内生菌大多数为假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、草生欧文氏菌(Erwinia herbico⁃lav)和成团泛菌属(Pantoea agglomerans)等[18]。本试验发现具有高效溶磷能力的罗旺醋酸杆菌,在以往研究中报道较少。醋酸杆菌最适pH偏酸性,东北地区土地多为弱酸性,如何在实际应用中最大限度发挥该菌株溶磷效果具有重要意义。
