层粘连蛋白调控奶牛乳腺上皮细胞乳蛋白合成途径研究
2020-07-01王春梅王保胜门晶晶
王春梅,王保胜,门晶晶,赵 锋
(东北农业大学乳品科学教育部重点试验室,哈尔滨 150030)
乳腺导管上皮细胞和腺泡上皮细胞附着于基底膜(Basement membrane,BM)的细胞外基质(Extracellular matrix,ECM)上。乳腺组织局部上皮发生细胞与细胞外基质相互作用及上皮与间质之间长距离通讯对乳腺发育和功能具有重要作用[1-2]。在乳腺发育阶段,ECM蛋白和重塑酶表达在时间、空间上受严格调控。原位杂交和免疫荧光试验表明,I型胶原、IV型胶原和层粘连蛋白-γ 2链表达和沉积与青春期、妊娠期乳腺上皮细胞(Mammary gland epithelial cells,MECs)增殖及间质侵袭有关[3]。与其在导管伸长过程中作用一致,I型胶原蛋白主要位于乳腺导管内,而IV型胶原蛋白和层粘连蛋白(Laminin,LN)则集中在端芽附近和腺泡周围,表明这些ECM成分有助于正常腺泡生成和功能分化[3]。作为ECM主要受体,整联蛋白将ECM与细胞骨架和信号通路相关联,建立ECM-整联蛋白信号轴。整联蛋白作为微环境感受器控制细胞表型和命运决定。有条件地敲除乳腺腺泡基底侧细胞整联蛋白β1使上皮细胞丧失再生能力,并损害妊娠期导管分支和小叶腺泡发育,表明整联蛋白介导的ECM信号对于正常组织形态发生十分必要[4]。
催乳素(Prolactin,PRL)是正常MECs增殖和分化以及乳汁生成刺激所需垂体激素。PRL与MECs细胞膜表面催乳素受体(Prolactin receptor,PRLR)结合,激活JAK2-STAT5信号途径,继而调控乳腺细胞信号转录反应,即促进与分化相关基因和编码牛乳蛋白(如β-酪蛋白)基因转录,而STAT5持续激活需整联蛋白β1-层粘连蛋白相互作用[5]。
作为一种细胞外基质,LN可影响其细胞表面受体整联蛋白β1表达水平,通过其潜在信号枢纽作用增强BMECs对PRL信号应答水平,上调β-酪蛋白蛋白合成[6]。报道指出,ILK与Rho GTPase家族成员(Rac1,cdc42等)均是整联蛋白转导过程中关键节点[7-8]。整联蛋白无法直接与Rac1结合,但招募信号和接头蛋白,调节Rac1(与其他GTPase)激活。目前对整联蛋白在MECs分化过程中如何控制GTPase功能研究较少。在分化MECs中,ILK已被确认为连接整联蛋白和Rac1激活。利用富含层粘连蛋白基膜(Laminin-rich basement membrane,lrBM)开展体外三维培养时,妊娠期MECs中ILK缺失,抑制细胞分化与乳蛋白合成。ILK-/-MECs降低Rac1激活,且在PRL处理时无法刺激JAK2/STAT5信号传导[9]。乳腺特异性缺失Rac1基因不影响青春期或妊娠期腺体发育[10],用Rac1抑制剂NSC23766处理乳腺组织器官型培养物可抑制导管分支[11],表明器官型培养难以完全概括体内乳腺发育。Rac1缺失推迟乳腺退化,则归因于溶酶体介导的凋亡和乳腺退化启动所必需STAT3激活延迟[12-13]。
小鼠乳腺研究发现,细胞-ECM相互作用调控乳腺发育分化,整联蛋白介导这一调控作用[4]。但奶牛乳腺发育分化中,细胞-ECM相互作用以及整联蛋白介导的相关机制尚不明确。本研究利用transwell细胞培养模型,模拟机体内细胞所处极性环境,获得奶牛乳腺上皮细胞功能调控试验模型。通过在小室内包被不同蛋白成分(BSA、LN、Matrigel)作为细胞培养底物,在分化培养液诱导下,检测整联蛋白β1及其下游信号分子ILK与Rac1表达变化,揭示LN调控泌乳分化重要作用和信号途径。通过添加AIIB2抗体调控整联蛋白β1活性,确定整联蛋白β1及下游信号分子介导细胞-LN相互作用调控乳蛋白合成机制。研究为进一步揭示LN如何参与经典的泌乳调控信号途径,了解其泌乳分化阶段作用提供新见解。
1 材料与方法
1.1 材料
1.1.1 细胞
本试验采用健康泌乳期中国荷斯坦奶牛乳腺组织作为试验原材料,胶原酶消化法分离培养奶牛乳腺上皮细胞。奶牛乳腺上皮细胞经纯化培养后角蛋白18(Cytokeratin 18,CK18)鉴定与肌球蛋白重链11(Myosin heavy chain 11,MYH11)检测。
1.1.2 试验试剂
胎牛血清购自加拿大WISENTING公司;DMEM/F12、0.25%胰酶-EDTA消化液购自Gibco公司;Laminin、牛胰岛素、牛血清白蛋白购自美国Sigma公司;氢化可的松、膜再生液、蛋白上样缓冲液购自北京Solarbio公司;催乳素购自美国Abcam公司;SDS-PAGE快速凝胶试剂盒购自上海碧云天公司;ILK和Rac1购自美国CST公司;CSN2购自英国Biorbyt;AIIB2购自美国DSHB公司;Prime ScriptTMRT Reagent Kit with gDNA Eraser和TB GreenTMPremix Ex TaqTMⅡ购自大连TaKaRa公司。
1.2 方法
1.2.1 原代奶牛乳腺上皮细胞CK18鉴定及MYH11阳性细胞检测
对分离培养纯化后细胞作CK18鉴定及MYH11阳性细胞检测,确定是否为奶牛乳腺上皮细胞及其纯度是否可用于后续试验。制作细胞爬片,将细胞悬液以适当浓度接种于无菌盖玻片六孔板中,待细胞生长至60%~70%时,弃去培养液,预冷PBS漂洗3×5 min,4%多聚甲醛固定10 min,PBST(0.1%Tween-20)漂洗3×5 min,5%BSA(PBST)37℃封闭1 h,弃去封闭液,以1∶200加入AF488标记的CK18及MYH11抗体,4℃避光过夜。PBST漂洗3×5 min,加入1 μg·mL-1DAPI细胞核染色10 min。弃去DAPI染液,PSBT漂洗3×5 min。洁净载玻片上滴加适量抗荧光淬灭剂,将载玻片取出,滤纸吸取载玻片上多余液体,倒置在抗荧光淬灭剂处,避免产生气泡,指甲油封边。激光共聚焦显微镜检测CK18和MYH11荧光信号。
1.2.2 不同基质上培养细胞
将细胞以适当浓度接种在预先分别包被BSA 30 μg·mL-1、LN 30 μg·mL-1与 Matrigel 1∶100 的transwell上室内,添加无血清培养基至1.5 mL,下室添加完全培养基2.6 mL。置于37℃,5%CO2培养箱内培养,待细胞生长至80%~90%汇合,上下室内培养基均更换为无血清培养基饥饿培养12 h,下室培养液更换为HIP分化培养液分化处理24 h。
1.2.3 细胞的AIIB2阻断培养
将细胞以适当浓度接种在预先分别包被BSA 30 μg·mL-1、LN 30 μg·mL-1与 Matrigel 1∶100 的transwell上室内,添加无血清培养基至1.5 mL,下室添加完全培养基2.6 mL。置于37℃,5%CO2培养箱内培养,待细胞生长至80%~90%汇合,上下室内培养基均更换为无血清培养基,饥饿培养12 h,下室培养液更换为HIP分化培养液并分别添加AI⁃IB2抗体和同型IgG处理24 h。
1.3 荧光定量PCR
细胞处理24 h后,弃去培养液,预冷PBS洗涤两次,采用Trizol法提取细胞总RNA,使用核酸检测仪测定总RNA的OD260/280值与浓度。其OD260/280值在1.8~2.0,说明纯度较高,可用于后续试验。应用Prime ScriptTMRT reagent Kit反转录试剂盒,将RNA反转录为cDNA。根据合成引物序列使用TB GreenTMPremix Ex TaqTMⅡ试剂盒,作qRT-PCR反应检测相关基因表达量,引物由上海生物工程有限公司合成,引物序列:ITGB1,F:5'TCAAATC CAGCCACAGCAGC3', R: 5'CCGTGTCACATTCCAC CAAC3';CSN2,F:5'CCCTAACAGCCTCCCACA3',R:5'AGCCATAGCCTCCTTCAC3';β-actin,F:5'CTG TCCCTGTATGCCTCTG3',R:5'AT GTCAC GCACG ATTTCC3'。RT-PCR反应程序95℃,30 s预变性。95℃,5 s;60℃,30 s;40个循环。根据ct值,以β-actin为内参,采用2-ΔΔCt法计算目的基因试验组与对照组相对表达量,根据样本相对表达量分析差异显著性。
1.4 蛋白免疫印迹
各组细胞培养处理后弃去培养液,PBS清洗2次,向小室内各加入100 μL细胞裂解液,反复吹打数次,直至细胞完全裂解。冰上放置5 min,将细胞裂解液转移至1.5 mL离心管,12 000 r·min-14℃离心15 min。将上清液转移至新1.5 mL EP管,加入适量上样缓冲液,煮沸10 min,用于后续检测。各组蛋白样品加入配制SDS-PAGE上样孔中,电泳分离。
根据蛋白Marker,将目的蛋白转移至适宜NC膜,TBST配制5%脱脂奶粉对NC膜非特异性封闭2 h,将NC膜置于一抗中4℃摇床孵育过夜,隔日,取出TBST漂洗3次,每次10 min,置于二抗中37℃摇床孵育2 h。取出TBST漂洗3次,每次10 min。将NC膜置于凝胶成像仪中,均匀滴加超敏发光液,曝光获取蛋白条带,使用imagine Proplus 6.0读取蛋白灰度值。
1.5 统计分析
试验3次重复,使用SPSS 21.0分析试验数据显著性;使用GraphPad Prism 8作图。数据均以平均值±标准差表示,样本间差异比较作t检验或单因素方差分析,*为差异显著(P<0.05),**为差异极显著(P<0.01)。
2 结果与分析
2.1 奶牛乳腺上皮细胞生物学特性鉴定
胶原酶消化法获得奶牛乳腺上皮细胞,纯化培养后,通过免疫细胞荧光对其作CK18和MYH11检测。CK18在奶牛乳腺上皮细胞中特异性表达,激光共聚焦显微镜检测如图1所示,绿色荧光为CK18,蓝色荧光为细胞核。拉丝状细胞骨架CK18信号阳性表达率表明已获得纯化奶牛乳腺上皮细胞。MYH11为腺泡肌上皮细胞分子标志,检测结果如图2所示,并未检测到MYH11阳性信号,表明分离培养纯化后所获得细胞为具有泌乳潜能的腺泡腔上皮细胞,可用于后续泌乳诱导试验。
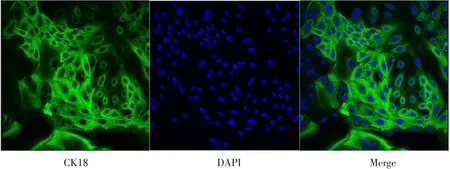
图1 奶牛乳腺上皮细胞CK18鉴定Fig.1 Identification of CK18 in BMECs
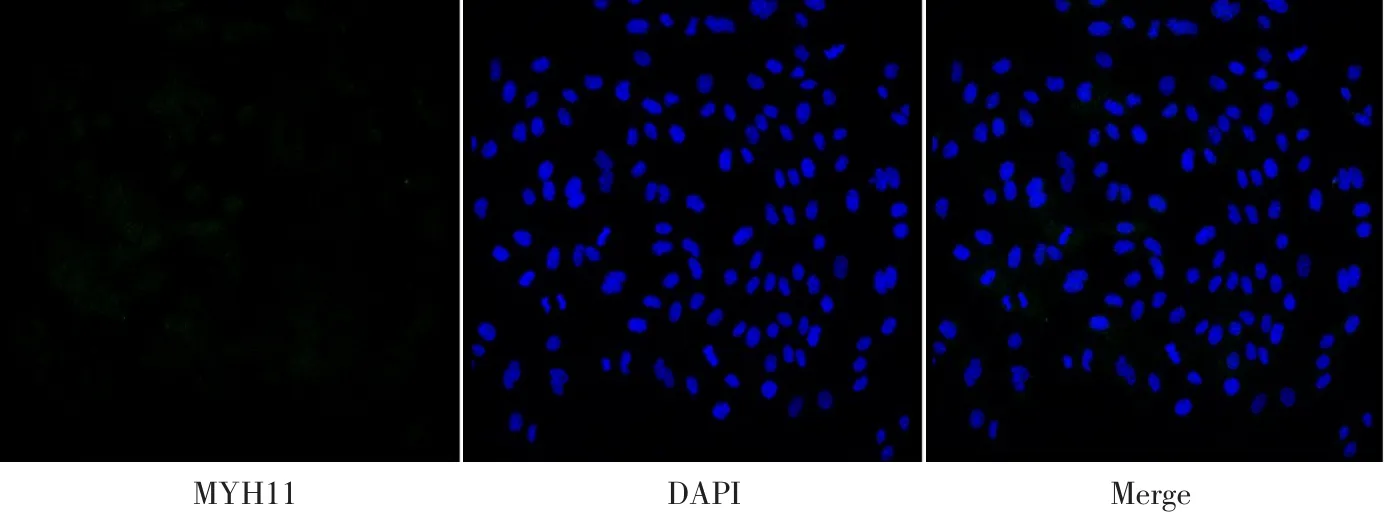
图2 奶牛乳腺上皮细胞中MYH11检测Fig.2 Detection of MYH11 in BMECs
2.2 层粘连蛋白对奶牛乳腺上皮细胞泌乳分化的影响
2.2.1 层粘连蛋白对奶牛乳腺上皮细胞中整联蛋白β1途径的影响
奶牛乳腺上皮细胞分别生长在BSA、LN与Matrigel 3种不同基质上,HIP分化培养液分化处理24 h后,检测BSA、LN与Matrigel 3组细胞模型中泌乳相关基因在mRNA与蛋白质水平表达情况。结果如图3所示,在mRNA水平上,与BSA组相比,LN与Matrigel组中ITGB1基因表达量显著升高(P<0.05)。在蛋白质水平上,与BSA组相比,LN与Matrigel组中整联蛋白β1、ILK与Rac1蛋白合成显著升高(P<0.05)。
2.2.2 层粘连蛋白对奶牛乳腺上皮细胞中β-酪蛋白表达的影响
本试验分别在mRNA和蛋白质水平检测BSA、LN与Matrigel 3组细胞模型中β-酪蛋白的表达情况。结果如图4所示,在mRNA水平上,与BSA组相比,LN与Matrigel组中β-酪蛋白编码基因CSN2 mRNA表达量显著升高(P<0.01)。在蛋白质水平上,与BSA组相比,LN与Matrigel组中β-酪蛋白表达量显著升高(P<0.05)。
2.3 整联蛋白β1活性对奶牛乳腺上皮细胞中泌乳分化的影响
2.3.1 整联蛋β1活性对奶牛乳腺上皮细胞中泌乳相关蛋白表达的影响
AIIB2阻断处理后,分别收集BSA、LN与Matri⁃gel组细胞蛋白样品,Western blot检测与泌乳分化相关的整联蛋白β1下游蛋白表达情况。试验结果如图5所示,结果显示,在BSA组中,与同型IgG相比,AIIB2阻断后ILK蛋白表达量无明显变化(P>0.05),Rac1蛋白表达量显著上升(P<0.05)。在LN组中,与同型IgG相比,AIIB2阻断后ILK蛋白表达量显著降低(P<0.05),Rac1蛋白表达量显著上升(P<0.05)。在Matrigel组中,与同型IgG相比,AIIB2阻断后ILK与Rac1蛋白表达量显著降低(P<0.05)。结合图4结果,LN和Matrigel可增强整联蛋白β1活性,提高ILK表达,阻断抗体抑制整联蛋白β1活性增强引起的ILK表达,阻断抗体对于BSA组中ILK表达无明显影响。

图3 奶牛乳腺上皮细胞中整联蛋白信号途径关键分子表达Fig.3 Expression of key integrin signaling mediators in BMECs

图4 奶牛乳腺上皮细胞中乳蛋白基因表达Fig.4 Expression of milk protein gene in BMECs

图5 整联蛋白β1活性对奶牛乳腺上皮细胞中泌乳相关蛋白的影响Fig.5 Effect of integrin β1 activity on lactation related proteins in BMECs
2.3.2 整联蛋白β1活性对奶牛乳腺上皮细胞β-酪蛋白合成的影响
AIIB2阻断处理后,分别收集BSA、LN与Matrigel组细胞蛋白样品,Western blot检测奶牛乳腺上皮细胞中β-酪蛋白含量。试验结果如图5所示,在BSA组中,与同型IgG相比,AIIB2阻断后奶牛乳腺上皮细胞中β-酪蛋白含量无明显变化(P>0.05)。在LN组中,与同型IgG相比,AIIB2阻断后奶牛乳腺上皮细胞中β-酪蛋白含量显著降低(P<0.05)。在Matrigel组中,与同型IgG相比,AIIB2阻断后奶牛乳腺上皮细胞中β-酪蛋白含量显著降低(P<0.05)。结合图4结果,LN和Matrigel可增强整联蛋白β1活性,提高β-酪蛋白合成,阻断抗体抑制LN和Matrigel对于β-酪蛋白合成作用,但阻断抗体对于BSA组β-酪蛋白合成无明显影响。
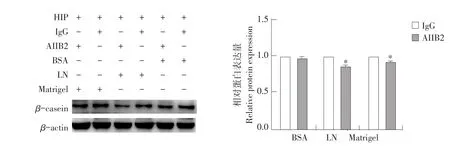
图6 整联蛋白β1活性对奶牛乳腺上皮细胞中β-酪蛋白合成的影响Fig.6 Effect of integrin β1 activity on the synthesis of β-casein in BMECs
3讨 论
3.1 层粘连蛋白对于奶牛乳腺上皮细胞泌乳的影响
乳腺上皮细胞生长在非ECM塑料培养介质上2D培养时,无法响应PRL刺激,继而激活STAT5及乳腺特异性基因表达[14]。乳腺上皮细胞对于PRL刺激反应取决于PRLR正确暴露。在单层培养模型中,乳腺上皮细胞与顶端加入的PRL结合能力有限,因为PRLR沿基底外侧表面分布。在体外将乳腺上皮细胞聚集体培养在非粘附介质上时使PRLR暴露,与PRL结合,并在无LN情况下激活STAT5。这种短暂激活无法刺激乳腺特异性基因转录[15]。ECM与细胞核之间动态交互对话对于转录调控至关重要,当用LN1或lrECM 3D培养时,MECs形成极化腺泡,PRLR暴露于PRL使STAT5持续磷酸化和高水平STAT5核转位。LN1与细胞核沟通影响核组织和乳腺特异基因表达的信号通路仍未发现。近期小鼠乳腺研究表明整联蛋白β1可能通过调控其下游信号通路蛋白FAK、ILK、Rac1等促进核转位和/或STAT5持续激活,但在奶牛乳腺中尚不清楚。本研究中,利用transwell细胞培养模型,模拟机体内细胞所处极性环境。通过上室底膜包被LN(试验组)、BSA(对照组)与Matrigel(阳性对照组),下室添加HIP细胞分化培养液,研究LN对于奶牛乳腺上皮细胞泌乳分化的影响。结果显示,在HIP分化培养液处理时,与BSA组相比,LN与Matrigel组整联蛋白β1、ILK、Rac1及β-酪蛋白翻译水平显著上调,整联蛋白β1与β-酪蛋白转录水平显著上调。表明HIP诱导乳腺上皮细胞泌乳分化时,LN可通过上调整联蛋白β1信号通路,提高β-酪蛋白表达,促进奶牛乳腺上皮细胞泌乳分化。由此推断LN通过与其细胞表面受体整联蛋白β1结合激活整联蛋白β1,并以整联蛋白β1依赖性调控奶牛乳腺上皮细胞泌乳分化。
3.2 整联蛋白β1活性对于奶牛乳腺上皮细胞泌乳的影响
目前常用条件缺陷方法研究整联蛋白β1在特定组织发育和功能中作用。表皮中,整联蛋白β1条件敲除导致基膜蛋白组装缺陷,细胞增殖改变,毛囊形态发生缺陷,细胞骨架动力学受损,受伤后减少迁移和上皮再生[16]。角质形成细胞时空分化不受影响。骨等间充质组织中,软骨细胞中整联蛋白β1的条件缺陷可通过细胞与胶原蛋白和纤连蛋白异常粘附而导致软骨发育不良,并通过细胞周期G1/S边界处缺陷而减少增殖[17]。而肌肉中整联蛋白β1条件缺失导致成肌细胞融合和肌节组装缺陷。神经组织中,整联蛋白β1缺失也有显著表型,例如,在神经嵴衍生的周围神经系统中,整联蛋白β1对于雪旺细胞迁移和髓鞘形成准确时间、轴突周围维持过程及神经肌肉连接成熟均为必需。抑制乳腺上皮细胞与基膜的接触改变形态,存活,增殖和分化。通过使用抑制分化的功能阻断抗体证明整联蛋白β1在小鼠乳腺细胞功能中重要性。最近研究发现,小鼠基因敲除模型中已经证实整联蛋白β1对乳腺发育和STAT5持续激活至关重要[18]。因此提出奶牛乳腺上皮细胞中,功能阻断整联蛋白β1是否对细胞泌乳分化造成影响。本研究中,构建transwell细胞培养模型。在分化培养过程中下室分别添加整联蛋白β1功能阻断抗体AIIB2与同型IgG,处理24 h。观察整联蛋白β 1功能阻断对于泌乳分化的影响。结果显示,LN和Matrgel存在时,整联蛋白β1下游信号分子ILK表达及β-酪蛋白合成同步下降,表明其处于相互关联的泌乳分化调控途径,LN和Matrigel激活整联蛋白β1信号途径,再通过ILK调控影响乳蛋白合成。而BSA作为非基膜成分阴性对照,无法激活整联蛋白β1,即使给予整联蛋白功能阻断抗体也不会对泌乳分化产生影响。
研究表明,小鼠乳腺中Rac1和ILK是介导整联蛋白β1泌乳分化作用的下游关键信号分子,且ILK连接整联蛋白β1对于Rac1激活[19]。在小鼠乳腺连续妊娠中,Rac1既控制乳腺分泌功能,也控制乳腺重塑。Rac1基因缺失试验发现,小叶腺泡发育受损乳腺导管粗大,表明Rac1在调节乳腺上皮组织命运决定中发挥关键作用,用泌乳激素刺激体外培养Rac1基因缺失细胞时,乳蛋白合成能力降低[20]。但本研究中,BSA和LN作为底物时,整联蛋白β1失活Rac1表达反而上升。表明在奶牛乳腺上皮细胞中Rac1可能与整联蛋白β1并非上下游直接关联,并参与其他ECM激活途径,当一条途径失活引起另一条途径反馈增强,导致Rac1表达不降反升;Rho GTPase与亚家族成员补偿机制也造成这种现象[21]。由此推测其他Rho GTPase与亚家族成员与整联蛋白β1存在上下游关联,整联蛋白β1失活时,该家族成员表达下调,触发补偿机制造成Rac1表达上调需后续研究验证。Matrigel含有多种ECM,成分复杂,可能抑制反馈效应或通过其他方式阻碍Rac1表达上调。
4结论
研究表明LN协助并促进诱导的奶牛乳腺上皮细胞β-酪蛋白合成分泌上调,这种上调作用依赖整联蛋白β1-ILK通路活性。
