改性类水滑石的制备及其去除溶液中Eu(Ⅲ)和U(Ⅵ)
2020-06-30徐哲婷何亚卓
徐哲婷,于 涛,*,潘 涛,杨 俊,何亚卓
1.东华理工大学 放射性地质与勘探技术国防重点学科实验室,江西 南昌 330013;2.东华理工大学 核科学与工程学院,江西 南昌 330013
随着人口的增长和化石能源的消耗,日益严重的能源危机已成为人们关注的主要问题和研究热点之一。核能作为一种清洁有效的能源,已成为解决这一危机的重要方案[1]。在过去的几十年里,铀的开采与加工、核安全事故以及核废料管理不当导致大量可溶性铀离子及其它放射性核素通过地表或地下水系统的迁移进入自然环境中[2]。241Am是锕系元素的一种剧毒的人工放射性核素,是核电站使用之后的乏燃料经过处理形成的放射性废水中的重要成分[3]。由于这些放射性核素半衰期长、毒性高,可导致环境放射性污染和辐射损伤,降低细胞的生物活性甚至导致癌变。因此,从废水中将其去除对保护环境和生命安全具有重要意义和迫切性。


实验通过对中、低放废水来源的调研,采用水热合成法制备新型的类水滑石化合物为吸附剂,选取U(Ⅵ)以及常用于三价锕系元素(如Am3+)模拟替代物的Eu(Ⅲ)为目标物,采用吸附法这种简便、高效、低成本的方法,考察目标物在不同实验条件下在吸附剂上的行为,为了解其在环境中的吸附和迁移行为提供实验支持。
1 实验部分
1.1 试剂与仪器
偶氮胂Ⅲ,分析纯,上海馨晟试化工科技有限公司;丙三醇、六水合硝酸镍、九水合硝酸铝、尿素、六水合硝酸铀酰、氧化铕,分析纯,国药集团化学试剂有限公司;盐酸、氢氧化钠、硝酸钠,分析纯,西陇科学股份有限公司。
SP-721E可见光分光光度计,上海仪电分析仪器有限公司;D8 Advance X射线衍射仪,德国布鲁克AXS公司;Nicolet 6700傅里叶红外变换光谱仪,美国尼高力公司。
1.2 改性水滑石的制备
本实验采用传统的水热合成法制备丙三醇改性Ni/Al型类水滑石纳米材料(记为GMH)[8]。具体步骤为:取6 mL丙三醇和34 mL超纯水于烧杯中搅拌均匀,然后分别加入4.7 g的Al(NO3)3·9H2O、10.9 g的Ni(NO3)2·6H2O(其中Ni2+/Al3+摩尔比为3∶1)和20.3 g的尿素。将溶液移入聚四氟乙烯反应釜中,然后将反应釜置于恒温加热箱中,先在110 ℃下反应10 h,再调节至80 ℃反应8 h。冷却至室温后,用超纯水、无水乙醇洗涤、抽滤多次。将得到的样品真空干燥、冷却并研磨,得到丙三醇改性Ni/Al型类水滑石纳米材料(GMH)。
1.3 实验流程
将一定量的吸附剂(GMH)和吸附质(U(Ⅵ)和Eu(Ⅲ))投入到250 mL锥形瓶中,加入一定量0.01 mol/L NaNO3作为背景电解质,根据不同的实验目的加入不同浓度吸附剂、腐殖酸、盐浓度等,并加入超纯水定容,通过加入少量0.1 mol/L HNO3/NaOH将溶液调节至实验所需pH值。锥形瓶恒温振荡24 h以达到吸附平衡,取适量反应后的溶液于离心管中,在10 000 r/min下离心分离10 min,再取一定量的上清液。采用分光光度法对上清液的浓度进行测量,动力学和热力学实验分别在不同实验温度条件下进行。所有实验数据均为两次实验所得的平均值。实验的吸附率(A,%)以及分配系数Kd的计算如下[10]:
(1)
(2)
式中:ρ0和ρe分别为初始时和吸附达到平衡后溶液中吸附质的质量浓度,mg/L;V为溶液的体积,mL;m为吸附剂的质量,mg。
吸附量q的计算如下[11]:
(3)
(4)
式中,qt和qe分别为吸附反应进行到t时刻和吸附达到平衡时的吸附量,mg/g。
1.4 表征方法
本实验主要采用扫描电镜(SEM)、X射线衍射(XRD)、傅里叶变换红外光谱分析(FTIR)及Zeta电位表征方法对吸附U(Ⅵ)和Eu(Ⅲ)前后的GMH材料进行表征分析。SEM可以形象直观地描述材料吸附前后的表面形态、尺寸和空隙大小等微观结构;XRD是分析材料晶体形态和结构的有效方法之一;FTIR是分析材料表面官能团有效且简便的方法之一;Zeta电位分析可以测量液体中材料表面所带有的静电荷的电位,是研究固体表面性质的有效方法。
2 结果与讨论
2.1 GMH吸附前后表征分析
2.1.1扫描电镜分析 GMH吸附Eu(Ⅲ)和U(Ⅵ)前后的SEM分析示于图1。由图1(a)可得,合成材料GMH的形态为簇球状,直径在3~5 μm之间,其球状结构由层状结构组成,材料的空隙结构发达,该结构有利于材料与吸附质的接触,有助于吸附反应的发生。吸附Eu(Ⅲ)和U(Ⅵ)后GMH形貌发生了一定的变化,原来的簇状结构发生了团聚变为片状,结合吸附后的FTIR光谱分析可知,这是由于溶液中的铕离子和铀离子进入到材料表面,与材料表面羟基官能团作用,被成功地吸附固定在材料上。
2.1.2X射线衍射分析 GMH吸附Eu(Ⅲ)和U(Ⅵ)前后的XRD图谱示于图2。由图2曲线Ⅰ可知,GMH的XRD图谱中在11.5°、22.9°、34.9°、39.3°、46.7°、60.8°和61.9°处的一系列对称衍射峰对应指数为(003)、(006)、(009)、(015)、(018)、(110)和(113),这些峰是类水滑石化合物的标准特征衍射峰,表明实验成功地制备了类水滑石化合物(与X射线衍射卡片JCPDS 48-0593相对应)[12],合成材料GMH的衍射峰强度较大且无其他杂峰出现,说明合成材料晶相均一且具有良好的结晶度。从图2曲线Ⅱ、Ⅲ可以看出,GMH吸附Eu(Ⅲ)后衍射峰发生了一定变化,其特征峰强度变弱,46.7°(018)和61.9°(113)处的特征峰基本消失不见,并且22.9°(006)处的特征峰在吸附后发生了偏移,表明吸附剂材料GMH的晶形结构在吸附Eu(Ⅲ)后发生了改变。而材料吸附U(Ⅵ)后在11.5°(003)和22.9°(006)处的特征衍射峰强度降低,表明GMH吸附U(Ⅵ)后其晶形结构遭到了一定的破坏。同时,吸附后的图谱未出现新的衍射峰,表明吸附的铕和铀的物种未结晶。

图1 GMH(a)及其吸附Eu(Ⅲ)(b)和U(Ⅵ)(c)后的SEM图Fig.1 SEM images of GMH before(a) and after adsorption of Eu(Ⅲ)(b) and U(Ⅵ)(c)

Ⅰ——GMH,Ⅱ——吸附Eu(Ⅲ),Ⅲ——吸附U(Ⅵ)图2 GMH吸附Eu(Ⅲ)和U(Ⅵ)前后的XRD图谱Fig.2 XRD patterns of GMH before and after adsorption of Eu(Ⅲ) and U(Ⅵ)


Ⅰ——GMH,Ⅱ——吸附Eu(Ⅲ),Ⅲ——吸附U(Ⅵ)图3 GMH吸附Eu(Ⅲ)和U(Ⅵ)前后的FTIR光谱图Fig.3 FTIR spectra of GMH before and after adsorption of Eu(Ⅲ) and U(Ⅵ)
2.2 接触时间的影响
图4为不同温度条件下接触时间对Eu(Ⅲ)和U(Ⅵ)在GMH上吸附过程的影响。从图4可以看出,当接触时间分别达到5 h和3 h后,Eu(Ⅲ)和U(Ⅵ)在GMH上的吸附基本达到平衡。这是由于反应刚开始时,吸附剂材料表面有大量的吸附位点可与溶液中的Eu(Ⅲ)或U(Ⅵ)离子结合发生配位反应,从而Eu(Ⅲ)或U(Ⅵ)被迅速地吸附;随着反应的进行,吸附剂表面的吸附位点已被Eu(Ⅲ)或U(Ⅵ)所占据,吸附位点上已负载的吸附质离子会阻碍溶液中的吸附质离子在吸附剂上的扩散,同时溶液中的Eu(Ⅲ)或U(Ⅵ)达到吸附剂内部空隙需要较长的时间,因此吸附量增加变缓。同时可以看出,温度越高,相同pH下吸附量越大,表明吸附过程是吸热反应,温度升高有利于吸附反应的进行。

■——298 K,●——308 K,▲——318 K(a):pH=5.0±0.1,m/V=0.016 g/L,c0(Eu(Ⅲ))=4.546×10-5 mol/L;(b):pH=4.5±0.1,m/V=0.03 g/L,ρ0(U(Ⅵ))=10 mg/L图4 不同温度下接触时间对Eu(Ⅲ)(a)和U(Ⅵ)(b)在GMH上吸附过程的影响Fig.4 Effect of contact time for adsorption of Eu(Ⅲ)(a) and U(Ⅵ)(b) onto GMH at different temperatures
为了进一步研究Eu(Ⅲ)和U(Ⅵ)在GMH上的吸附机理,实验采用准一级和准二级动力学模型对不同温度条件下的吸附动力学数据进行分析拟合,拟合方程如下[14-15]:
ln(qe-qt)=lnqe-k1t
(5)
(6)
式中:t为吸附反应进行的时间,min;qt和qe分别为吸附反应进行到t时刻和吸附达到平衡时的吸附量,mg/g;k1为准一级动力学方程速率常数,min-1;k2为准二级动力学方程速率常数,g/(mg·min)。
Eu(Ⅲ)和U(Ⅵ)在GMH上的吸附动力学拟合结果示于图5,拟合相关参数列于表1。由图5可得,在实验条件内准二级动力学模型的线性拟合情况好于准一级动力学模型,结合表1中拟合相关参数,准二级动力学模型拟合所得的平衡吸附量qe与实验所得的平衡吸附量qe,exp基本一致,线性相关系数r2接近1,表明Eu(Ⅲ)和U(Ⅵ)在GMH上的吸附符合准二级动力学模型,吸附过程受到化学吸附的影响。
为了进一步探讨Eu(Ⅲ)和U(Ⅵ)在GMH上的扩散过程,采用Weber-Morris粒子内扩散模型对实验数据进行拟合分析,如下式:
qt=kpt1/2+C
(7)
式中:kp为粒子内扩散速率常数,mg/(mg·min1/2);C是一个涉及边界层厚度的常数,mg/g。拟合结果示于图6。
从图6可得,Eu(Ⅲ)和U(Ⅵ)在GMH上的吸附进程主要分为快速吸附、较快吸附以及平衡吸附三个阶段。第一阶段是溶液中的吸附质Eu(Ⅲ)和U(Ⅵ)通过外部扩散进入吸附剂GMH的边界层;第二阶段是Eu(Ⅲ)和U(Ⅵ)在GMH中的粒子内扩散以及孔扩散;第三阶段则是由于GMH上负载的吸附质离子会阻碍溶液中自由的Eu(Ⅲ)和U(Ⅵ)粒子向内部继续扩散,吸附量基本保持不变。同时,拟合曲线均不经过原点,表明内扩散不是控制吸附的唯一步骤,Eu(Ⅲ)和U(Ⅵ)在GMH上的吸附过程还受到液膜扩散等外部扩散或外界物质交换等影响[16]。
2.3 固液比的影响
固液比(m/V)对Eu(Ⅲ)和U(Ⅵ)在GMH上的吸附影响示于图7(a)和(b)。从图7可以看出,随着GMH投加量的增加,Eu(Ⅲ)和U(Ⅵ)的吸附率迅速增加,这是由于随着吸附剂含量的增加,更多的吸附位点可以与吸附质结合,导致吸附率的增加[17]。但吸附剂上的Eu(Ⅲ)或U(Ⅵ)的量,即平衡吸附量(qe)值不断降低,可能是由于高吸附浓度下吸附位点之间的竞争,并且一些可用的位点不能与Eu(Ⅲ)或U(Ⅵ)形成络合物,从而降低了吸附质在GMH上的相对吸附。为了减少材料的浪费,达到最好的利用效果,GMH对Eu(Ⅲ)吸附实验选取的最佳固液比为0.016 g/L,对U(Ⅵ)吸附实验选取的最佳固液比为0.03 g/L。

■——298 K,●——308 K,▲——318 K图5 不同温度下Eu(Ⅲ)(a,b)和U(Ⅵ)(c,d)在GMH上吸附的准一级(a、c)和准二级(b、d)动力学模型拟合曲线Fig.5 Fitting curves of pseudo-first-order(a, c) and pseudo-second-order(b, d) kinetic models for adsorption of Eu(Ⅲ)(a, b) and U(Ⅵ)(c, d) onto GMH at different temperatures

表1 GMH吸附Eu(Ⅲ)和U(Ⅵ)的准一级和准二级动力学模型线性拟合参数Table 1 Kinetic parameters simulated by linear fitting of pseudo-first-order and pseudo-second-order models for adsorption of Eu(Ⅲ) and U(Ⅵ) onto GMH
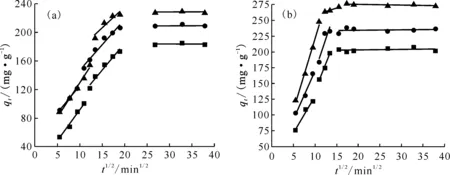
■——298 K,●——308 K,▲——318 K图6 不同温度下Eu(Ⅲ)(a)和U(Ⅵ)(b)在GMH上吸附的粒子内扩散模型拟合图Fig.6 Fitting curves of the Weber-Morris intraparticle diffusion model for adsorption of Eu(Ⅲ)(a) and U(Ⅵ)(b) onto GMH at different temperatures
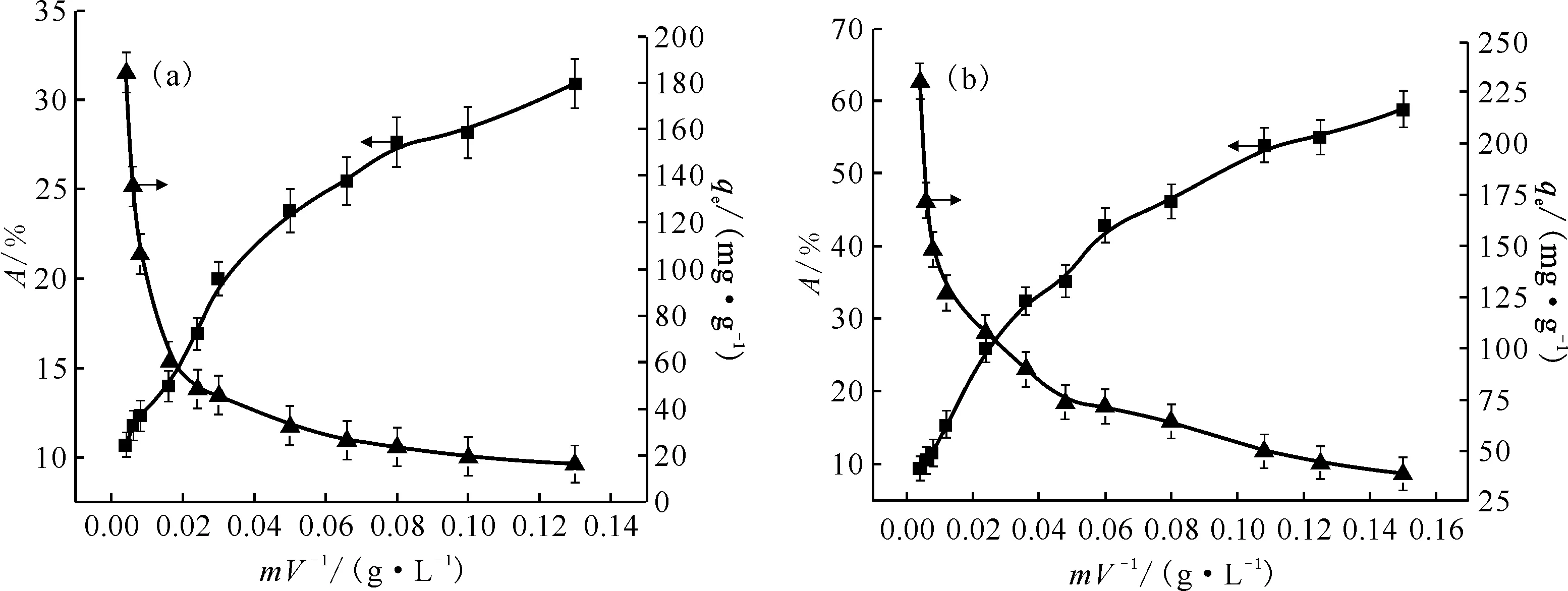
298 K,t=24 h(a):pH=5.0±0.1,c0(Eu(Ⅲ))=4.546×10-5 mol/L;(b):pH=4.5±0.1,ρ0(U(Ⅵ))=10 mg/L图7 固液比m/V对Eu(Ⅲ)(a)和U(Ⅵ)(b)在GMH上吸附过程的影响Fig.7 Effect of solid-liquid ratio for adsorption of Eu(Ⅲ)(a) and U(Ⅵ)(b) onto GMH
2.4 pH和离子强度的影响
由于在不同pH值下,固体颗粒表面电化学性质不同,因此对合成材料GMH以及天然的水滑石(NH)样品进行表面Zeta电位分析,结果示于图8。如图8所示,天然水滑石的零点电位为pH=7.31,而合成材料GMH的零点电位(pH=6.13)向pH更小的方向偏移,表明合成材料GMH在较低pH下即可实现表面质子化与去质子化的平衡,因此较天然水滑石在更低pH下即可实现吸附。同时,不同pH值下Eu(Ⅲ)和U(Ⅵ)在溶液中存在种类不同,实验利用Visual MINTEQ 3.1软件模拟了溶液环境中Eu(Ⅲ)和U(Ⅵ)在不同pH条件下的形态,模拟结果示于图9。

○——GMH,□——NH图8 GMH和天然水滑石(NH)的Zeta电位Fig.8 Zeta potentials of GMH and natural hydrotalcite(NH)
本实验考察了三种不同浓度下的NaNO3对GMH吸附去除溶液中Eu(Ⅲ)和U(Ⅵ)的影响,结果示于图10(a)和(b)。从图10可以看出,在pH=2.0~7.0范围内,随着pH增大,Eu(Ⅲ)和U(Ⅵ)在GMH上的吸附率逐渐增加到最大值。

图9 Eu(Ⅲ)(a)和U(Ⅵ)(b)在不同pH溶液中的形态分布图Fig.9 Speciation of Eu(Ⅲ)(a) and U(Ⅵ)(b) in solution as function of pH values

c(NaNO3),mol/L:■——0.001,●——0.01,▲——0.1;t=24 h;298 K(a):m/V=0.016 g/L,c0(Eu(Ⅲ))=4.546×10-5 mol/L;(b):m/V=0.03 g/L,ρ0(U(Ⅵ))=10 mg/L图10 pH及离子强度对Eu(Ⅲ)(a)和U(Ⅵ)(b)在GMH上吸附过程的影响Fig.10 Effect of pH and ionic strength for adsorption of Eu(Ⅲ)(a) and U(Ⅵ)(b) onto GMH with different concentrations of NaNO3 solution

由图10可知,Eu(Ⅲ)在GMH上的吸附在4.0
2.5 腐殖酸的影响
为研究腐殖质对合成材料GMH对Eu(Ⅲ)和U(Ⅵ)去除的影响,不同浓度的腐殖酸被引入到吸附体系当中。图11为腐殖酸存在时吸附剂材料GMH对溶液中Eu(Ⅲ)和U(Ⅵ)吸附的影响。由图11可得,当pH<8.0时,腐殖酸的存在对Eu(Ⅲ)在GMH上的吸附有促进作用,且浓度越高,促进作用越明显;而当pH>8.0时,腐殖酸的存在体系中,Eu(Ⅲ)吸附率仍然保持在最高水平。在pH<6.0时,腐殖酸的存在对GMH吸附U(Ⅵ)有一定的促进作用,而当pH>6.0后,腐殖酸的存在则会抑制U(Ⅵ)吸附反应的进行。这是由于在低pH值下,带负电的腐殖酸会吸附到带正电的GMH表面,改变了材料表面的性质即减少了固相表面的正电性,同时腐殖酸分子上具有大量的官能团,能与溶液中的Eu(Ⅲ)/U(Ⅵ)形成稳定的复合物GMH-HA-Eu(Ⅲ)/U(Ⅵ),导致吸附率增大。
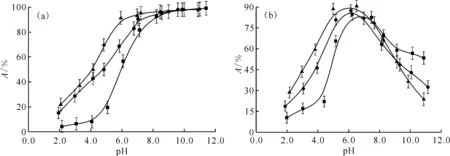
298 K;t=24 h;ρ(HA),mg/L:■——0,●——10,▲——20(a):m/V=0.016 g/L,c0(Eu(Ⅲ))=4.546×10-5 mol/L;(b):m/V=0.03 g/L,ρ0(U(Ⅵ))=10 mg/L图11 腐殖酸对Eu(Ⅲ)(a)和U(Ⅵ)(b)在GMH上吸附过程的影响Fig.11 Effect of HA for adsorption of Eu(Ⅲ)(a) and U(Ⅵ)(b) onto GMH
2.6 反应温度的影响
不同温度条件下,溶液pH=5.0时,Eu(Ⅲ)和U(Ⅵ)的投加量对其在GMH上吸附的影响示于图12(a)和图13(a)。由图12(a)和图13(a)可以看出,随着吸附质初始浓度的增大,GMH对Eu(Ⅲ)和U(Ⅵ)的吸附量不断增加,同时温度越高,吸附量也越大,即升温有利于吸附反应的进行。这是由于温度越高,分子间的作用增强,溶液中的Eu(Ⅲ)或U(Ⅵ)更有利于与吸附剂表面的活性位点结合,同时溶液中Eu(Ⅲ)或U(Ⅵ)离子获得更多能量,促进了其在吸附剂空隙中的扩散,进一步导致吸附量的增加。
为了进一步揭示GMH对Eu(Ⅲ)和U(Ⅵ)的吸附机理,实验在不同温度条件下进行,并采用Langmuir、Freundlich和D-R吸附等温线模型对实验数据进行分析,拟合方程如下[19-21]:
(8)
(9)
lnqe=lnqmax-βε2
(10)
式(10)中参数计算为:
(11)
(12)
式中:qe为吸附平衡时的吸附量,mol/g;ce是吸附平衡时液相中吸附质的浓度,mol/L;qmax为单位质量下的最大吸附量,mol/g;b为与吸附热有关的Langmuir常数;KF为表征吸附能力的常数,mol1-n·Ln/g;n为与吸附强度相关的常数;β表示吸附自由能的活度系数,mol2/kJ2;T表示温度,K;R为理想气体常数,8.314 J/(mol·K);E表示吸附自由能,kJ/mol。
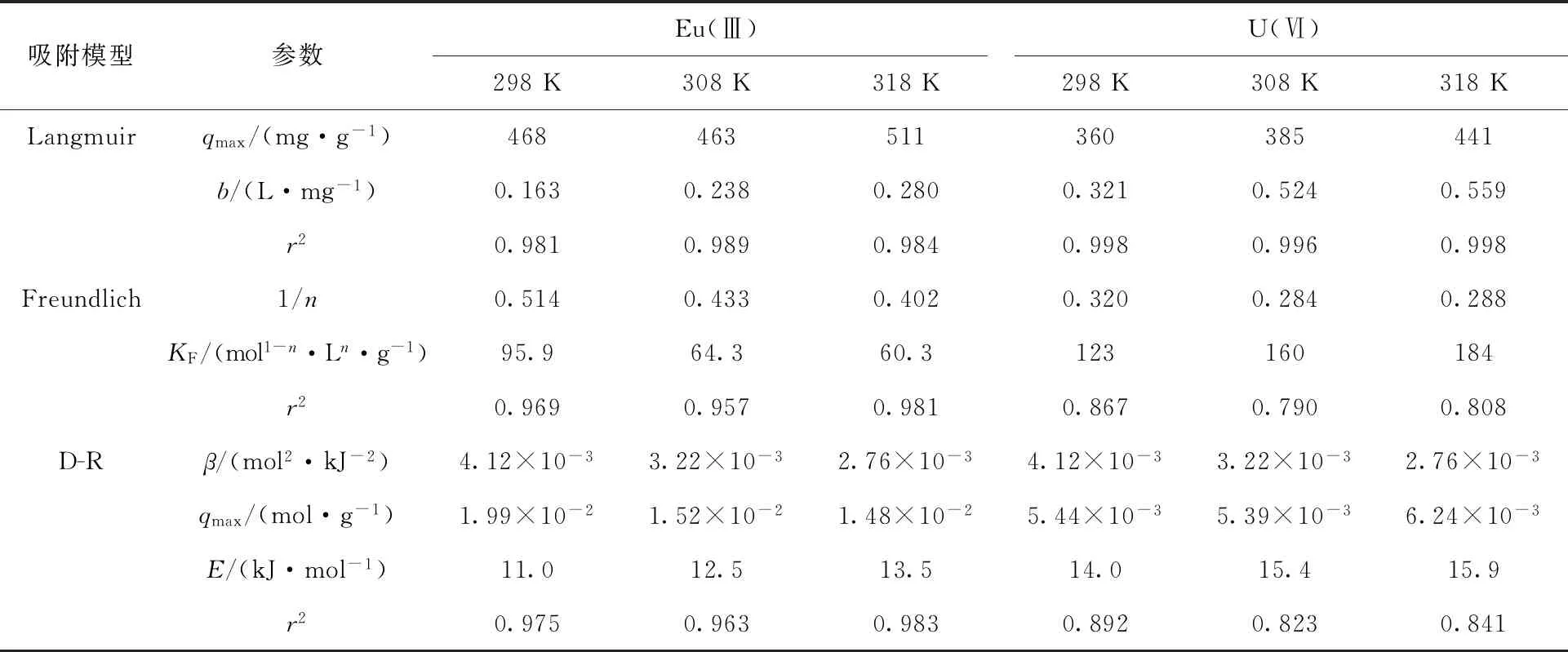
Eu(Ⅲ)和U(Ⅵ)在GMH上吸附的热力学拟合结果分别示于图12和图13,拟合相关参数列于表2。从图12和图13可得,Eu(Ⅲ)在GMH上的吸附符合Langmuir等温线模型,同时Freundlich等温线模型拟合系数也较高,表明Eu(Ⅲ)在GMH上的吸附以表面单层吸附为主,不规则的多层吸附为辅。而GMH对U(Ⅵ)主要为单层表面吸附。从表2可以得到,Freundlich吸附等温模型常数n值处于0.1 ■——298 K,●——308 K,▲——318 K图12 不同温度下Eu(Ⅲ)在GMH上的吸附(a)及Langmuir(b)、Freundlich(c)和D-R(d)吸附等温线模型拟合曲线Fig.12 Effect of different temperatures for adsorption of Eu(Ⅲ) onto GMH(a), and Langmuir(b), Freundlich(c) and D-R(d) isotherm models ■——298 K,●——308 K,▲——318 K图13 不同温度下U(Ⅵ)在GMH上的吸附(a)及Langmuir(b)、Freundlich(c)和D-R(d)吸附等温线模型拟合曲线Fig.13 Effect of different temperatures for adsorption of U(Ⅵ) onto GMH(a),and Langmuir(b), Freundlich(c) and D-R(d) isotherm models 表2 GMH吸附Eu(Ⅲ)和U(Ⅵ)的Langmuir、Freundlich和D-R等温线模型相关参数Table 2 Related parameters of Langmuir, Freundlich and D-R isotherm models for adsorption of Eu(Ⅲ) and U(Ⅵ) onto GMH 热力学参数焓变(ΔH)、熵变(ΔS)以及吉布斯自由能(ΔG)的值,由以下方程拟合所得[22],分别列于表3。 ΔG=-RTlnK (13) (14) 式中:R为理想气体常数,8.314 J/(mol·K);T表示温度,K。 由表3可得,Eu(Ⅲ)和U(Ⅵ)在GMH上吸附的ΔG<0,表明吸附反应是自发进行的,其绝对值随着温度的升高而增大,说明高温有利于吸附反应的进行,这是由于高温易于去Eu(Ⅲ)或U(Ⅵ)离子溶剂化。ΔH>0,表明吸附过程是吸热过程,这是由于Eu(Ⅲ)或U(Ⅵ)离子首先要在水溶液中从它们的水化壳中剥离出来,即这个过程需要能量输入,而高温条件下更有利。反应的熵变ΔS为正值,可能是由于GMH在吸附Eu(Ⅲ)和U(Ⅵ)的过程中材料表面结构发生了变化,吸附过程中材料-溶液界面系统的无序性增加,即系统的自由度升高。 根据实验分析,Eu(Ⅲ)和U(Ⅵ)在GMH上吸附的模型分析示于图14。如图14所示,在背景电解质溶液中,材料GMH表面的—OH官能团可以与进入到吸附层的目标离子形成络合物,而平衡离子存在于扩散层中。当Eu(Ⅲ)和U(Ⅵ)离子穿过扩散层进入到吸附层后,材料表面含氧的官能团(≡SOH)能与Eu(Ⅲ)和U(Ⅵ)离子形成表面络合物而将其固定在材料上。而在酸性和中性的溶液环境中,材料表面的羟基官能团与目标离子之间存在水合壳,高背景离子强度下水合壳会被压缩,这会对外层表面络合反应产生一定的影响。但在碱性溶液环境中,Eu(Ⅲ)离子则与材料表面的羟基官能团直接接触而形成内层表面络合物,几乎不受离子强度变化的影响。 表3 GMH吸附Eu(Ⅲ)和U(Ⅵ)的热力学相关参数Table 3 Values of thermodynamic parameters for adsorption of Eu(Ⅲ) and U(Ⅵ) onto GMH 图14 Eu(Ⅲ)和U(Ⅵ)在GMH上吸附的模型分析Fig.14 Adsorption model analysis of Eu(Ⅲ) and U(Ⅵ) onto GMH 考察了合成材料GMH对水溶液中Eu(Ⅲ)和U(Ⅵ)的吸附作用,探讨了固体投入量、溶液pH值、离子强度、腐殖酸、接触时间和温度等因素对吸附的影响,通过SEM、FTIR、XRD等微观表征手段,结合吸附模型探讨了吸附机理。得出以下结论。 (1) 合成改性类水滑石材料(GMH)为层状结构的簇球状,材料具有较大的比表面积,吸附Eu(Ⅲ)和U(Ⅵ)后材料发生团聚而变为块状。XRD和FTIR图谱表明实验成功制备了类水滑石化合物,且吸附后Eu(Ⅲ)和U(Ⅵ)被固定在了材料上。 (2) 溶液pH值对Eu(Ⅲ)和U(Ⅵ)在GMH上的吸附行为影响显著,GMH对Eu(Ⅲ)和U(Ⅵ)的吸附率在pH=2.0~7.0左右迅速上升并达到最大,随着pH值的进一步增大,GMH对Eu(Ⅲ)的吸附率基本保持不变,而对U(Ⅵ)的吸附率出现一定的降低。离子强度不影响GMH对Eu(Ⅲ)的吸附,而高离子强度对U(Ⅵ)在GMH上的吸附有一定的抑制作用。 (3) 准二级动力学模型和Langmuir等温线模型可以很好地描述Eu(Ⅲ)和U(Ⅵ)在GMH上的吸附过程。Eu(Ⅲ)和U(Ⅵ)在吸附剂上的吸附是自发的、吸热的过程。实验条件下,GMH对溶液中的Eu(Ⅲ)和U(Ⅵ)的理论最大吸附量分别为511 mg/g和441 mg/g。 (4) 结合微观表征和实验数据可得,合成材料GMH对溶液中Eu(Ⅲ)的吸附主要是通过静电相互作用和内层表面络合或离子交换相互作用实现;而对U(Ⅵ)的吸附主要是通过静电相互作用和内层表面络合作用实现的。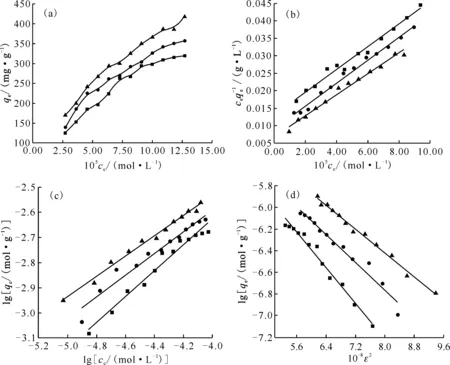

2.7 吸附机理的讨论


3 结 论
