99Tcm-3PRGD2 SPECT显像用于胰腺癌荷瘤裸鼠动物实验及临床转化研究
2020-06-30靳晓娜石希敏董诚岩郑连芳杜延荣
靳晓娜,郑 堃,石希敏,贾 兵,董诚岩,郑连芳,杜延荣,霍 力,李 方,*
1.中国医学科学院 北京协和医学院 核医学科,北京 100730;2.核医学科分子靶向诊疗北京重点实验室,北京 100730;3.北京大学 医学部 同位素中心,北京 100191;4.通用电气医疗(中国),北京 100004
整合素(integrin) αvβ3在某些肿瘤细胞和新生血管内皮细胞表面高表达,但在成熟血管和正常的器官系统很少表达或不表达,此特点使其成为肿瘤新生血管显像及治疗的靶点[1-3]。研究证实含有RGD(Arg-Gly-Asp,精氨酸-甘氨酸-天冬氨酸)三肽序列的配体与整合素αvβ3具有特异性和高亲和力[4-5]。3PRGD2是一种新型RGD二聚体,在两个RGD模序之间引入PEG4作为连接基团。99Tcm标记的3PRGD2可与整合素αvβ3特异性结合,并进行单光子发射计算机断层显像(SPECT)。
近几年整合素受体显像已经被用于肺癌、乳腺癌、甲状腺癌肺转移的临床诊断及疗效评估,以及脑梗、心梗后的血管新生的评估中,本研究团队也积累了大量的经验[6-8],但国内外尚无其在胰腺癌中应用的报道。胰腺癌是一种具有高度侵袭性和快速进展性疾病[9-10]。在西方发达国家,胰腺癌是第9个最常见的恶性肿瘤和第4个癌症相关的死亡原因,平均5年生存率不到5%[10]。大多数患者的胰腺癌第一次被发现时,已经出现了严重的局部浸润和/或远处转移,从而错过了根治性手术切除最佳时机,因此可早期诊断和准确评估肿瘤分期的影像学方法显得尤为重要。因此本研究拟进行动物实验及初步临床转化,探索99Tcm-3PRGD2SPECT显像应用于胰腺癌的价值。
1 实验部分
1.1 材料与仪器
HYNIC-3PEG4-E[c(RGDfK)2药盒(药盒中含有5 mg三苯基膦三间磺酸钠、6.5 mg三羟甲基甘氨酸、40 mg 甘露醇、20 μg HYNIC-3PRGD2以及琥珀酸盐缓冲液成分),由北京大学医学部同位素中心王凡教授惠赠;胰腺癌PANC-1细胞,由北京协和医院基本外科实验室惠赠;Sep-Pak C18反相萃取柱,美国Waters公司;Muhiscreen抽滤板,美国Millipore公司;Na99TcmO4洗脱液,北京原子高科股份有限公司;鼠抗人整合素αvβ3单克隆抗体,美国Chemicon公司;异硫氰酸荧光素(FITC)标记的羊抗鼠IgG、3-氨丙基-3-甲氧基硅烷(3-aminopropyl-triethoxysilane, APES),北京中杉金桥生物技术有限公司;4′,6-二脒基-2-苯基吲哚(DAPI),美国Biotium公司。
CRC-15R放射性活度计,美国Capintec公司;ITLC-SG纸条,美国Agilent公司;AR-2000放射性扫描仪,Bioscan公司;E.CAM单光子发射计算机断层扫描仪(SPECT)、biography 128 TrueVTrueX正电子发射计算机断层扫描仪/电子计算机X射线断层扫描仪(PET/CT),西门子公司。
1.2 实验方法
1.2.1细胞培养和荷瘤鼠模型的建立 将PANC-1胰腺癌细胞用含10%(质量分数,下同)胎牛血清(BSA)的低糖DMEM培养基在37 ℃、5%(体积分数)CO2的培养箱中常规培养传代。荷瘤鼠模型的建立:取4~5周龄BALB/c裸鼠,于上肢肩部接种PANC-1胰腺癌细胞,每只接种5×106个细胞,饲养于SPF级动物房。待肿瘤平均直径达到0.8~1.0 cm时用于实验。
1.2.2免疫组化实验
(1) 细胞实验设2个平行组,每组设2个平行样。一组将待检PANC-1细胞以1×105mL-1接种到小玻片(细胞爬片)上,培养过夜,用4%(质量分数)多聚甲醛固定20 min。磷酸盐缓冲溶液(PBS,0.01 mol/L,pH=7.4)洗后用含有1%(质量分数,下同)BSA的PBS封闭1 h。封闭后分别加入鼠抗人整合素αvβ3单克隆抗体( 1∶100稀释)和人源IgG,4 ℃孵育过夜。用含0.1%(体积分数,下同)Tween-20的PBS洗3次后加入FITC标记的羊抗鼠IgG (1∶200稀释)和DAPI(用含5%BSA的PBS稀释成100 ng/L)溶液,室温下孵育1 h。用PBS洗3次。用蒸馏水冲去盐分,甘油缓冲液封片。另一组用人源IgG代替鼠抗人整合素αvβ3单克隆抗体。最后置于激光共聚显微镜下观察。
(2) 组织实验设2个平行组,每组设2个平行样,将胰腺癌组织冰冻切片取出风干,用冰丙酮溶液浸泡固定10 min,空气干燥10 min。加含5%BSA的PBS室温孵育1 h。一组加鼠抗人整合素αvβ3单克隆抗体(1∶100稀释),37 ℃孵育1 h。用PBS洗3次,加FITC标记的羊抗鼠IgG(1∶200稀释)和DAPI溶液,37 ℃孵育1 h。用PBS洗3次。用蒸馏水冲去盐分,甘油缓冲液封片。另一组用人源IgG代替鼠抗人整合素αvβ3单克隆抗体。最后使用激光共聚显微镜观察。
1.2.399Tcm-3PRGD2标记、质控及安全性检测 取1 mL Na99TcmO4洗脱液740~1 300 MBq (20~35 mCi)加入到3PRGD2药盒中。充分振荡使药盒中固体样品彻底溶解至澄清,100 ℃加热20 min。反应完成后,冷却至室温,用0.22 μm无菌滤膜过滤。用无菌生理盐水稀释到所需剂量浓度。标记完成后,用无菌注射器取1滴产物溶液点于快速硅胶薄层纸(ITLC-SG),点样后分别用柠檬酸-柠檬酸三钠二水合物缓冲液(体系1,pH=5)和乙腈与生理盐水混合体系(体系2,体积比1∶1)两种展开体系上行展开,将层析纸条晾干后,使用Bioscan放射性薄层扫描仪进行数据采集,数据采集完成后获取图像、各放射性百分比及Rf值,用于计算药品的放化纯度。产品低温保存,质控合格后使用。标记3批次,将产品进行细菌培养及细菌内毒素检测。
1.2.4急性毒性试验 取6周龄昆明鼠8只,体重(20±5) g,5只为实验组,3只为对照组。实验组每只鼠尾静脉注射99Tcm-3PRGD22 mCi/0.5 mL(1 Ci=3.7×1010Bq)。本研究拟以0.3 mCi/kg的剂量给患者注射99Tcm-3PRGD2,则所给实验组鼠的剂量是人体的333倍。对照组鼠尾静脉注射生理盐水0.5 mL。均于5 s内匀速注射完毕。
1.2.5荷瘤裸鼠全身平面显像 4只荷瘤裸鼠分别自尾静脉注射99Tcm-3PRGD2(200 μL,14.8 MBq),并于注射后0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0 h时,将裸鼠腹腔注射10%水合氯醛(剂量3 mL/kg)麻醉后仰卧于配有平行孔低能高分辨准直器的双探头SPECT上进行平面显像。全身采集计数分别为300 k,矩阵大小为128×128。观察肿瘤对示踪剂的摄取以及全身分布情况。在肿瘤(T)和健康侧对应部位(NT)勾画的感兴趣区(ROI),获取感兴趣区内最高放射性计数,并计算其放射性摄取比值T/NT,分析它们随时间变化的规律。
1.2.6初步临床转化应用 本临床研究获得中国医学科学院北京协和医院伦理委员会批准。对6例CT发现胰腺肿瘤患者行99Tcm-3PRGD2SPECT显像,患者均为男性,年龄51~67(62.4±3.4)岁。静脉注射99Tcm-3PRGD2,每kg体重注射剂量0.3 mCi(±10%),注射后1 h排尿后行前后位全身扫描,扫描速率为10 cm/min,后行腹部断层显像,约为注射示踪剂后1.5 h±10 min,其中5例患者于2周内行常规18F-FDG PET/CT检查。
2 结果与讨论
2.1 免疫组化实验
胰腺癌PANC-1细胞和肿瘤组织切片对鼠抗人整合素 αvβ3单克隆抗体显示出强阳性免疫染色,以人源IgG作为阴性对照的免疫荧光染色结果为阴性证实了结合的特异性,表明了PANC-1胰腺癌细胞和肿瘤组织中表达整合素αvβ3(图1)。此结果为本工作的后续实验提供了分子水平的理论依据。
2.2 99Tcm-3PRGD2标记、质控及安全性检测

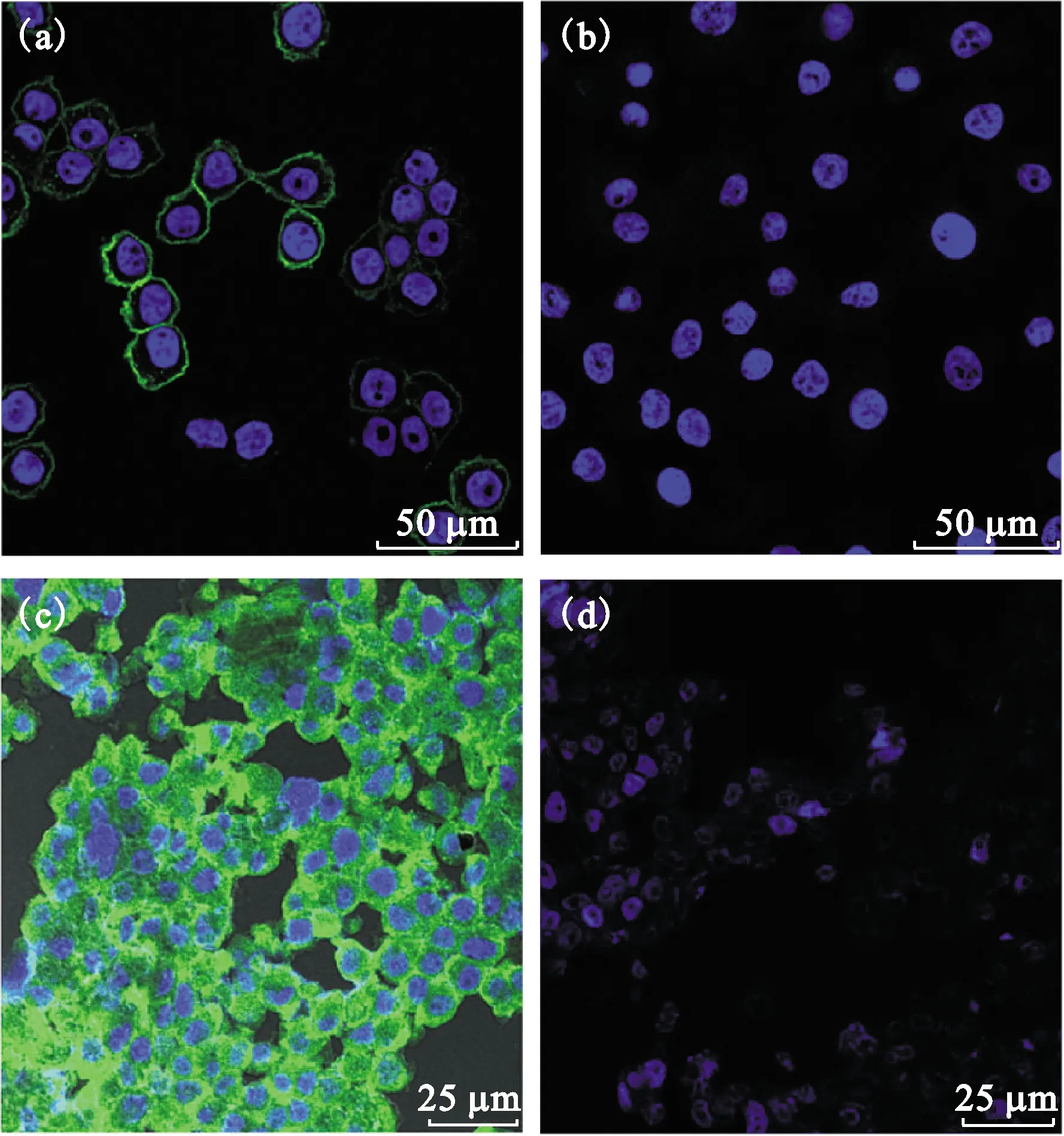
(a)和(c)分别为以鼠抗人整合素αvβ3单克隆抗体为一抗肿瘤细胞和肿瘤组织切片的染色结果,强阳性;(b)和(d)分别为以IgG作为一抗肿瘤细胞和肿瘤组织切片的染色结果,为阴性图1 胰腺癌PANC-1细胞及肿瘤组织免疫组化染色Fig.1 Integrin αvβ3 expression in PANC-1 cells and tumor tissue by immunofluorescence staining
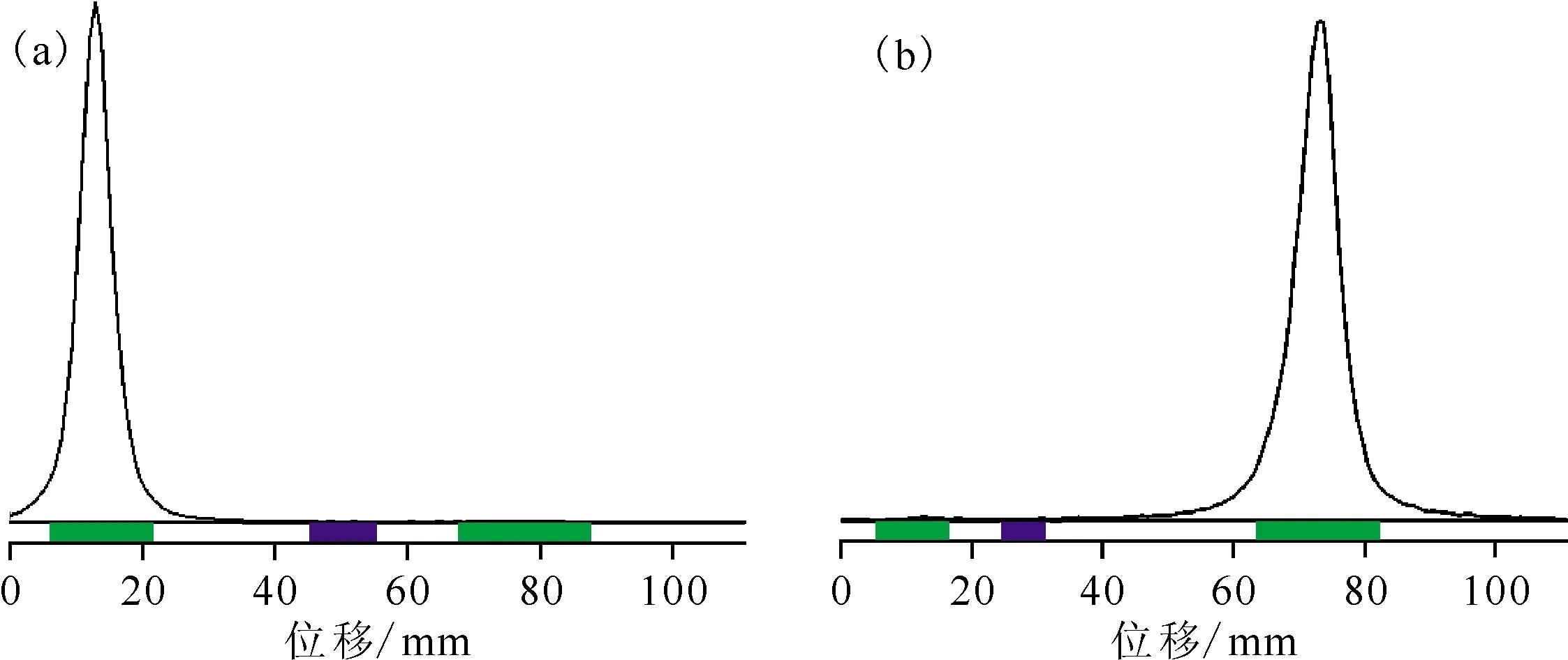
99Tcm-3PRGD2:(a)——Rf=0.0,(b)——Rf=0.9~1.0图2 ITLC-SG法质控结果Fig.2 Quality control results of ITLC-SG method
2.3 急性毒性试验
注射99Tcm-3PRGD2观察48 h内小鼠无死亡,120 h内实验组和对照组小鼠饮食、活动均正常。注射后120 h时处死并解剖小鼠,实验组小鼠各脏器颜色、形态与对照组无明显差异。急性毒性试验提示安全性强。
2.4 荷瘤裸鼠全身平面显像
荷瘤裸鼠全身平面显像(图3)提示99Tcm-3PRGD2主要分布于肿瘤、肝脏、双肾和膀胱,排尿后膀胱内放射性分布明显减少。心脏、双肺、肌肉和骨骼对示踪剂摄取低。 肿瘤在0.5 h即可清晰显影,肌肉本底较低,说明99Tcm-3PRGD2能够快速与整合素受体结合,且靶/本底比值较高,T/NT为1.58±0.15。从图3所示的全身分布情况看,双肾及膀胱放射性分布多,肝脏次之,脑、心脏、双肺分布最少,说明99Tcm-3PRGD2主要经肾脏代谢后以尿液形式排出体外。受肝、脾、双肾及膀胱影响,未观察到胰腺及肠道摄取。随时间延长,肿瘤摄取99Tcm-3PRGD2逐渐增加,软组织本底逐渐降低,1.5 h时T/NT达峰值(图4),为2.51±0.54。观察至6.0 h,肿瘤仍清晰可见,T/NT为1.43±0.06。此实验为以荷胰腺癌(PANC-1细胞)裸鼠模型为基础的显像研究建立了成熟的显像方法,提供了观察肿瘤的最佳时间点。注射后6.0 h仍可见肿瘤对示踪剂有较高浓聚,除了肿瘤、肝、双肾及膀胱,其他脏器亦未见明显分布,说明99Tcm-3PRGD2在荷瘤鼠体内稳定性好,持续时间长。
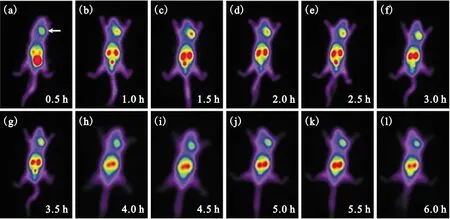
(a)中白色箭头所指位置为肿瘤图3 荷瘤鼠全身平面显像Fig.3 Whole body planar imaging of PANC-1-bearing mice

n=4图4 T/NT随时间的变化Fig.4 T/NT variation over time
2.5 初步临床转化应用

红色箭头:胰腺原发灶;蓝色箭头:肝转移灶图5 99Tcm-3PRGD2 SPECT 前(a)、后(b)位全身平面显像Fig.5 99Tcm-3PRGD2 SPECT anterior(a) and posterior(b) planar scans of the whole body
患者均为男性,年龄51~67(62.4±3.4)岁,检查过程及检查后随访两周,未见明显不适。共发现6个胰腺病灶,分布于胰头、颈及体尾部,大小约1.5~5.2 cm,手术或穿刺病理结果:导管腺癌4例,腺细胞癌2例。99Tcm-3PRGD2SPECT 全身显像显示胰腺癌及肝左叶见示踪剂浓聚灶(图5),肝、脾、肠道、双肾及膀胱见较多示踪剂分布,唾液腺及甲状腺轻度放射性摄取,其余脏器未见明显示踪剂分布。99Tcm-3PRGD2SPECT全身及断层显像(图6)检出所有的胰腺癌原发灶,检出率为100%,肿瘤/肝脏放射性摄取比值(T/L)为1.7~3.5。18F-FDG PET/CT检出5例患者中的原发灶,最大标准摄取值(SUVmax)为2.8~9.1,T/L为1.5~4.2。1例胰腺癌患者伴有肝左叶两处转移(图6),病灶大小分别约为2.6 cm和1.1 cm,较大者对99Tcm-3PRGD2摄取增高,T/L为2.5,较小者对99Tcm-3PRGD2摄取与肝脏接近;肝转移灶对18F-FDG摄取不同程度增高,T/L分别为1.5(2.6 cm)和2.3(1.1 cm),说明它们处于不同病理生理状态,较大者肿瘤细胞的糖代谢相对较低(对18F-FDG摄取较低),血管新生旺盛(对99Tcm-3PRGD2较高),较小者对两种示踪剂摄取程度相反,这个现象及原因需进行更深入的研究。99Tcm-3PRGD2SPECT检出了6例胰腺癌患者的原发灶和肝内转移灶,具有应用于胰腺癌诊断的潜能,并且检查操作简单,费用低于18F-FDG PET/CT。本研究仅为初步研究,临床转化病例数少,需进行大样本的临床研究,以证实99Tcm-3PRGD2SPECT对胰腺癌的诊断价值。
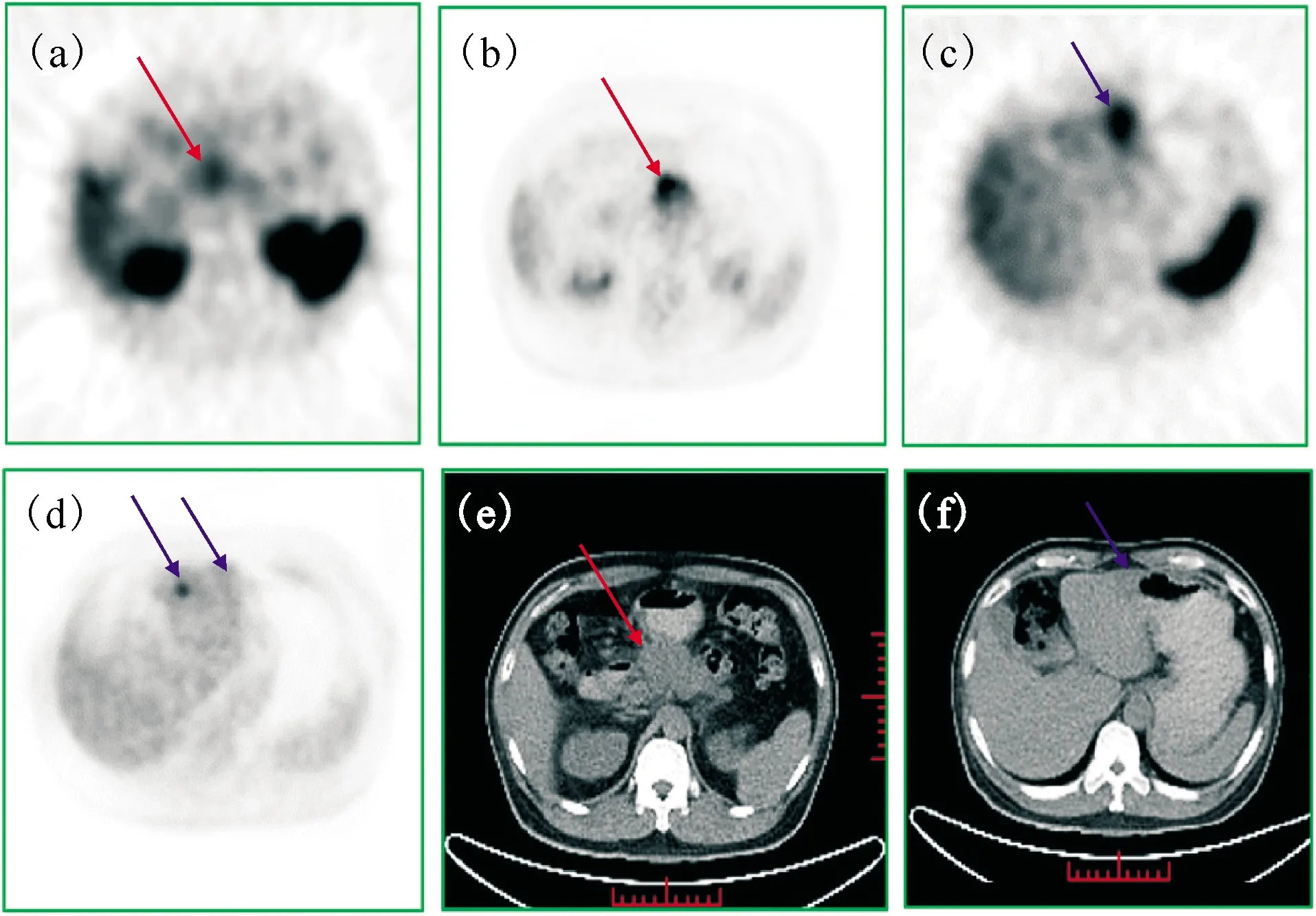
图6 胰腺癌对 99Tcm -3PRGD2(a)、18F-FDG(b)的摄取,肝转移灶对99Tcm-3PRGD2(c)、18F-FDG(d)的摄取,以及CT所示胰腺癌病灶(e)及肝转移灶(f)Fig.6 Intense 99Tcm-3PRGD2(a) and 18F-FDG(b) uptakes in pancreatic cancer, different distribution of 99Tcm-3PRGD2(c) and 18F-FDG(d) in liver metastases, and pancreatic cancer(e) and liver metastases(f) by CT
3 结 论
(1)99Tcm-3PRGD2是一种能够与肿瘤新生血管内皮细胞和肿瘤细胞表面的整合素受体特异性结合的单光子肿瘤显像剂。它的制备及质控方法易于操作,并且其具有很好的安全性和显像效果,适于推广应用。
(2) 初步的临床转化研究提示99Tcm-3PRGD2SPECT显像对胰腺癌的临床诊断具有潜在的应用前景。
