黑布林籽β-葡萄糖苷酶聚合物的制备与稳定性研究
2020-06-30毕艳红王朝宇张晓辉赵希荣韦洁玲
黄 硕 毕艳红 朱 春 王朝宇 张晓辉 赵希荣 韦洁玲
(淮阴工学院生命科学与食品工程学院,江苏淮安 223003)
糖苷是自然界普遍存在的一类具有重要生物学功能的次生代谢产物,在食品、化妆品及药品领域具有广泛的应用。 天然色素、挥发性香味化合物的前驱体及药用植物药剂中的主要成分大多属于糖苷类化合物[1-2]。 因此,如何实现该类化合物的高效合成一直是该领域的研究热点[3]。
酶法合成糖苷具有反应过程可控、选择性高、条件温和、工艺简单及产物纯度高等优势,已逐渐成为糖苷合成领域的首选方法[4-6]。 糖苷水解酶是合成糖苷的重要酶类,其来源广泛、性质稳定、底物谱广,且可直接以非保护的糖作为反应底物,通过逆水解反应合成不同结构的糖苷[7]。 近年来,研究人员陆续发现植物组织中种类繁多的糖苷水解酶可高效、高选择性的催化糖苷的合成,如Yang 等[8]考察了11 种植物源β-葡萄糖苷酶催化7 种糖苷的合成过程,发现西梅籽β-葡萄糖苷酶合成乙基β-D-葡萄糖苷的产率高达78%。 此外,有研究发现,植物源β-葡萄糖苷酶的葡萄糖抑制常数通常为0.6 ~8.0 mmol·L-1,与微生物源β-葡萄糖苷酶相比具有更高的葡萄糖耐受性和潜在的工业应用价值[9]。 尽管植物源β-葡萄糖苷酶在合成糖苷方面具有优越性,但其在有机溶剂中仍然存在稳定性较差、回收利用困难等问题[10]。 因此,寻求β-葡萄糖苷酶的有效固定化方式将是解决上述问题的策略之一。
2000 年Sheldon 课题组首次提出了无载体的交联酶聚合物(cross-linked enzyme aggregates, CLEAs)概念[11]。 该方法可通过改变液态酶的溶解性质而使其物理沉降,随后再利用双功能试剂使酶蛋白直接相互连接,具有简单快速、原料廉价、单位体积酶活高以及对蛋白纯度要求低等特点[12]。 Yu 等[13]将制备的绿豆环氧化物酶CLEAs 用于环氧苯乙烯的不对称水解反应,发现与游离酶相比,该酶具有反应速度更快、产率和对映体选择性更高的特点;慕洋洋等[14]对青霉素酰化酶进行了交联固定化,发现其最适催化温度、pH和稳定性均有显著提高。 制备β-葡萄糖苷酶CLEAs并探究其稳定性的研究尚鲜见报道,因此,本研究以黑布林籽β-葡萄糖苷酶为目标蛋白,在对其CLEAs 制备过程进行优化的基础上,对其热稳定性和操作稳定性进行详细研究,旨在为该酶的规模化应用提供借鉴。
1 材料与方法
1.1 材料与试剂
黑布林,市售。 红景天苷标品、对羟基苯乙醇、对硝基苯基-β-D-吡喃葡萄糖苷(4-nitrophenyl β-Dglucopyranoside,pNPG)、戊二醛和对硝基苯酚,均购自上海阿拉丁生化科技股份有限公司。 乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA),购自北京索莱宝科技有限公司。 其他试剂均为分析纯。
1.2 主要仪器与设备
Agilent1100 型高效液相色谱仪,美国Agilent Technologies 公司;S-3000N 型扫描电子显微镜,日本日立公司;T6 型紫外可见分光光度计,北京普析通用仪器有限责任公司;5804R 型高速冷冻离心机,德国Eppendorf 公司;FA2004 型电子天平,上海菁海仪器有限公;PHS-3C 型pH 计,上海仪电科学仪器股份有限公司;GT2-8 型冷冻干燥机,德国SRK 系统技术有限公司。
1.3 试验方法
1.3.1 β-葡萄糖苷酶的制备 将黑布林籽充分研磨,分别加入预冷(-20℃冰箱内放置2.0 h)的乙酸乙酯和丙酮搅拌脱脂1 ~2 次,晾干后过60 目筛得到粗酶粉;之后加入少量二氧化硅及磷酸盐抽提液(50 mmol·L-1,pH 值7.4,含有1 mmol·L-1EDTA 及100 mmol·L-1氯化钠)研磨15 min,转移至烧杯中温和搅拌(4℃)1.0 h,经离心(4℃、10 000 r·min-1、15 min)后取上清液得到粗酶液。
在冰浴条件下,将硫酸铵粉末加入到一定量的粗酶液中,使其饱和度至40%,搅拌30 min 后离心(4℃、10 000 r·min-1、15 min);取上清液,再次加入硫酸铵,至饱和度为65%,取离心沉淀溶于Tris-HCl 缓冲液(50 mmol·L-1,pH 值7.4)中透析过夜。 滤膜过滤透析液,上样至DEAE-52 阴离子交换柱(1.6 cm×20 cm),用含氯化钠浓度分别为0.10、0.15 和0.20 mol·L-1的Tris-HCl 缓冲液洗脱(1.5 mL·min-1),制得β-葡萄糖苷酶。
1.3.2 β-葡萄糖苷酶CLEAs 的制备及制备条件的优化 取一定量的β-葡萄糖苷酶液缓慢加入预冷的沉降剂,温和搅拌后聚集30 min;之后加入戊二醛交联一定时间,离心(4℃,6 000 r min-1,10 min)后用Tris-HCl缓冲液(50 mmol·L-1,pH 值7.4)洗涤2 次,制得β-葡萄糖苷酶CLEAs。
1.3.2.1 沉降剂的确定 取1.0 mL β-葡萄糖苷酶液加入4.0 mL 预冷的不同种类沉降剂,包括甲醇、95%乙醇、二恶烷、正丙醇、异丙醇、无水乙醇、丙酮、四氢呋喃(tetrahydrofuran, THF)、N,N-二甲基甲酰胺( N, N-dimethylformamide, DMF)、 二甲基亚砜(dimethyl sulfoxide, OMSO),以上述方法制得β 葡萄糖苷酶CLEAs 并测定酶活性。 探究不同种类沉降剂对β-葡萄糖苷酶CLEAs 活性的影响。
1.3.2.2 沉降剂比例的确定 确定沉降剂种类后,改变沉降剂与酶液的比例(1 ∶1、2 ∶1、3 ∶1、4 ∶1、5 ∶1),以上述方法制得β-葡萄糖苷酶CLEAs 并测定酶活性。探究沉降剂比例对β-葡萄糖苷酶CLEAs 活性的影响。
1.3.2.3 戊二醛浓度的确定 其他操作条件及方法不变,改变戊二醛浓度( 10、 20、 30、 40 和50 mmol·L-1),以上述方法制得β-葡萄糖苷酶CLEAs并测定酶活性。 探究戊二醛浓度对β-葡萄糖苷酶CLEAs 活的影响。
1.3.2.4 交联时间的确定 在确定戊二醛浓度后,其他操作条件及方法不变,改变戊二醛交联时间(0.5、1、2、3 和4 h),以上述方法制得β-葡萄糖苷酶CLEAs 并测定酶活性。 探究交联时间对β-葡萄糖苷酶CLEAs活性的影响。
1.3.3 酶活性的测定 将一定量的β-葡萄糖苷酶液或其CLEAs 置于3.0 mL(含15.0 μL 浓度为200 mmol·L-1的pNPG)的柠檬酸-磷酸氢钠缓冲液中(50 mmol·L-1,pH 值7.4)启动反应,5 min 后加入3.0 mL 1.0 mol·L-1的碳酸钠溶液终止反应,用分光光度计测定反应液中对硝基苯酚含量。 以每分钟β-葡萄糖苷酶水解释放1 μmol 对硝基苯酚所需酶量为1 个酶活单位。
1.3.4 β-葡萄糖苷酶CLEAs 的结构特征 将β-葡萄糖苷酶CLEAs、粗酶粉及游离酶经真空冷冻干燥(冷阱温度-45℃,真空度0.01 kPa,干燥时间24 h)后,用扫描电子显微镜观察其表面结构。
1.3.5 酶促合成红景天苷的研究 向7 个反应瓶中分别加入1.6 mL 丙酮、二恶烷、叔丁醇、THF、DMF、OMSO 和乙腈有机溶剂,0.4 mL 磷酸盐缓冲液(50 mmol·L-1,pH 值6.0),0.5 mmol 葡萄糖和5.0 mmol对羟基苯乙醇,将其置于恒温振荡器内(50℃,200 r·min-1)预热30 min,之后加入6.0 U β-葡萄糖苷酶CLEAs 启动反应。 定时取样20 μL,加入流动相稀释50 倍,于275 nm 波长处用高效液相色谱仪测定红景天苷的产率。 流动相为甲醇-水(60 ∶40,v ∶v),流速为1.0 mL·min-1, 红景天苷保留时间为2.47 min。
1.3.6 β-葡萄糖苷酶CLEAs 热稳定性的测定 在反应瓶中分别各加入1.6 mL 二恶烷、0.4 mL 磷酸盐缓冲液(50 mmol·L-1,pH 值6.0)、6.0 U β-葡萄糖苷酶CLEAs,置于恒温振荡器内(200 r·min-1)于不同温度(40~60℃)下保温2.0 h,过滤除去溶剂,自然干燥4.0 h 后测定其剩余酶活性。
1.3.7 β-葡萄糖苷酶CLEAs 的操作稳定性测定 1.3.5 中酶促反应结束后,过0.45 μm 有机滤膜除去溶剂,用新鲜反应溶剂洗涤β-葡萄糖苷酶CLEAs 2次,自然干燥4.0 h 后,再次加入至新鲜反应体系中,在相同条件下启动酶促红景天苷的合成反应,并测定每次的剩余酶活性,重复操作数批次。
1.4 数据分析
采用Microsoft Office Excel 2010 对试验数据进行统计,采用Origin 8.5 软件绘图。
2 结果与分析
2.1 沉降剂对β-葡萄糖苷酶CLEAs 活性的影响
在酶蛋白溶液中添加适宜的沉降剂如无机盐、有机溶剂或非离子型高分子聚合物可改变溶液体系的介电常数或蛋白的水合状态,从而降低蛋白分子在溶液中的溶解度,引起蛋白分子聚集而形成非共价结合的超分子结构[15]。 良好的沉降剂应能使溶液状态的酶完全析出,且对酶活性的影响较小。
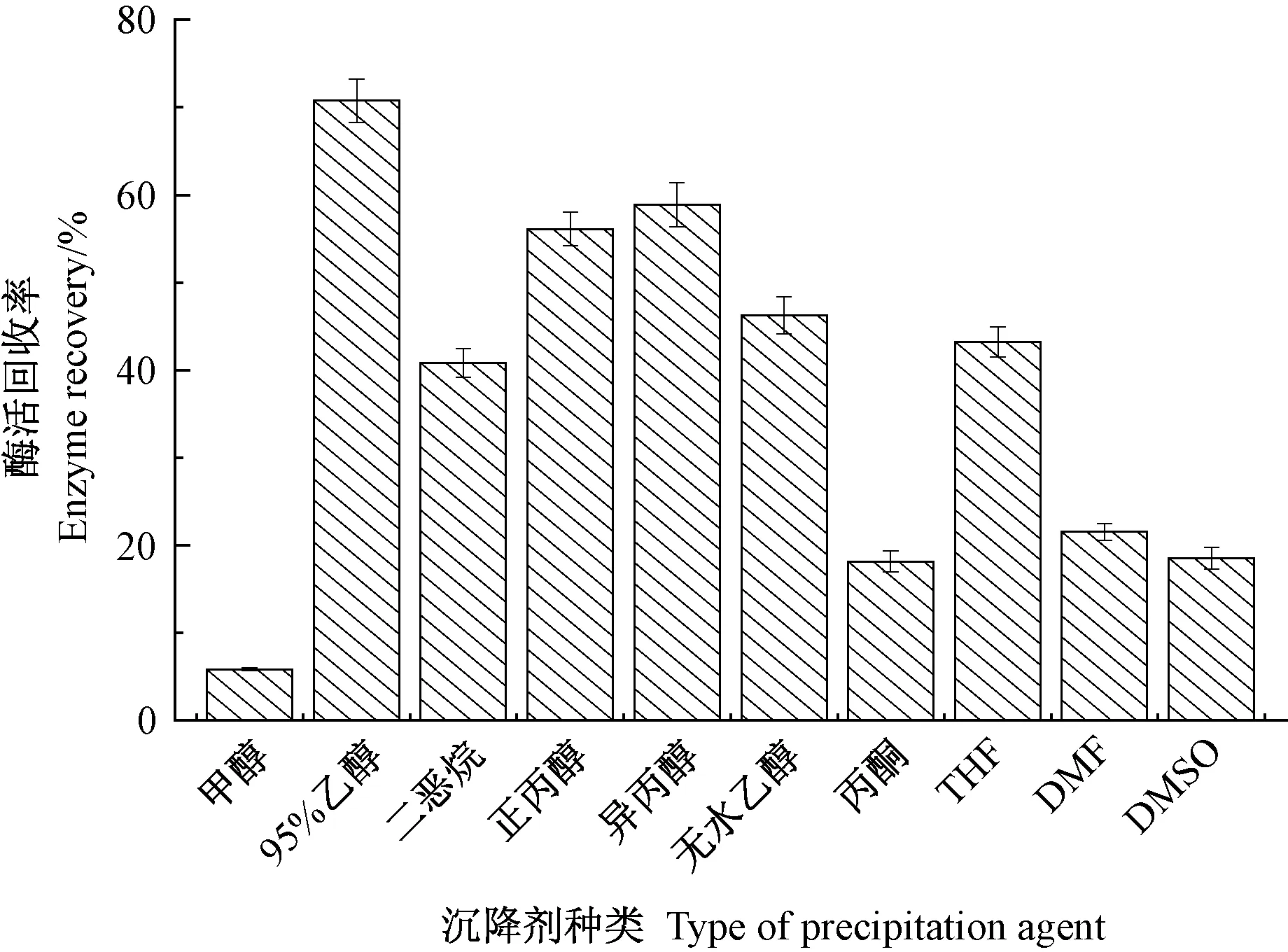
图1 沉降剂对CLEAs 活性的影响Fig.1 Effect of different precipitation on the activity of CLEAs
由图1 可知,沉降剂的理化特性对β-葡萄糖苷酶CLEAs 活性影响较大。 当以强极性溶剂如甲醇、丙酮、DMSO 和DMF 为沉降剂时,剩余酶活性仅为5.9%~21.5%,酶活性损失严重,不宜作为该酶溶液的沉降剂。 二恶烷、正丙醇、异丙醇、无水乙醇以及THF 虽然对酶分子的损伤较小,但酶活回收率仍较低(40.8%~58.9%);而当沉降剂为95%乙醇时,β-葡萄糖苷酶CLEAs 的酶活回收率最高, 达70.8%。 此外,在CLEAs 制备过程中,沉降剂浓度也是影响蛋白沉降效率的重要参数,过多的沉降剂会影响蛋白分子之间的相互作用和聚集状态,导致酶失去活力[16-17]。 由图2可知,当95%乙醇的添加量是酶液体积的3 倍时,获得的β - 葡萄糖苷酶 CLEAs 的酶活回收率最高(79.5%),效果最好。 故后续试验选择95%乙醇作为沉降剂,添加量为酶液体积的3 倍。
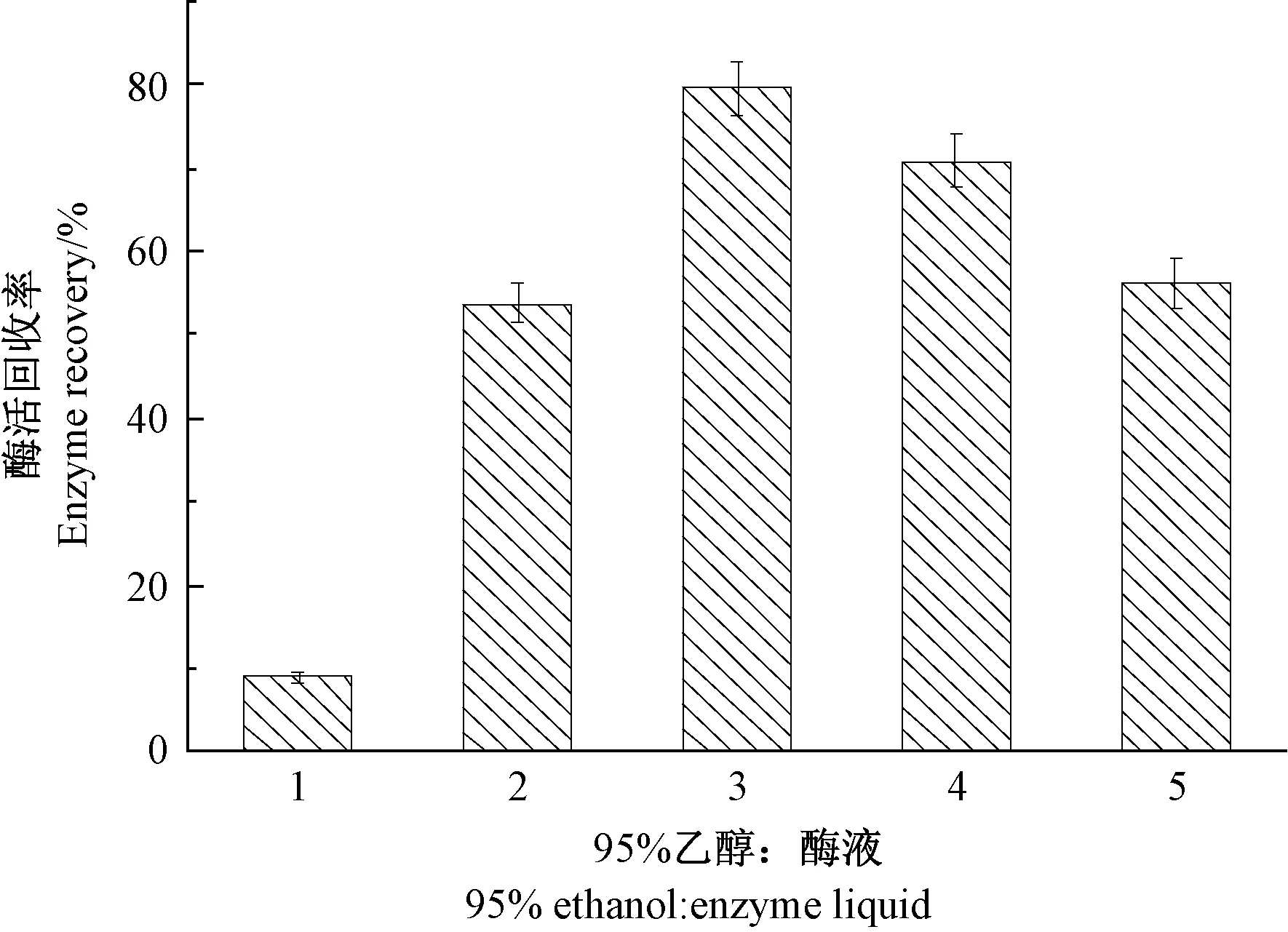
图2 沉降剂比例对CLEAs 活性的影响Fig.2 Effect of different volume ratios of precipitant to enzyme liquid on the activity of CLEAs
2.2 戊二醛交联剂对β-葡萄糖苷酶CLEAs 活性的影响
戊二醛是一种廉价易得的交联剂,由于其分子较小,极易与蛋白内部结构中的氨基酸残基相互作用,使得蛋白分子紧密结合,因而广泛用于蛋白的交联[12,18]。 研究表明,交联剂的浓度和交联时间均会影响CLEAs 的大小和活性[19-21]。 由图3 可知,当戊二醛浓度由10 mmol·L-1逐渐增加至50 mmol·L-1时,β-葡萄糖苷酶CLEAs 的酶活回收率呈先增加后减小的趋势,当戊二醛浓度为30 mmol·L-1时,β-葡萄糖苷酶CLEAs 的酶活回收率高达91.4%;当戊二醛浓度为50 mmol·L-1时,酶活回收率降低至69.9%。 由此可见,戊二醛的浓度过低或过高均会导致β-葡萄糖苷酶CLEAs 活性的损失。 与之类似,交联时间也会对β-葡萄糖苷酶CLEAs 活性产生影响,在所考察的范围内,当交联时间为1.0 h 时,酶活回收率最高(图4)。
2.3 β-葡萄糖苷酶CLEAs 的结构特征结果
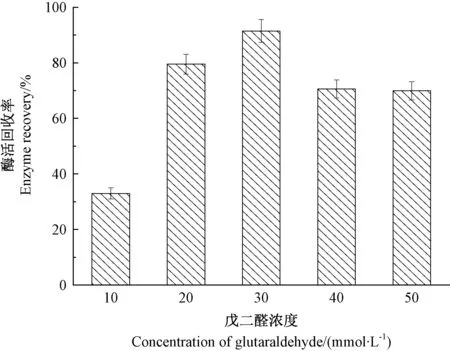
图3 戊二醛浓度对CLEAs 活性的影响Fig.3 Effect of different glutaraldehyde concentrations on the activity of CLEAs
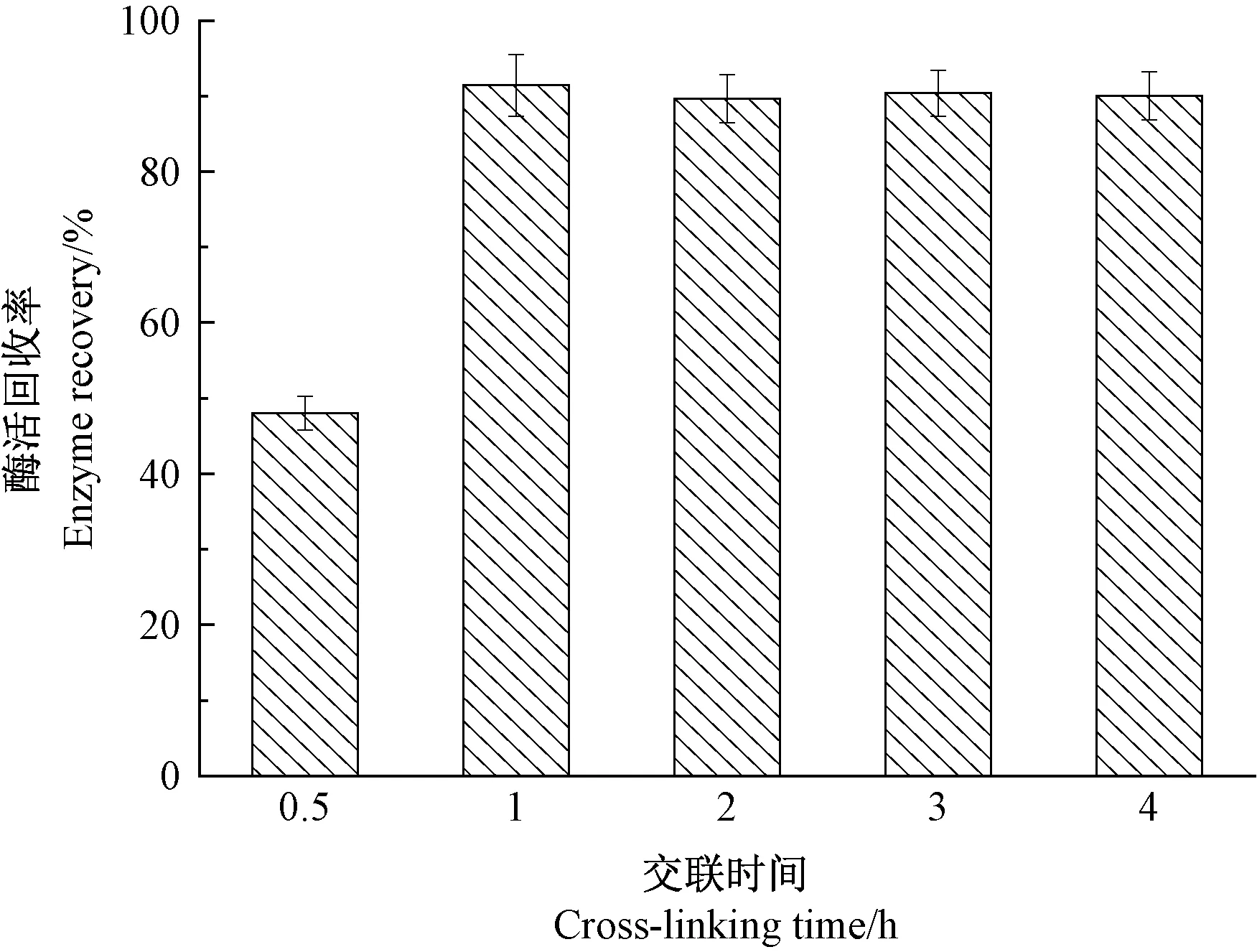
图4 交联时间对CLEAs 活性的影响Fig.4 Effect of different cross-linking time on the activity of CLEAs
CLEAs 是否具有适宜的大小和丰富的孔道结构是决定其制备成功与否的关键。 Schoevaart 等[15]研究表明,不同种类的CLEAs 存在2 种类型,一种是表面糖基化率低且疏水性基团多,而另一种则是表面糖基化程度高且亲水性基团丰富。 由图5-A 可知,黑布林籽粗酶粉表面呈较大的颗粒状,表面光滑;而游离酶交联前则表面粗糙(图5-B),呈层状结构。 经交联固定化后(图5-C),CLEAs 属于上述第二种类型,表面为无定型的致密多孔道结构,与交联前相比拥有更大的比表面积,酶分子可与底物结合的活性位点更多,有助于降低底物的扩散限制,提高催化效率。

图5 不同形式β-葡萄糖苷酶电镜扫描结果(10 000×)Fig.5 Scanning electron mircophotographs of different forms of β-glucosidase (10 000×)
2.4 β-葡萄糖苷酶CLEAs 合成红景天苷的研究结果
以有机介质中红景天苷的合成为模型反应,对比研究了有机介质中不同形式β-葡萄糖苷酶对合成红景天苷的影响。 由表1 可知,对于同一溶剂中不同酶的催化特性而言,CLEAs 的催化效果最佳,其次是粗酶粉,而游离酶的效果最差。 其中,CLEAs 在二恶烷中表现出最高的催化活力,反应72 h 后,红景天苷的产率达到21.7%。 Laane 等[22]认为酶在极性参数2<logP<4 的溶剂中表现出中等活性,而在logP<2 的溶剂中酶活较低,在logP>4 的溶剂中酶活较高。 本研究结果与上述规律不相符。 Yang 等[23]研究发现,除溶剂极性对酶分子表面必需水的影响外,溶剂分子的大小、空间结构及进出酶活性中心的能力也是重要的影响因素。 不同形式存在的酶其空间构型不同,从而影响有机溶剂进入酶分子活性位点的难易程度,进而影响酶的催化过程。
2.5 β-葡萄糖苷酶CLEAs 的稳定性研究结果
稳定性参数是衡量固定化酶能否满足工业化生产需求的重要指标,具有较高稳定性的酶在应用过程中可降低生产成本,并实现连续化、自动化的生产操作。将游离酶和CLEAs 分别在不同温度下保温一定时间后比较酶活回收率发现(图6),保温温度较低时(40 ~50℃),二者之间的酶活回收率相差不大;但在60℃保温2.0 h 后,CLEAs 的酶活回收率为75.1%,是游离酶的6.1 倍,表明CLEAs 有着较好的温度耐受性和更宽的耐热范围。 同样,尽管随着使用批次的增加,CLEAs酶活回收率呈逐渐下降的趋势,但在重复使用8 次后,其酶活回收率仍然保持为原来的73.5%(图7),表明CLEAs 具有良好的操作稳定性,这有助于降低催化剂工业化使用的成本和满足连续化操作的要求。

表1 不同的形式β-葡萄糖苷酶对合成红景天苷的影响Table 1 Effect of different forms of β-glucosidases on the synthesis of salidroside

图6 CLEAs 的热稳定性Fig.6 The thermal stability of CLEAs
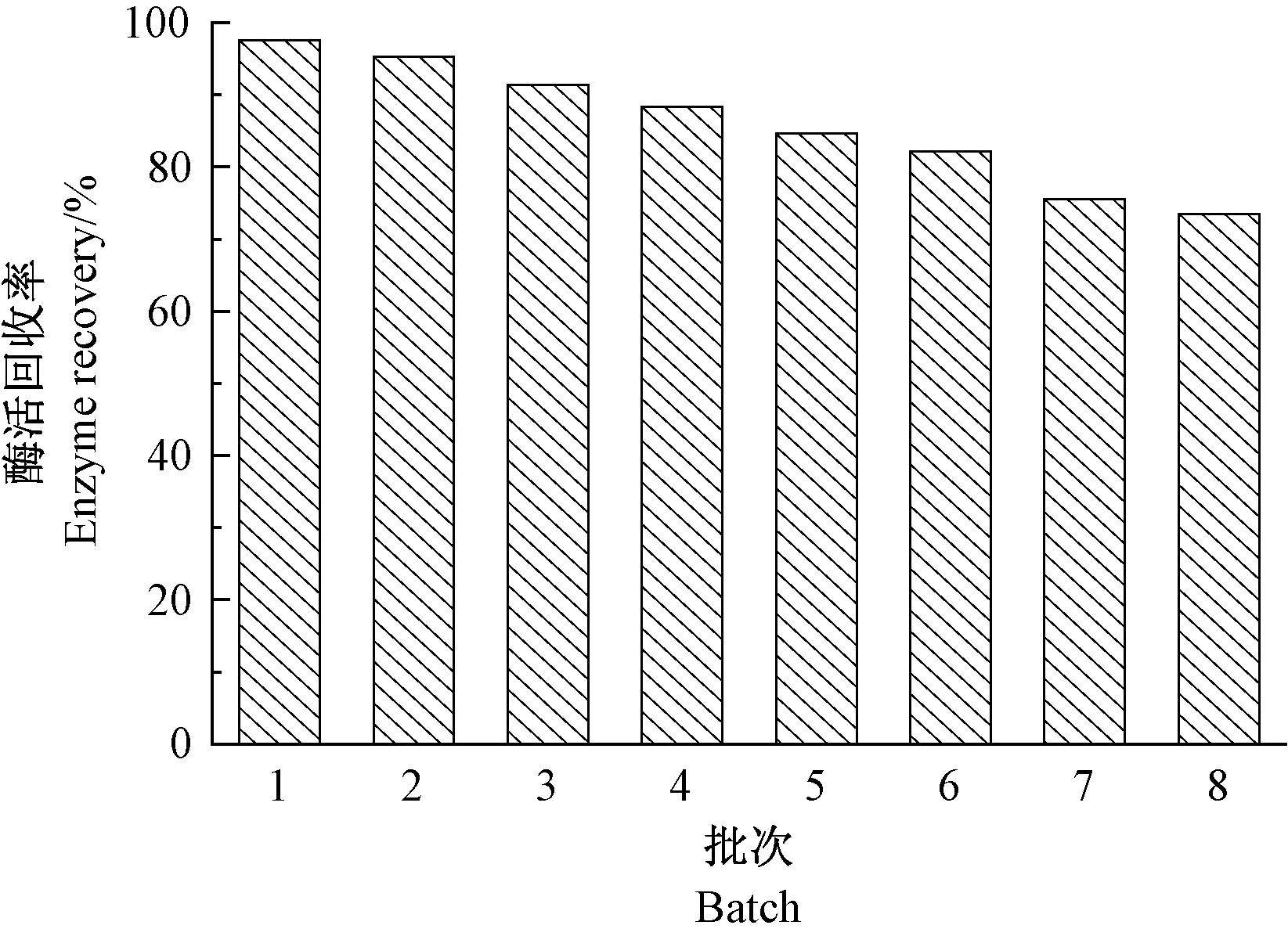
图7 CLEAs 的操作稳定性研究Fig.7 The operational stability of CLEAs
3 讨论
蛋白沉降剂是影响CLEAs 制备的关键因素,强极性沉降剂容易剥夺酶分子表面的结合水,会致其“柔性”降低,从而引起沉降酶蛋白的活性丧失[24-25]。 同时,针对不同的酶蛋白其最适沉降剂种类也会改变,如邢肖肖等[26]研究表明,β-半乳糖苷酶的最适沉降剂为异丙醇,区晓阳等[27]研究表明,碱性蛋白酶的最适沉降剂为90%叔丁醇。 本试验发现β-葡萄糖苷酶的最佳沉降剂为95%乙醇,而且沉降剂还会影响β-葡萄糖苷酶CLEAs 的形态,如以95%乙醇作为最优沉降剂所制备的CLEAs 经离心重悬后,可得颗粒均一、分散较好的悬浊液,且可以缓慢地自发沉降,这有利于固定化酶的分离及回收利用,而其他沉降剂制备的CLEAs在溶液中颗粒大小不一,分散性较差。
此外,诸多研究表明,戊二醛浓度对CLEAs 的活性有影响[18-19,26-28]。 较低浓度的戊二醛会导致蛋白交联不充分,CLEAs 中酶蛋白的含量较低;而戊二醛浓度过高则会导致蛋白过度交联,使CLEAs 的“刚性”较强,传质阻力增加,致使酶的活性降低[29]。
扫描电镜观察酶的表面结构发现,与粗酶粉和游离酶相比,CLEAs 表面呈无定型的致密多孔道结构,且具有更大的比表面积,这种酶结构可提供更多与底物结合的活性位点,更利于底物、产物的扩散和CLEAs催化效率的提升。
本研究以酶促红景天苷合成体系为反应模板进一步探讨CLEAs 在实际应用中的效果,结果显示游离态的酶分子更容易受到有机溶剂的影响,进而影响酶活性中心的“柔性”结构,导致酶活性损失较大[30];虽然粗酶粉中含有的脂质、杂蛋白等成分有助于减弱有机溶剂对酶分子带来的损伤,在一定程度上维持酶的活性,但其催化产率较低。 本研究发现,β-葡萄糖苷酶经交联固定化后,除具有优良的表面结构外,其适宜的“刚性”结构可有效抵御有机溶剂对酶蛋白分子的失活作用,解决游离酶在合成红景天苷过程中不稳定的问题,最终提高该酶在有机溶剂中合成红景天苷的效率。 这与邢肖肖等[26]利用β-半乳糖苷酶CLEAs 制备功能性低聚半乳糖、陈海龙等[18]利用脂肪酶CLEAs合成月桂酸淀粉酯、董守利等[28]使用交联荧光假单胞菌脂肪酶聚集体催化甘油解制备甘油二酯等的研究结果相一致,CLEAs 具有比游离酶更好的可重复性和稳定性,通过沉降交联制备CLEAs 是一种较好的无载体固定化酶的方法。
4 结论
本研究通过考察沉降剂和交联剂等因素制备了具有高酶活回收率的β-葡萄糖苷CLEAs,并以此为催化剂建立了高效合成红景天苷的体系,该固定化糖苷酶具有高效、高选择性合成糖苷类化合物的能力及良好的热稳定性和操作稳定性。 本研究不仅深化了交联固定化酶领域的基础理论知识,也为糖苷类化合物的绿色合成提供了新途径,具有重要的理论研究和工业化应用价值。
