水稻黑条矮缩病抗病品种的筛选及其抗病机制初探
2020-06-30李路路侯士辉张合红孙宗涛檀根甲陈剑平
李路路 侯士辉 张合红 孙宗涛 檀根甲 陈剑平
(1安徽农业大学植物保护学院,安徽 合肥 230036;2宁波大学植物病毒学研究所,浙江 宁波 315211)
水稻黑条矮缩病是一种由水稻黑条矮缩病毒(rice black-streaked dwarf virus, RBSDV)引起的病毒性病害,在我国南方稻区广泛流行[1-2]。 RBSDV 属呼肠孤科(Reoviridae) 斐济病毒属(Fijivirus) 中的第二组成员[3],主要经灰飞虱以持久性方式传播,但不会经卵传递给子代幼虫[4]。 RBSDV 寄主范围广泛,除了能侵染水稻、玉米外,还能在大麦、小麦、高粱、看麦娘、狗尾草等禾本科植物上引起病害[5]。 感染RBSDV 的水稻一般表现为植株矮小、叶色浓绿,茎秆基部表面有纵向瘤状乳白色凸起,不抽穗或抽包颈穗,穗小颗粒少,直接影响水稻产量,严重影响我国粮食生产安全[6-7]。
在我国,水稻黑条矮缩病最早于1963 年在浙江省余姚县的早稻上发现,同时在上海市嘉定和奉贤县、江苏省苏州和镇江等地区的水稻生产上有局部危害[8]。1991-2002 年浙江杂交稻区水稻黑条矮缩病又再次流行成灾,发病面积达11.79 万hm2,给农业生产造成了巨大的经济损失[9]。 目前对于RBSDV 的防控主要依赖于喷施化学农药,但由于灰飞虱的迁飞能力较强,防治效果并不理想,且长时间喷施化学农药对环境造成了一定程度的污染[10]。 因此,筛选抗性品种对于防治田间水稻黑条矮缩病至关重要。
植物激素茉莉酸(jasmonic acid,JA)和水杨酸(salicylic acid,SA)是调节植物免疫的重要内源性信号分子,与植物的抗病性存在密切关系[11-13]。 现已明确JA 和SA 可通过激活植物体内的防御基因表达,从而介导植物体对病原菌的抗性[14-15]。 其中,MYC2 是JA信号途径抵御生物胁迫和非生物胁迫中的关键转录因子,正调控植物的抗胁迫能力[16-17];病程相关基因非表达子1(non-expresser of PR1,NPR1)是SA 途径的重要抗性基因,NPR1 基因的大量表达可以诱导植物的系统获得性抗性[18]。
本研究选择20 个浙江省主栽水稻品种进行室内人工饲养灰飞虱接毒,并栽种田间自然发病,筛选对RBSDV 抗性较强的水稻品种,以期为今后水稻黑条矮缩病的防治工作提供优良抗性品种。
1 材料与方法
1.1 试验材料
供试水稻品种:淮5、浙粳99、秀水14、秀水134、嘉禾218、宁88、绍糯9714、中嘉早17、中早39、浙优18、Y 两优900、Y 两优17、Y 两优302、Y 两优957、深两优5814、甬优15、甬优9 号、甬优538 和甬优17,均购自浙江勿忘农种业股份有限公司。
本研究使用的RBSDV 病苗采自山东省农业科学院试验田,无毒灰飞虱由江苏省农业科学院植物保护研究院周益军研究员提供。
1.2 RBSDV 人工接毒试验
参照周彤等[19]、李硕等[20]的方法对灰飞虱进行饲毒。 首先将无毒的灰飞虱成虫扫入播有二至三叶龄水稻苗的烧杯内,产卵3~4 d 后扫出,6~8 d 后即可孵育出幼虫。 将新孵育出的1 ~2 日龄的无毒灰飞虱幼虫扫在RBSDV 病株上,饲喂3 ~4 d 后转移到健康水稻苗上,渡循回期10 ~12 d。 当病毒在灰飞虱体内循回到10 d 时,用ELISA-dot 方法检测灰飞虱带毒率。同时将待接毒的所有水稻品种播种于不同烧杯内,每个品种播3 杯重复,每杯约播种35 粒。 所有烧杯均放置在25℃温室内生长7 d,按照5 头/株的比例将带毒灰飞虱转移至不同品种水稻苗上,统一将所有秧苗经带毒灰飞虱咬食4 d,然后扫除全部灰飞虱并将所有品种水稻秧苗统一移栽大田,30 d 后取样。
1.3 水稻发病症状观察
RBSDV 侵染30 d 后,发病水稻的典型症状表现为植株矮小,叶色浓绿,分蘖增多,严重时还会引起植株枯死[21],易于与健康水稻区分。 统计田间水稻株高并取样,用液氮保存于-80℃。
1.4 植物总RNA 提取
采用Trizol 法。 首先将离心机预冷至4℃,称取100 mg 新鲜水稻叶片,装入盛有玻璃珠的2 mL RNAFree 离心管中,液氮速冻后放置于Tissuelyser-96 多样品组织磨样仪(上海净信实业发展有限公司)中进行震荡(30 Hz,60 s)。 样品震碎后加入1 mL Trizol,混匀后4℃放置5 min,然后加入200 μL 氯仿(Trizol:氯仿=1 ∶0.2,v/v),上下翻转15 s,混匀后4℃放置5 min,再于4℃条件下12 800 r·min-1离心20 min,保留上清液。 吸取上清液至新的1.5 mL RNA-Free 离心管中(用RNA-Free 的枪头),加入等量异丙醇,混匀后-40℃放置2 h,然后4℃条件下12 800 r·min-1离心20 min,弃上清液,沉淀用RNA-Free 75%酒精洗涤2 遍,最后经LABCONCO 冷冻干燥机(无锡凯派克斯科技有限公司) 抽真空,烘干后加入适量焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)水溶解管中RNA。
1.5 cDNA 逆转录
采用Vazyme 逆转录试剂。 20 μL 反应体系如下:移液器吸取1 μg 植物总RNA,加入4 μL 4×gDNA wiper Mix,用DEPC 水补齐至16 μL,轻轻吹打混匀后置于42℃金属浴2 min,去除基因组DNA。 再加入4 μL 5×HiScript ⅡqRT Super Mix Ⅱ,轻轻吹打混匀后放入PCR 仪(Eppendorf,德国)进行逆转录,逆转录程序:50℃,15 min;85℃,5 s。
1.6 RT-qPCR 试验
采用上海翊圣生物科技有限公司的HieffTMqPCR SYBR® Green Master Mix (Low Rox Plus) 试剂。 10 μL 反应体系如下: 向0.5 μL 逆转录合成的cDNA 中加入3.9 μL 灭菌水进行模板稀释,每孔加该模板4.4 μL;另外分别吸取0.3 μL 引物F 和引物R 混入5 μL HieffTMqPCR SYBR® Green Master Mix 中,混匀后,每孔继续加入5.6 μL 该混合液。 反应程序:95℃预变性5 min;95℃变性10 s,60℃退火20 s,72℃延伸20 s,共40 个循环。 PCR 结束后根据溶解曲线判断引物特异性,采用2-ΔΔCt法分析基因相对表达量[22]。 共做3 次独立试验,每次3 个生物学重复,2 个技术重复。
2 结果与分析
2.1 水稻田间发病率统计
由表1 可知,粳稻品种在接种RBSDV 后的发病率相对较高,其中,淮5、浙粳99、秀水14、秀水134等品种的发病率均在40%~70%之间,而籼稻品种在接种RBSDV 后的发病率较低,处于20%~45%范围内。 粳稻品种受RBSDV 侵染后的植株尤为矮小,株高仅10 ~25 cm,发病症状严重,而籼稻品种感病后的株高仍能维持在20 ~50 cm,且发病症状轻,尤其是两优系列品种(深两优5814、Y 两优302 等)表现更明显(图1)。
2.2 不同水稻品种病毒含量差异分析
为了进一步检测RBSDV 侵染后不同水稻品种体内的病毒含量,本试验选择6 个不同发病程度的水稻品种(包括3 个粳稻品种和3 个籼稻品种)进行RTqPCR,分析不同水稻品种RBSDV 侵染后体内的病毒RNA 水平。 由图2 可知,与健康株比较,RBSOV 侵染后的所有水稻样品体内的病毒RNA 水平均出现显著性上调。 为了便于分析,选用发病程度居中的甬优17 作为参照,结果表明,粳稻品种淮5、秀水14 在RBSDV 侵染后病毒的S4、S6、S10 基因在RNA 水平上显著上调,而籼稻品种深两优5814 和Y 两优302 中的病毒RNA 水平相对较低,这与大田水稻株高和发病率统计结果一致。
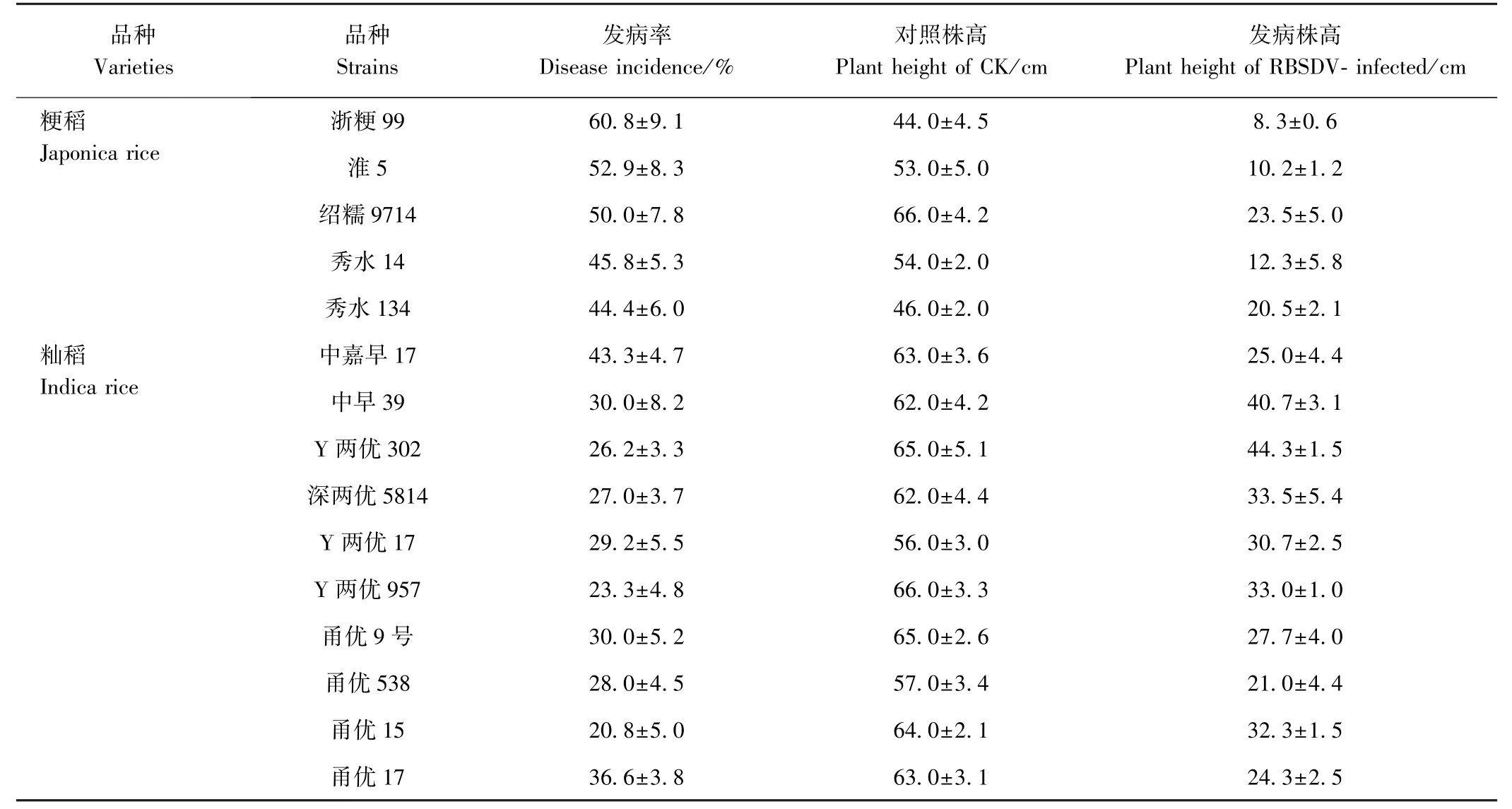
表1 不同水稻品种发病率统计表Table 1 Disease incidence of RBSDV inoculated rice plants

图1 不同水稻品种的发病症状Fig.1 Symptoms in RBSDV-infected rice varieties
2.3 不同水稻品种JA、SA 信号途径相关基因的差异表达分析
JA 和SA 在植物免疫过程中发挥重要作用,MYC2 和NPR1 分别是JA、SA 信号通路的关键基因,调控着植物的防御反应[23]。 本研究采用RT-qPCR 技术分析健康及RBSDV 感病水稻样品中OsMYC2 和OsNPR1 基因的表达水平。 在淮5、秀水14、深两优5814 和Y 两优302 水稻中,感病植株OsMYC2 及OsNPR1 的mRNA 水平显著高于健康植株(图3)。 此外,籼稻品种深两优5814 和Y 两优302 中OsMYC2 和OsNPR1 在mRNA 水平的上调倍数也显著高于粳稻品种淮5 和秀水14。

图2 定量检测RBSDV 基因侵染后不同品种水稻体内病毒RNA 水平Fig.2 Expression level of genes of RBSDV RNA in RBSDV-infected rice varieties
3 讨论
研究表明,对于水稻条纹叶枯病的侵染,粳稻一般抗病性较差,且在所有试验水稻品种中未找到能够对水稻条纹叶枯病表现出免疫的品种[24]。 在众多水稻品种资源中,抗白叶枯的抗源多属籼稻[25-26]。 张小明等[27]利用回交育种快速有效地将籼稻白叶枯抗性基因成功转育到粳稻品种中,极大提高了粳稻抗白叶枯病的能力。 本研究分析了20 个水稻品种对RBSDV 的田间抗性,在接种RBSDV 30 d 后,籼稻深两优5814 和Y 两优302 的病苗株高、发病率及病毒RNA 水平都低于粳稻淮5 和浙粳99,说明籼稻品种可能比粳稻品种对RSBDV 的抵抗能力更强。 综上所述,粳稻品种的抗病能力较弱,而籼稻品种的深两优5814 和Y 两优302 抗病能力更强,并不仅局限于对RBSDV 表现出抗性,这可能是一个普遍存在的现象。
植物在受到病原菌侵染时,体内复杂的激素网络可以迅速响应防御反应。 前期研究表明,在RBSDV侵染水稻过程中,JA 途径相关基因的表达水平会显著升高以响应JA 介导对RBSDV 的防御能力[28]。 同样在烟草花叶病毒(Tobacco mosaic virus,TMV)浸润本氏烟(N. benthamiana)时,单独喷施JA 或SA 都能够有效抑制TMV 的侵染,JA 处理后再喷施SA 会对TMV的抑制效果更明显[29]。 本研究通过RT-qPCR 分析发现,RBSDV 侵染后,所有水稻样品中的OsMYC2 和OsNPR1 在mRNA 水平上全部上调表达,说明当RBSDV 侵染植物体时,体内的JA、SA 抗病途径被激活,防御反应开始应答。 而籼稻深两优5814、Y 两优302 的上调倍数显著高于粳稻淮5、秀水14,在一定程度上更能说明籼稻深两优5814 和Y 两优302 可能比粳稻更能抵抗RBSDV 的侵染。
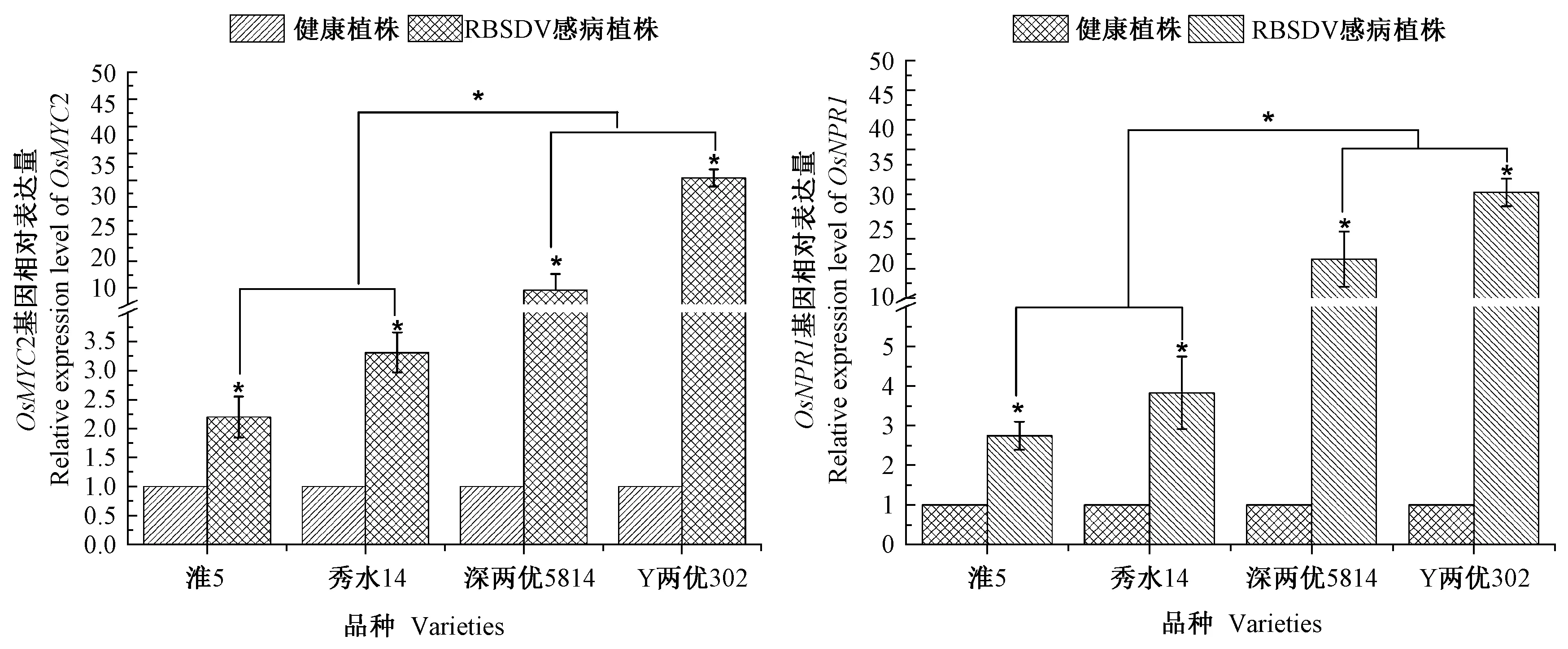
图3 RBSDV 侵染后不同水稻品种OsMYC2、OsNPR1 基因的差异表达Fig.3 Expression level of OsMYC2 and OsNPR1 in different rice varieties after RBSDV infected
4 结论
本研究结果表明,RBSDV 侵染后籼稻的田间发病率和病毒含量比粳稻更低,发病症状更轻,尤其是两优系列品种如深两优5814 和Y 两优302 的表型最为明显,在RBSDV 的侵染过程中表现出较强的抵抗能力,且多次室内接种RBSDV 试验结果均一致,表明在抗RBSDV 水稻品种筛选工作中,筛选出的籼稻深两优5814 和Y 两优302 水稻品种不仅能够抵抗RBSDV 的侵染,而且具有稳定的抗性。 此外,感病粳稻淮5 和浙粳99 体内OsMYC2 和OsNPR1 的上调倍数远低于籼稻深两优5814 和Y 两优302,说明各籼粳稻品种对RBSDV 所表现出的不同抗性与其体内的JA 和SA 激素水平有关。 这为今后RBSDV 的防治工作提供了理论基础,并为抗病育种筛选提供了新的思路。
