间充质干细胞因子群对角膜损伤药效研究及临床初探
2020-06-29梁璐马涛王斌韩忠朝
梁璐,马涛,王斌,韩忠朝
(1.天津百恩生物科技有限公司天津 300308;2.北京汉氏联合生物技术股份有限公司北京 100176)
角膜作为高度特化、复杂的器官,经常因为炎症或外伤等因素导致过度血管化、结膜化、角膜瘢痕,而引起角膜透明度下降甚至失明。治疗中应尽可能恢复角膜的完整性和透明度,角膜损伤治疗的首要策略是控制炎症,防止感染,必要时进行手术治疗例如金刚砂车针、格状切开或者结膜瓣遮盖术等。现有的促角膜修复的药物较少,干细胞特有的组织损伤修复功能使其对角膜损伤修复的治疗具有非常独特的优势。
干细胞(stem cells)是各种细胞的起源细胞,依靠强大的组织再生能力而成为了再生医学的重要工具。间充质干细胞(Mesenchymal stem cells,MSC)是一类具有多向分化潜能和自我更新能力的干细胞[1],MSC 具有易获得、易扩增、低免疫原性和无伦理争议等优势,是临床应用最广泛的种子细胞之一。MSC 具有调节血管新生的作用,表达促血管新生因子,同时也可以表达抑血管新生因子,当与人的角膜上皮细胞共同培养时,MSC 上调了VEGF 的表达,同时,也表达了抑血管新生因子TSP1,下调了MMP-2 和MMP-9 的表达[2]。MSC 还具有抗瘢痕的作用,通过下调TGF-β 1 和α -平滑肌肌动蛋白(α -SMA)并上调TGF-β 3 来发挥抗瘢痕的作用[3]。
间充质干细胞因子群是干细胞分泌的蛋白产物,干细胞因子具有促修复、调节免疫、抑制瘢痕产生等许多干细胞的生物学特性。经对比试验证明,干细胞因子的治疗效果和干细胞的治疗效果相当[4]。同时其使用和保存条件与蛋白类药物相同,使用和运输都更加方便和经济。本文旨在研究间充质干细胞因子群对大鼠角膜化学烧伤的治疗作用及进行临床应用的初步探讨。
1 材料与方法
1.1 试验动物
清洁级健康成年SD 大鼠(购自维通利华),雌雄各半,体重200~220g,24 只。适应性饲养1 周,正常饮食饮水。试验前,裂隙灯下检查双眼附属器及眼前段,排除眼部病变。
1.2 主要仪器和试剂
裂隙灯显微镜、裂隙灯数字图像处理系统、眼科手术显微镜、光学显微镜、显微镜照相机、石蜡切片机、多媒体医用彩色图像病理分析系统等。
戊巴比妥钠、1mol/L NaOH 溶液、抗生素滴眼液、生理盐水、2%荧光素钠等。
1.3 试验分组
对照组:生理盐水;治疗组:干细胞因子滴眼液(天津百恩生物科技有限公司制)。
1.4 角膜碱烧伤模型制备
采用4%戊巴比妥钠腹腔注射麻醉。直径3mm 单层滤纸片浸泡在1mol/L NaOH 溶液中,使之达到饱和状态,滤纸吸去过多碱液,将其贴敷于角膜中央40s。立即用生理盐水冲洗烧伤区及结膜囊直至pH=7。回笼后正常饲养。
1.5 动物分组及给药治疗
随机分组,每组造模后24h 开始给药治疗,给药15 μL/次/眼,3 次/d,使用周期20d,观察周期21d。
1.6 观察指标
1.6.1 角膜形态学变化观察角膜缺损面积,在造模及治疗后第1、3、7、10、14、21d,采用2%荧光素钠染色,于裂隙灯下观察缺损面积;观察角膜缺损发生率及角膜穿孔率、前房积血情况。
1.6.2 角膜透明度、水肿程度检查 造模后第1、3、5、7、10、14、21d,于裂隙灯下观察角膜透明度、水肿程度。
角膜透明度评分标准[5]:0 分,角膜透明、无混浊;1 分,极轻度角膜浅表混浊,虹膜清晰可见;2 分,轻度角膜基质混浊,可见瞳孔缘及虹膜血管;3 分,中度角膜基质混浊,仅见瞳孔缘;4 分,重度角膜基质混浊,仅见前房;5 分,极重度角膜混浊,前房亦不可见。
角膜水肿程度评分标准:0 分,无水肿(角膜厚度正常);1 分,轻度水肿(角膜厚度轻度增加);2 分,中度水肿(角膜厚度中度增加);3 分,重度水肿(角膜厚度重度增加)。
1.6.3 角膜新生血管(CNV)长度及面积的测量观察造模后及治疗后第1、3、7、14、21d 的CNV 长度及面积。大鼠称重,经腹腔麻醉(同前法),采用裂隙灯数字图像处理系统观察角膜新生血管形成情况,并拍照。照片经图像分析,通过计算机分析系统测量从角巩缘向心性生长的连续且弯曲度小,并于角巩缘切线垂直的新生血管长度。以大鼠角膜9 点到3 点划一横线将角膜分成上下两部分,再由12 点到6 点划一条线,这两条线将角膜分成4 个象限。每张图片在4 个象限测5 个值取其平均值,得出伤后不同时间点大鼠角膜新生血管的长度。带入电脑数学模型公式计算面积:A=C/12×3.1416[r2-(r-1)2][5],其中C 为CNV 累计角膜的圆周钟点数,l 为CNV 从角膜缘伸入角膜的长度,r 为角膜半径。CNV 总面积等于4 个象限面积之和。
1.7 统计学方法
采用SPSS 11.5 统计学软件进行处理,测量指标用平均值± 标准差表示,差异显著性采用重复测量数据分析检验,部分资料采用多样本等级检验。
1.8 临床疗效观察
1)临床患宠数量:3 只宠物患猫。
2)临床症状:因各种原因引起的角膜损伤或溃疡,或行瞬膜遮盖术,无眼部肿瘤,无蛋白过敏史。
3)临床检查:患宠泪液常规检查基本正常;角膜荧光素钠染色呈阳性,或可见角膜穿孔或溃疡;或肉眼可见角膜水肿、浑浊,表面大量浅表新生血管形成血管翳、或肉芽组织增生等。
4)治疗方法:使用前用生理盐水冲洗患眼眼表,滴注干细胞因子滴眼液,4 次/d,连续使用;必要时与抗生素滴眼液配合使用。患宠佩戴伊丽莎白圈,防止自主挠伤或舔舐患处。
2 试验结果
2.1 角膜形态学修复观察
动物造模后,荧光观察角膜缺损率100%。试验各组治疗后,均出现不同程度的修复愈合,其中治疗组的愈合快于对照组,荧光染色显示在治疗的第7d 可以显著的观察到治疗组的角膜上皮迅速修复完成,而对照组仍有大面积的缺损,治疗组的愈合时间明显缩短,具有显著性差异(P<0.05,图1)。
从角膜透明度和水肿的临床评分来看,治疗组角膜修复显著。如图2 所示,治疗组角膜透明度评分与对照组比较,治疗的第14、21d 有显著性差异(P<0.05)。
2.2 角膜新生血管观察
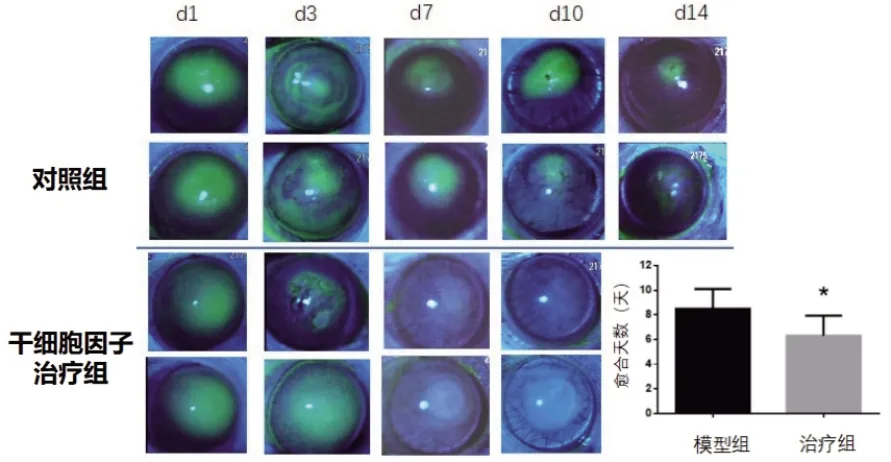
图1 各组不同时期角膜修复荧光染色比较
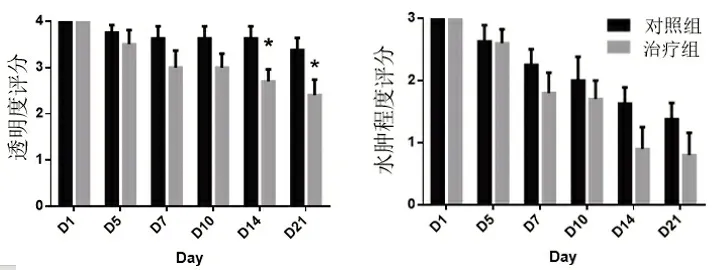
图2 各组不同时期角膜水肿度和透明度比较
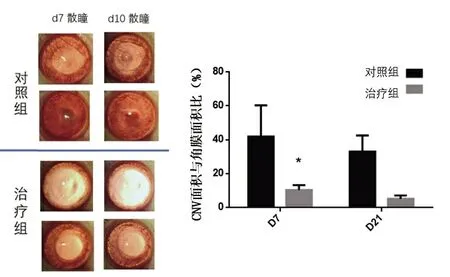
图3 各组不同时期角膜新生血管观察
造模及治疗后各组均有不同程度的血管新生情况,其中治疗组的新生血管短且粗。随着治疗时间的延长,对照组的新生血管变的又细又长,深入角膜中央,而治疗组的大部分角膜新生血管逐渐消失,角膜逐渐透明。治疗组的新鲜血管明显要少于对照组,并具有统计学意义(P<0.05,图3)。干细胞因子在加速修复的同时,抑制新生血管的过度生长,从而提高角膜愈合后的透明度。
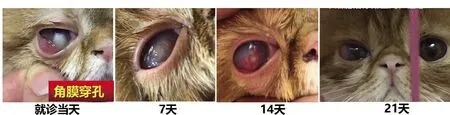
图4 病例一患宠使用干细胞因子滴眼液治疗前后对比图
2.3 干细胞因子在宠物眼科临床治疗观察
病例一为1 岁公猫,因角膜外观异常来院就诊。临床检查可见威胁反应正常,泪液量正常,荧光素染色阳性,可见角膜穿孔,纤维素样物渗出,未见眼内翻及异位睫毛等异常。因畜主拒绝手术治疗,遂单纯使用药物治疗。给予干细胞因子滴眼液治疗,同时配合抗生素滴眼液,4 次/d,逐日使用。结果显示,干细胞因子滴眼液治疗3 周后患宠角膜穿孔愈合(图4)。
病例二患猫,不明原因角膜溃疡在外院接受治疗,未见好转,后转院。检查可见荧光素染色阳性,角膜溃疡,行瞬膜遮盖术,术后1 月拆线。拆线后见角膜水肿及表面肉芽组织增生,并出现眼睑内翻。行眼睑内翻矫正术后使用干细胞因子滴眼液修复角膜,4 次/d,连用3d。结果显示,干细胞因子滴眼液治疗3d 后,角膜水肿明显改善,角膜透明度恢复,表面肉芽组织消失(图5)。
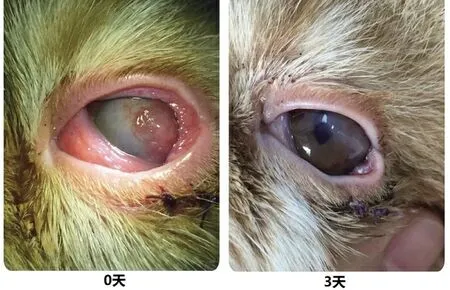
图5 病例二患宠使用干细胞因子滴眼液治疗前后对比图
病例三布偶猫,因左眼结膜炎就诊,经口服药物和常规滴眼液配合治疗一月,期间角膜缘出现明显血管化,密度逐渐升高并向视轴区蔓延,持续恶化。检查可见泪量检查正常,荧光素染色和细胞学检查因客观原因未进行,可见明显角膜表面大量浅表新生血管形成血管翳,无眼睑内翻、双行睫等。诊断为结膜炎诱发慢性角膜炎,并发血管翳,角膜溃疡及嗜酸性角膜炎待排查。随后给予患眼干细胞因子滴眼液,4 次/d,逐日使用。结果显示,使用干细胞因子滴眼液治疗4d 后,患眼角膜透明度增加,血管翳基本消失(图6)。
3 讨论
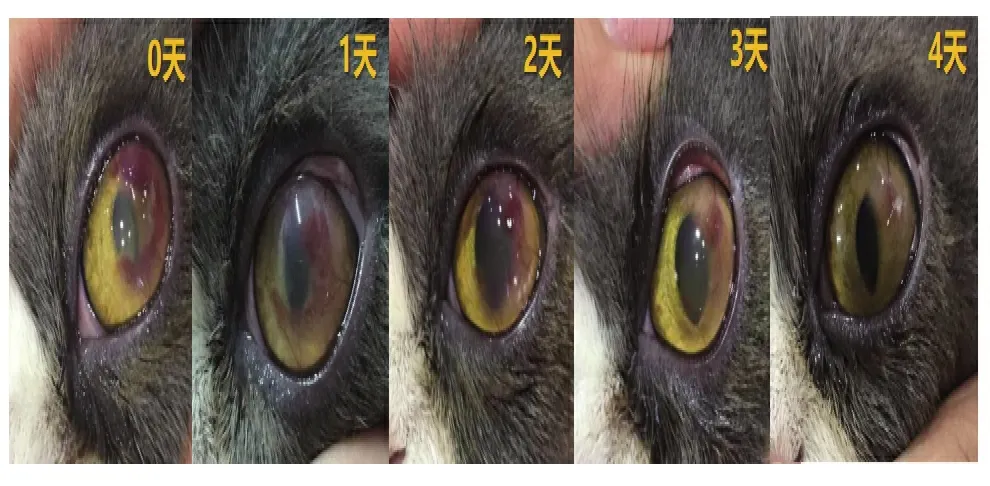
图6 病例三患宠使用干细胞因子滴眼液治疗前后对比图
角膜损伤修复是一个复杂的、多种细胞因子协同、多种细胞参与的过程。角膜不同程度的损伤其愈合过程需要不同细胞及细胞因子的参与[6],上皮细胞可在表皮生长因子(EGF)等细胞因子的激活作用下快速进行增殖,并由边缘向损伤区域迁移,从而完成对损伤区域的填补和修复,恢复角膜上皮的完整性。当上皮损伤范围较大且严重时,角膜缘干细胞的参与变得不可或缺(图7),是角膜组织再生能力的重要保障。损伤发生后其在胰岛素样生长因子(IGF)、转化生长因子β(TGF-β )等细胞因子的作用下被激活,开始增殖并产生瞬时扩增上皮细胞,瞬时扩增上皮细胞最终分化为成熟的上皮细胞并不断从角膜缘基底层向角膜表层和角膜中央迁移,这个过程将使得角膜的伤口逐渐缩小直至闭合。
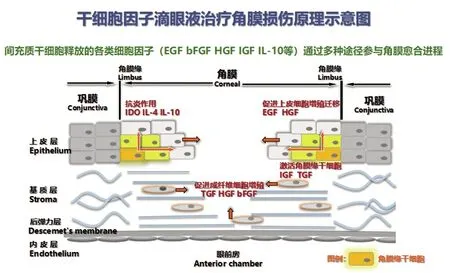
图7 干细胞因子治疗角膜损伤机制示意图
基质层中的角细胞在肝细胞生长因子(HGF)、TGF-β、碱性成纤维细胞生长因子(bFGF)等因子的刺激下启动向成纤维细胞的转化。激活后的成纤维细胞对细胞外基质进行重构,进而完成对基质层伤口的填充和闭合。
角膜内皮细胞不具有再生能力,当角膜内皮损伤时,内皮细胞可在TGF-β 等细胞因子的作用下完成“上皮-间充质转化”,内皮细胞发生延展迁移从而完成对伤口的闭合。
研究发现,MSC 可以分化成多种类型细胞,例如,脂肪细胞、骨细胞、成骨细胞[7],同时它也能转分化成为其他胚层的细胞,例如神经细胞,心肌细胞等[8];有研究报道MSC 可以分化成角膜上皮细胞,表达角膜上皮细胞标记的CK3,进而参与角膜上皮的损伤修复[9];MSC 也可以迁移至角膜基质中,分化成除上皮细胞以外的其它类的细胞[10]。
众多研究发现,MSC 的治疗作用更多是通过旁分泌作用来实现的,而不是直接分化。MSC 通过分泌一系列促进组织损伤修复的因子[11-14],例如血小板来源生长因子(PDGF)、bFGF、TGF、HGF、EGF 等来促进角膜上皮的增殖和迁移,进而促进角膜上皮的再上皮化。MSC 还具有抗炎作用,它通过分泌抗炎因子(例如IL-10、TSG-6)和抑制促炎因子(例如IL-1a、IL-6、IL-17、IFN-g、G-CSF、GM-CSF、MIP-2a、MCP-1)来发挥抗炎作用[15]。动物试验数据表明,移植含有MSC 的羊膜到化学烧伤模型动物的角膜上,移植4周后,角膜中炎性因子IL-2、MMP2 的表达是被抑制的,而抑制炎症防止了角膜的进一步损伤[16]。其他研究团队也发现将MSC 移植到角膜可以抑制炎性因子IL-2 和干扰素(IFN-γ )的表达,提高了抑炎因子IL-10、转化生长因子(TGF-β 1)的表达[2]。
4 结束语
综上所述,角膜各层的修复均有赖于各种细胞的参与,而细胞的参与则必须经过多种细胞因子的激活和调节。细胞因子在细胞增殖再生及组织修复中的重要作用恰恰是近年来生物医学的重要成果,诸如EGF、bFGF 等作为有效成分的单因子药物已应用于眼科临床多年。间充质干细胞因子群是MSC 分泌的蛋白产物,富集多种细胞因子,集合了干细胞的促修复、调节免疫、抑制瘢痕产生等许多生物学特性(表1)。试验药效学及临床应用显示,间充质干细胞因子群可以参与角膜各层的细胞修复,进而促进角膜愈合,同时抑制瘢痕的生成。
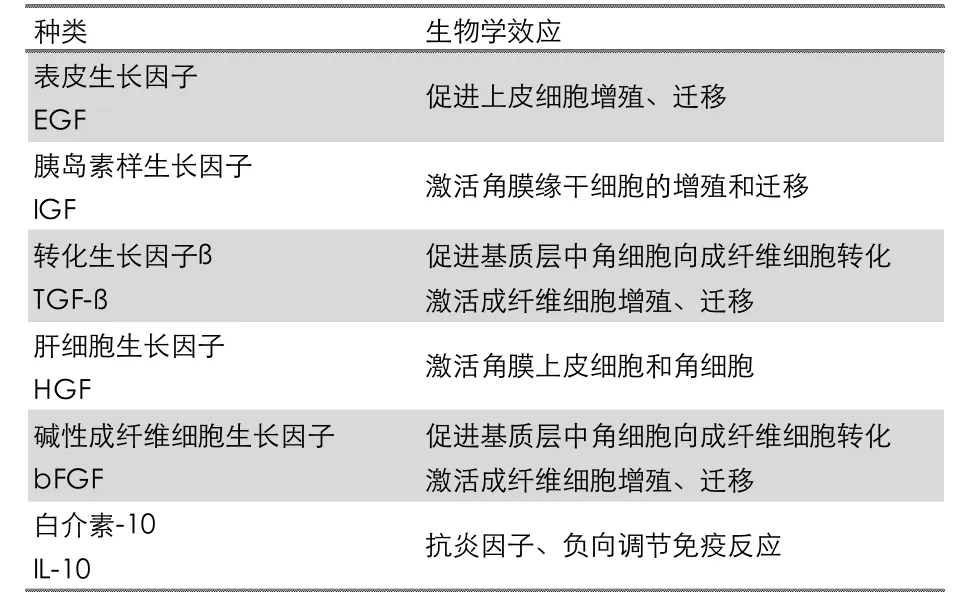
表1 干细胞因子的生物学效应
