右侧肩胛部未分化多形性肉瘤1例并文献复习
2020-06-28任海华王小兵
任海华,王小兵
未分化多形性肉瘤 (Undifferentiated Polymorphic Sarcoma,UPS)临床表现缺乏特异性,且发病率较低,易误诊误治,现报道1例未分化多形性肉瘤病例,结合文献复习,总结未分化多形性肉瘤的临床表现、辅助检查、病理和免疫组织化学,加强对该病的认识。
1 临床资料
患者,男,54岁,因“发现右侧肩胛部皮肤肿物2月余”就诊于山西医科大学第一医院。入院诊断为“右肩胛部皮肤肿物性质待查”,既往无特殊病史。专科检查:可见右侧肩胛部有一椭圆形皮肤肿物,约4 cm×1.5 cm×5 cm,突出皮肤表面约1 cm,肤色,质韧,压痛(-),活动度可,周围皮肤温度正常(图1、2)。常规实验室检查未见明显异常,右侧肩胛部超声所见:右肩胛部皮下脂肪层可见无回声包块,大小约4.3 cm×1.6 cm×4.5 cm,内透性差,边界清,CDFI:其内未见明显血流信号。超声诊断为:右肩部皮下脂肪层囊性包块(图3、4)。
入院后完善术前准备,排查手术禁忌后在局麻下行“右侧肩胛部皮下肿物切除术”:术中可见右侧肩胛部椭圆形肿物一个,于深筋膜层去除肿物,大小约4 cm×1.5 cm×4 cm,被覆皮肤,肿物切开后,切面呈灰白,实性,质软,病灶内有不同程度的坏死。切除肿物送做术后病理检查,结果回报:右肩部梭形细胞瘤(间叶组织来源),形态学考虑恶性生物学行为,需做免疫组化进一步明确。免疫组化结果回报:(右肩部)多形性未分化肉瘤:CK(-),Vim(+),CD163(+/-),CD68(+),S100(-),SOX10(-),SMA(-),Ki67 (40%+),Desmin (-),Myoglobin (+/-),CD34(-)(图 5),送检组织边缘可见肿瘤组织,建议扩大切除。遂安排再次手术:局麻下行“右侧肩胛部未分化多形性肉瘤扩大切除术+术中冰冻检查”。患者恢复顺利,1月后复查可见伤口愈合良好,伴轻度瘢痕增生,未见瘢痕破溃。1周后行辅助放疗,放疗采取常规分割方式,2.2 Gy/次,5次/周,总剂量55 Gy/25 f。术后患者病情稳定,仍在随访中。

图1 患者正位照

图2 患者侧位照

图3 右侧肩胛部脂肪层囊实性包块
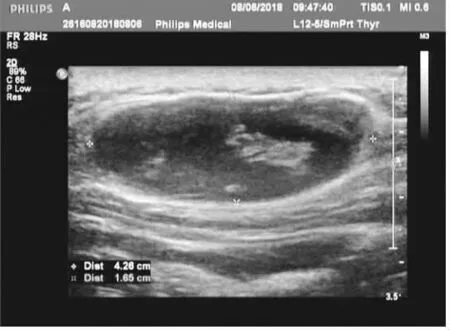
图4 肿物在CDFI下未见明显血流信号

图5 免疫组化均采用En-Vision二步法(×100)
2 讨论
2.1 UPS的临床特点 自20世纪60年代中期发现及命名以来,UPS的概念及分类标准不断变迁。UPS指一组具有席纹状或轮辐状排列生长的恶性软组织肿瘤[1],曾被称为恶性纤维组织细胞瘤(malignant fibrous histiocytoma,MFH),根据软组织和骨肉瘤2013最新分类年正式删除MFH代之以UPS,被归入新设立的未分化/未能分类软组织肉瘤,是一组无明确分化方向的多形性异质性间质肿瘤[2]。目前未分化多形性肉瘤的病理诊断标准为:没有特异性分化方向的高级别肿瘤[3]。
2.2 UPS的组织来源与病理学特征 软组织肉瘤(soft tissue sarcoma,STS)的发病约占所有成人恶性肿瘤发病的 0.7%~0.8%[4,5],而未分化多形性肉瘤(UPS)占成年人软组织肉瘤的 19.22%[6],发病年龄高峰在50~70岁,大约2/3发生在男性。其恶性程度高,复发和转移常见,预后较差。UPS最常发生在下肢,尤其是大腿,其次是躯干部、头颈部和腹膜后[7],主要位于深部的肌肉和筋膜,少数位于皮下。
镜下可见瘤细胞及细胞核具有多样性,核大异性明显,易见核分裂象(>10个/HPF)和病理性核分裂象,可见多核瘤巨细胞伴慢性炎细胞浸润(图6)。梭形、长梭形瘤细胞排列成长条束状、编席状、旋涡状及鱼骨状(图7)。UPS缺乏特异性免疫组化标记,Vim和CD68的阳性表达被兼容于UPS,并有助于 UPS 的诊断[8,9],Vim 是间叶细胞的肿瘤标志物,CD68已成为近年来常用的和特异的组织细胞标志物。

图6 瘤细胞及细胞核病理图(HE染色×100)
2.3 UPS的诊断 UPS的诊断需结合临床表现、实验室检查、影像学检查、病理学检查。临床表现主要表现为进行性增大的软组织肿块,时间数月到数年,常伴有压迫症状,可伴有疼痛;实验室检查肿瘤标志物无特异性改变;影像学检查对诊断软组织肉瘤有辅助作用:超声可确定肿瘤的大小形态、肿物回声、与周围组织的关系,可以鉴别浅表组织肿块性质,尤其是对神经源性肿瘤、脂肪瘤、血管瘤、各种囊肿和动静脉畸形有较高的诊断价值;CT具有理想的定位效果和较好的定性诊断能力,增强扫描可以明确显示肿块的大小、边界及其与周边各相邻组织的关系;MRI对软组织肿瘤定位、肿瘤成分、血供情况及边缘侵袭的评估有很大优势,肿瘤是否侵犯定义为瘤周邻近组织T2WI高信号、且明显强化[10],可为术前诊断及手术方案提供重要依据;病理组织学检查仍为诊断该病的金标准,UPS缺乏特异性免疫组化标记,但是Vim,CD68目前已成为诊断UPS的极为重要的标志物。一般不推荐细针穿刺活检,因为软组织肉瘤一般存在一定的不均质性,且大多数时候需要免疫组化辅助诊断,建议做粗针穿刺活检或者切开活检。
2.4 UPS的鉴别诊断 由于多种恶性肿瘤也可表现为UPS样形态结构或具有UPS样细胞成分,尤其要与以下恶性肿瘤鉴别:(1)多形性平滑肌肉瘤:肿瘤内有时可见到经典的平滑肌肉瘤区域,瘤细胞至少表达一种象征平滑肌分化的抗原,如平滑肌肌动蛋白(SMA)、肌特异性肌动蛋白(MSA)、Desmin等,但在多形性区域内,这些标记的表达常明显减弱;(2)多形性横纹肌肉瘤:瘤细胞表达Desmin、Myogenin、MyoD1和Myoglobin等肌源性标记。(3)恶性外周神经鞘瘤:起源于外周神经,并可见神经鞘细胞增生,S-100阳性可以区分二者。(4)梭形细胞为主的淋巴瘤:选用淋巴瘤的特有性抗原,易鉴别。(5)多形性脂肪肉瘤:免疫表型Vimentin呈阳性,局灶表达平滑肌肌动蛋白SMA和CD-34,Pan-CK、Desmin、S-100、上皮膜抗原和高迁移率族蛋白。(6)纤维肉瘤:X线呈纯粹的溶骨性病变,细胞间胶原丰富,常呈特征性的“人字形”或“鲱鱼骨”样排列,缺少典型的车辐状结构,而UPS细胞肥硕、巨细胞多而显著,无组织细胞样及其他背景细胞[11]。
2.5 UPS的治疗及预后 UPS是高度恶性肿瘤,关键在于早发现、早治疗,而预后取决于首次治疗的正确性和彻底性。手术治疗是UPS的首选治疗方式,根据肿瘤的部位、大小、分级、生物学特性多采用广泛切除或根治手术。广泛切除的手术原则是将肿瘤及肿瘤的活检部位1 cm内的正常组织完整切除并且获得阴性切缘[12];Heslin等分析,放疗是唯一与降低UPS局部复发危险性有意义的相关因素(P<0.02)[13]。 UPS 患者在接受手术切除后进行放疗,10年无复发生存率为62%,总体生存率为80%,与历史报告相比,明显提高了生存率[7]。同时也有文献指出术后辅助放疗对于改善局部的控制非常重要,特别是对于高度病变和广泛切除后手术边缘受损的患者[8,14]。 典型剂量在 50~60 Gy 之间,辐射场包括整个肿瘤床、瘢痕、排泄点以及肿瘤床周围至少5 cm的边缘[15];化疗在UPS辅助治疗中的作用存在争议[14,16],甚至有研究指出化疗是增加患者病死率的非独立预后相关因素[17]。Aoki推测 APN/CD13可能是UPS重要的诊断标志物和治疗靶点[18];Toda认为DcR3可以作为UPS有效的治疗靶点[19]。但目前的靶向治疗药物都还在临床试验阶段。
UPS侵袭性较高,与病灶侵犯部位、病灶大小及侵犯深度等相关。其预后据文献报道因发病部位不同而有所差别:头颈部患者的5年总生存率为48%,而躯干和四肢肿瘤患者达到5年总生存率为77%[7]。 但术后复发率高达 44%~48%[16],瘤周组织的侵犯与肿瘤恶性程度相关[20]。精确的肿瘤预处理是至关重要的,UPS目前虽尚无确切有效的辅助治疗方案,现在常用手术切除配合局部放疗的预后效果似乎更明确。建议外科医师充分结合术前相关检查选择合适的治疗方案,减少肿瘤局部复发率,改善患者预后。
由于UPS无特异性肿瘤标志物及辅助检查方法,加之发病率低,故而误诊率、漏诊率相对较高,术后易复发。通过该例介绍,手术医师应根据临床特征充分结合术前检查:彩超、CT、MRI等,以及术中冰冻及术后病理,提高对UPS的诊断率。
