间充质干细胞来源的外泌体通过microRNA-21-5p调节心脏自噬并影响心肌缺血大鼠的心脏功能
2020-06-24孙理华幸世峰
孙理华,王 娟,张 岳,张 颖,幸世峰
(新疆医科大学第五附属医院心血管内科,乌鲁木齐 830011)
缺血性心脏病(ischaemic heart disease,IHD)是世界上死亡的主要原因之一[1]。 及时再灌注是IHD的主要治疗手段,不仅可以减少梗死面积,而且可以提高IHD 患者的生存率[2]。 再灌注也可能导致梗塞扩展,这是心肌缺血/再灌注损伤(myocardial ischemia/reperfusion injury,MI/RI)的主要组成部分之一[3]。 MSCs 是一种多能祖细胞,它可以通过多种机制改善动物IHD 模型和IHD 患者的心脏功能,然而,移植的MSCs 在宿主组织中的存活率很低,并且在目标组织中仅能检测一小部分移植的MSCs[4-5]。 多项研究表明,MSCs-Exos 在心肌梗死和MI/RI 后具有心肌保护作用[6-8],而MSCs-Exos中的miRNA 可能为参与心脏保护中的关键因素,因此,Exos miRNA 具有为MI/RI 治疗提供强有力的治疗靶标的潜力。 文献检索显示,MSCs-Exos 中存在几种高度表达的miRNA,其中,miR-21-5p 是众所周知的抗凋亡miRNA,它在MSCs-Exos 中高度表达[9]。 研究表明,自噬可能保护缺血性心脏病心肌缺血再灌注损伤[10-11],但尚不清楚MSCs-Exos 是否通过miR-21-5p 调节MI/RI 模型中的自噬,从而达到保护心肌的作用。 因此,我们假设miR-21-5p 可能具有下调与细胞死亡/存活相关的特定靶基因的能力,本研究旨在观察MSCs-Exos 在H2O2诱导的缺氧H9C2 细胞(H9C2s)中及在大鼠MI/RI 模型体内是如何调节心肌的自噬。
1 材料和方法
1.1 实验动物
成年健康雄性SPF 级别SD 大鼠40 只(4 ~10周龄,250 ~300 g),购自上海Slac 实验室动物有限公司[SCXK(沪)2018-117]; 动物饲养在新疆医科大学[SYXK(沪)2016-073],经过新疆医科大学第五附属医院伦理委员会审查(2018049907),对于实验动物实行3R 原则。
1.2 主要试剂与仪器
H9C2 细胞系购自上海生物科学研究所;含10%FBS 和1%青霉素-链霉素的DMEM/Hi 培养基(北京沃比森科技有限公司,批号:C0662-857);PKH26(美国Sigma 公司,批号:031224);H2O2(美国Sigma 公司, 批号:7722-84-1);CCK-8 溶液(日本DOJINDO 公司,批号:EJ744);V-PE/7-AAD(美国eBioscience 公司,批号:XY-1944);GFP-LC3(美国Addgene 公司,批号:KL-Zl-2078);TUNEL 试剂(瑞士Roche 公司);TRIzol 试剂盒(日本TOYOBO公司,批号: FSQ-201);SeraMirTMEVs RNA 提取试剂盒(美国System Biosciences 公司,批号:15596-026);SYBR Green Master Mix 试剂盒(美国Thermo Scientific 公 司, 批 号: 75762500RX); Exoquick exosome 快速提取试剂盒(美国Invitrogen 公司,型号:EXOQ5A-1);透射电子显微镜(TEM, 日本Hitachi 公司,型号:HT7700);qNano 平台(新西兰Izon Science 公司);DAPI 试剂盒(美国Sigma 公司,批号:28718-90-3);FlowJo 软件(美国Tree Star 公司);Olympus FV1000 激光扫描共聚焦显微镜(日本Olympus 公司);PCR 系统(美国Thermo Scientific 公司);胎牛血清FBS、PBS、0.25%胰蛋白酶-EDTA(美国美国Gibco 公司);流式细胞仪(FCM,美国BD Biosciences 公司,批号:0796-2007)等。
1.3 实验方法
1.3.1 MSCs 的分离和培养
采用戊巴比妥(50 mg/kg,腹膜内注射)麻醉大鼠,颈脱位处死大鼠。 然后在无菌条件下去除胫骨和股骨。 切开骨头末端,并用含有1%~2% FBS 的PBS 冲洗骨髓。 然后将细胞悬液通过40 μm 滤网(美国BD Falcon 公司,批号:352340)过滤。 将过滤后的悬浮液以1000 r/min 的速度离心5 min 后,将骨髓细胞放在含有10% FBS 和1%青霉素-链霉的DMEM/F12 培养基中培养。 在第5 天更换培养基以除去非贴壁细胞,并在两天后进行细胞传代。 使用0.25%胰蛋白酶-EDTA 传代MSCs,并通过流式细胞仪(FCM)进行鉴定,后续实验使用第三代MSC细胞。
1.3.2 MSCs-Exos 提取、鉴定及进入H9C2 细胞的内在化
将MSCs 接种在10 cm 的培养皿中过夜,待细胞融合度达到80%,使用Exoquick exosome 快速提取试剂盒从细胞中提取MSCs-Exos,提取操作严格按照试剂盒说明书执行。 使用透射电子显微镜评估MSCs-Exos 的形态。 使用qNano 平台分析MSCs-Exos 的大小和浓度。 采用Western blot 检测了MSCs-Exos 的LAMP-1、CD9 和TSG101 蛋白质标记物的表达水平。
将MSCs-Exos 在37℃的黑暗环境中用PKH26标记15 min,随后用PBS 中洗涤3 次,并于4℃下,以30000 r/min离心2 h。 然后,将标记的Exos(10 μg/mL)置于含H9C2 细胞的培养皿中分别共孵育12 h、24 h。 用PBS 洗涤H9C2 细胞一次,用含有4’,6-二脒基-2-苯基吲哚(DAPI)的PBS 进行细胞核染色5 min。 使用荧光显微镜观察H9C2 细胞摄取MSCs-Exos 情况。
1.3.3 MSCs 转染
为了下调MSCs-Exos 中miR-21-5p 表达,用miR-21-5p 抑制剂(MSC/simiR-21-5p)及加干扰对照(MSC/scramble)(终浓度为100 nmol/L)处理MSCs。 使用Lipofectamine 2000 提高干扰效率。 转染24 h 后弃去培养基,更换为含10% FBS 的新鲜培养基继续培养。 如上述方法纯化源自MSC/simiR-21-5p 及MSC/scramble 的Exos。
1.3.4 H9C2 细胞活力测定
检测MSCs-Exos 及miR-21-5p 对H9C2 细胞活力的影响,首先将H9C2 细胞分别与含MSCs-Exos(10 μg/mL)、MSC-Exos simiR-21-5p(10 μg/mL)及MSC/scramble-Exos(10 μg/mL)共培养12 h,对照组采用普通培养基,然后暴露于H2O2(500 μmol/L)12 h;然后,将10 μL CCK-8 溶液加入到细胞中,再孵育4 h 后,使用酶标仪(美国BioTek 公司,批号:El-800)于450 nm 下测定光密度(OD)值,计算与对照组的相对值作为细胞存活率或处理细胞的增殖速率。
1.3.5 H9C2 细胞凋亡率测定
通过FCM 检测膜联蛋白V-PE/7-AAD 评估MSCs-Exos 及miR-21-5p 介导的H9C2 细胞凋亡的情况,按照评估Exos 对细胞生存力影响的实验中所述,实施了类似的实验组。 在预定的时间点,收集细胞,用冰冷的PBS 洗涤两次,将细胞置于7-AADPercp 和Annexin V-PE 的1×Annexin V 结合缓冲液中孵育15 min。 最后,采用FCM 检测凋亡并通过FlowJo 软件进行分析。
1.3.6 自噬体形成的测定
使用Lipofectamine 2000(美国Invitrogen 公司,批号:13778-075)将GFP-LC3 质粒(1 μL/mL)转染到H9C2s 中,然后用10%福尔马林固定细胞。 采用Western blot 检测H9C2s 自噬相关蛋白的表达,在Olympus FV1000 激光扫描共聚焦显微镜下观察到GFP-LC3 荧光,使用活细胞成像监测自噬通量。
1.3.7 动物实验
(1)动物分组与MI/RI 模型建立
将SD 大鼠(n=30)随机分成五组(n=6),建立大鼠的MI/RI 模型[12]:(1)假手术组,对未结扎的大鼠左冠状动脉前降支(LAD)进行缝合;(2)MI/RI组,将LAD 结扎30 min,然后再灌注2 h;(3)MI/RI+ MSCs-Exos 组,在再灌注前5 min,使用30 号针头的汉密尔顿注射器将溶解于10 μLPBS 中的MSCs-Exos(5 μg)注入可见损伤区域的前部和外侧;(4)MI/RI + MSC-ExossimiR-21-5p组,在再灌注前5 min,使用30 号针头的汉密尔顿注射器将溶解于10 μLPBS 中的MSC-ExossimiR-21-5p(5 μg)注入可见损伤区域的前部和外侧;(5)MI/RI + MSC/scramble-Exos 组,在再灌注前5 min,使用30 号针头的汉密尔顿注射器将溶解于10 μLPBS 中的 MSC/scramble-Exos(5 μg)注入可见损伤区域的前部和外侧。
(2)心肌组织学分析
取心尖附近的心肌组织,用4%多聚甲醛固定48 h,固定后将心肌组织石蜡包埋,切成横截面(6 μm),用于TUNEL 和免疫组织化学染色。 采用DAPI 标记所有细胞核,将TUNEL 标记的细胞核的细胞视为TUNEL 阳性细胞,每个切片中阳性细胞的数目是6 个视野中阳性细胞的平均值,计算结果表示为相对于假手术组获得的阳性细胞的百分比。按照免疫组织化学染色方法处理,然后将载玻片干燥,盖上盖玻片并在显微镜下检查,分析心肌组织中LC3B 表达情况,相对光密度(ROD)通过Image pro plus 软件计算为积分光密度(IOD)与测量面积之比。
(3)RT-qPCR 分析
按说明使用TRIzol 试剂提取心肌组织中的总RNA,使用SeraMirTMEVs RNA 提取试剂盒进行MSCs-Exos 总RNA 提取。 使用ReverTra Ace Qpcr RT 试剂盒将每个样品的总RNA 反转录为cDNA。使用SYBR Green Master Mix 试剂盒在Applied Biosystems 7500 实时PCR 系统中进行RT-qPCR 反应。 使用U6 小核仁RNA 基因的表达用作内部对照,并使用2-ΔΔCt方法进行基因表达分析。 miR-21-5p 和U6 的引物是由日本Takara 公司设计并合成。引物序列如下:miR-21-5p,正向:5′-GGCGGTGTA AACATCCTT-3′,反向:5′-GTCGTATCCAGTGCAGGG TCCGAGGTGTCG-3′; U6, 正 向: 5′-CTCGCTTCG GCAGCACA-3′,反 向:5′-AACGCTTCACGAATTTGC GT-3′。
(4)心脏功能分析
通过超声心动图检查(GE Vivid E9)以确定心脏结构和功能。 在两个乳头肌之间的短轴上观察心脏,并且通过对三个连续心跳的结果求平均值,以M 模式获得每个测量值。 测量LVID 和LVIDd 以确定心脏形态的结构变化。 分数缩短率(%FS)的计算公式如下:%FS=(LVIDd-LVIDs)/LVIDd×100,其中LVIDd 为舒张期LV 内径,LVIDs 为收缩期LV内径。 超声心动图软件根据Teicholz 公式自动计算左心室射血分数(LVEF)。
1.4 统计学方法
采用SPSS 22.0 统计软件对本研究数据进行分析。 计量资料所均表示为平均数±标准差(±s)表示。 采用单因素方差分析和LSD 检验对数据进行分析。 P<0.05 认为差异具有统计学意义。
2 结果
2.1 MSCs-Exos 的特征
MSCs-Exos 在TEM 下观察显示球形囊泡,呈圆形或典型的杯形(图1A)。 使用qNano 对MSCs-Exos 大小进行了分析,结果显示其总体分布为40 ~160 nm(图1B)。 Western blot 证实了Exos 标记物TSG101、LAMP-1 和CD9 高表达,而钙内毒素蛋白是内质网中的一种特殊的钙结合蛋白,在Exos 中很少出现(图1C)。 H2O2刺激后12 h,大多数PKH26标记的Exos 位于H9C2s 的细胞质中(图1D)。 上述结果表明,H2O2刺激后,MSCs-Exos 可被内化到H9C2s 中。
2.2 MSCs-Exos 增强H2O2 刺激后的H9C2 细胞的活力并减少细胞凋亡和ROS 的产生
H2O2刺激的H9C2s 制备体外细胞缺氧模型[13],从而模拟MI/RI 动物模型。 与H2O2组相比,H2O2+MSCs-Exos 组细胞活力显著提高(P <0.05),ROS 产生和细胞凋亡率显著降低(P<0.05;与 H2O2+ MSCs-Exos 组 相 比, H2O2+ MSCExossimiR-21-5p组细胞活力显著降低(P<0.01),ROS产生和细胞凋亡率显著增加(P <0.01);H2O2+MSC/scramble-Exos 组的治疗效果与H2O2+MSCs-Exos 组相似(图2)。
2.3 MSCs-Exos 增加了H9C2 细胞自噬的水平
Western blot 检测显示:与H2O2组相比,H2O2+MSCs-Exos 组LC3B-Ⅱ/LC3B-Ⅰ和LC3B-Ⅱ的表达显著增强(P <0.01),p62 的表达显著降低(P <0.01);与H2O2+MSCs-Exos 组相比,H2O2+MSCExossimiR-21-5p组的LC3B-Ⅱ/LC3B-Ⅰ和LC3B-Ⅱ的表达显著降低(P<0.05),p62 的表达显著增强(P<0.05);H2O2+MSC/scramble-Exos 组的治疗效果与H2O2+MSCs-Exos 组相似(图3A)。

图1 MSCs-Exos 的鉴定和表征Note. A, Representative images of MSC-Exos obtained by TEM analysis. B, qNano analysis was performed on MSC-Exos. C, Western blot analysis of TSG101, LAMP-1, CD9, and cadherin expression in SCS-Exos. D, After the co-culture of H9C2s and pkh26-labeled SCS-Exos for 12 and 24 h, fluorescence microscopy was used to detect the internalization of SCS-Exos into H9C2 cell.Figure 1 Identification and characterization of MSC-Exos
自噬通量结果显示:与H2O2组比较,H2O2+MSCs-Exos 组细胞中存在的GFP-LC3 点数增加;而与 H2O2+ MSCs-Exos 组 相 比, H2O2+ MSCExossimiR-21-5p组细胞中存在的GFP-LC3 点数显著降低(P<0.05),如图3B。
2.4 在MSCs-Exos 中和MI/RI 后心肌组织中miR-21-5p 的表达
RT-qPCR 分析结果显示:miR-21-5p 抑制剂转染可显著降低MSCs-Exos 中miR-21-5p 的表达(P<0.01,图4A)。 在miR-21-5p 抑制剂及其阴性对照治疗MI/RI 后,结果显示miR-21-5p 抑制剂在心肌组织中显著降低了miR-21-5p 表达(P <0.01,图4B)。
2.5 MSCs-Exos 诱导的自噬减少了大鼠心肌细胞的凋亡并改善了心脏功能
与其他各组相比,MI/RI + MSCs-Exos 组的LC3B 表达显著增强(P<0.01)(图5A);心肌细胞凋亡显著减少(P<0.01)(图5B);分数缩短率(%FS)和左心室射血分数(LVEF)均显著提高(P <0.05)(图5C)。
3 讨论
由于忙碌的生活和工作,越来越多的人不注重自己的饮食习惯,摄入各种高脂肪食物后,其高胆固醇血症发生的概率显著增加,甚至会演变为动脉粥样硬化,进而引起冠状动脉狭窄。 当冠脉内斑块脱落时,则易发生心肌梗死、急性心梗等疾病,用药物干预、冠状动脉支架、冠状动脉搭桥等方法可以挽救患者的生命。 而当发生心肌缺血时,有数亿的心肌细胞发生急性坏死,以上治疗方法并不能促使心肌的修复和再生。 近年来,干细胞移植成为治疗缺血性心脏病的研究热点之一,间充质干细胞具有分化为心肌细胞的能力,具有补偿缺血坏死的心肌细胞的作用。 大量研究表明,干细胞分泌的Exos 有多种生物活性,包括修复心肌、促进血管新生、促进神经再生[14-15]。 外泌体中含有mRNA、miRNA 以及各种抗凋亡和促血管生成因子,能诱导成纤维细胞迁移、增殖及胶原合成[16]。 且外泌体能传递miRNA至靶细胞,发挥促进组织再生作用[17]。 而miR-21-5p 具有促进细胞增值和迁移的功能[18]。 心肌I/R损伤病理机制研究的不断完善,有助于对相关治疗靶点更加深入探索。 I/R 损伤涉及炎症因子的释放、氧化应激、自由基损伤、自噬及细胞凋亡等病理生理过程[19-20]。 miR-21-5p 可作为糖尿病性心肌病的候选治疗靶标,也是治疗脑外伤炎症的重要探索方向[21-22]。 在MI/RI 期间,主要是从线粒体运输链中产生了过量的ROS,过量的ROS 通过各种机制导致细胞死亡[23]。

图2 MSCs-Exos 对H9C2 细胞的活力,H2O2 诱导的细胞凋亡和ROS 产生的影响Note. A, Cell viability was assessed by the CCK-8 assay. B, Evaluation of ROS production by fluorescence microscopy. C, The apoptosis of H9C2 cells was detected by FCM. Compared with the control group,*P<0.05,***P<0.001.Compared with the H2O2 group,##P<0.01,###P<0.001.Compared with the H2O2+MSCs-Exos group,&&P<0.01,&&&P<0.001.The same as below.Figure 2 Effect of SCS-Exos on H9C2 cell viability, H2O2-induced apoptosis, and ROS production
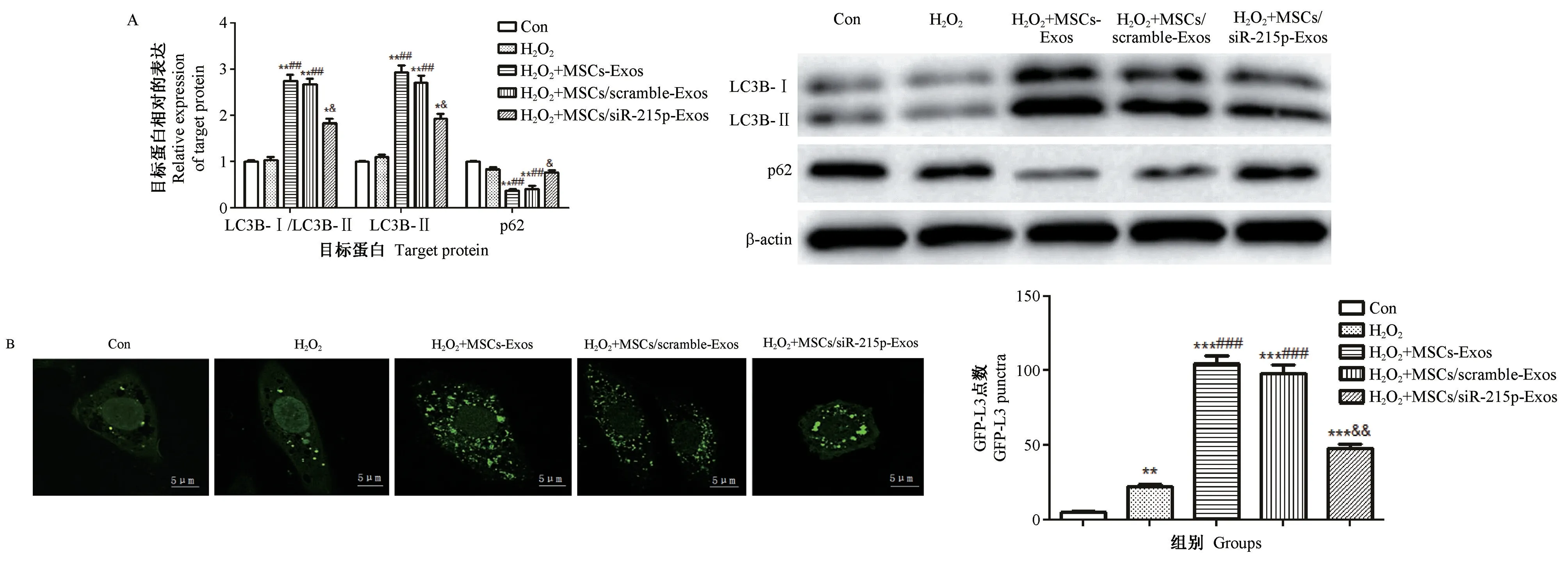
图3 MSCs-Exos 对H9C2 细胞自噬水平的影响Note. A, The effect of SCS-Exos on the expression of autophagy markers p62 and LC3 in H9C2 cells. B,H9C2 cells were transfected with a GFP-LC3 plasmid, and LC3 puncta were observed under a confocal fluorescence microscope. The bar graph shows the number of GFP points per cell.Figure 3 Effect of SCS-Exos on the autophagy level in H9C2 cells

图4 在MSCs-Exos 中和MI/RI 后心肌组织中miR-21-5p 的表达Note. A, miR-21-5p was expressed in MSC exos after transfection with miR-21-5p inhibitor and its negative control. B, Expression of miR-21-5p in the myocardium after MSC exos and miR-21-5p inhibitor treatment (n = 4). Compared with the control group,* P <0.05,*** P <0.001,#P<0.05,###P<0.001.Compared with the MI/RI + MSCs-Exos group,**P<0.01,&&P<0.01.Figure 4 Expression of miR-21-5p in the myocardium after MSCs-exos and MI/RI

图5 miR-21-5p 诱导的自噬对MI/RI 大鼠细胞凋亡和心脏功能。Note. A,Immunohistochemical staining of LC3b in the myocardium of each group. B,TUNEL staining was used to analyze the effect of MSCs-Exos and MSC-ExossimiR-21-5p on the apoptosis of cells after MI/RI. C, Cardiac function was measured by echocardiography. Compared with the control group,*P<0.05,**P <0.01, ***P <0.001.Compared with the MI/RI group,*P <0.05,**P <0.01.Compared with the MI/RI + MSCs-Exos group,& P<0.05.Figure 5 Autophagy induced by miR-21-5p can enhance apoptosis and cardiac function in MI/RI rats
本研究显示了H2O2诱导的ROS 降低H9C2 细胞活力并增加细胞凋亡。 暴露于H2O212 h 后,H9C2s 中的自噬通量被阻滞,这与细胞凋亡率显著增加是一致的,说明缺氧或缺血性损伤后自噬的增强对心肌有保护作用,心肌自噬减少了心肌细胞的凋亡并改善了心肌细胞的存活,心肌细胞自噬的上调减弱了MI/RI[24-27]。 本研究通过抑制MSCs-Exos中的miR-21-5p 表达,发现其可显著逆转MSCs-Exos对自噬、细胞凋亡和心脏功能的作用。 上述结果表明MSCs-Exos 可能通过miR-21-5p 调节自噬保护免受H2O2诱导的H9C2 细胞损伤,同时介导大鼠MI/RI 后的心脏自噬作用,当MSCs-Exos 注射入MI/RI大鼠模型时,自噬增加,凋亡减小,心脏功能得到改善。
综上所述,MSCs-Exos 可保护H2O2诱导的H9C2 细胞凋亡,其可能作用机制为miR-21-5p 参与MSCs-Exos 诱导的心肌自噬来实现保护MI/RI 损伤[28-32]。 这些发现可能为利用miR-21-5p 在优化未来基于干细胞的心脏病治疗中的作用开辟新的研究方向。
