汉防己甲素联合化疗药物在斑马鱼体内逆转多药耐药的研究
2020-06-24向文碧李志操周栋珍周艳华吴西军何志旭舒莉萍
向文碧,李志操,周栋珍,周艳华,吴西军,何志旭,舒莉萍*
(1.贵州医科大学 细胞工程生物医药技术国家地方联合工程实验室,贵州省再生医学重点实验室,儿科学教研室,贵阳 550004; 2.中国医学科学院成体干细胞转化研究重点实验室,贵阳 550004; 3.遵义医科大学附属医院儿科学教研室,贵州 遵义 563000; 4.贵州省贵阳市妇幼保健院/贵阳市儿童医院,贵阳 550003;5.贵州大学,贵阳 550025)
目前,恶性肿瘤发病率和死亡率仍逐年上升,是威胁人类生命安全的主要疾病之一。 恶性肿瘤主要的治疗措施包括化疗、放疗及手术切除等,但是多数肿瘤的治疗效果仍不令人满意,其主要原因是化疗过程中肿瘤细胞产生了多药耐药导致化疗效果不佳。 多药耐药是指最初对单一抗癌药物产生耐药的癌细胞后来对结构或功能不同的多种化疗药物产生交叉、广谱耐药性的现象[1]。 多药耐药的主要机制是ATP 结合盒(ATP-binding cassette,ABC)转运蛋白通过利用ATP 水解释放能量将抗肿瘤药物在细胞内泵出细胞外[2]。 ABCB1(即MDR1)编码的P 糖蛋白(p-glycoprotein, P-gp)是ABC 家族的主要成员之一,是引起肿瘤多药耐药的重要转运蛋白也是研究热点之一[3]。
近年来,斑马鱼作为一个新型的模式生物在高通量药物筛选研究方面拥有其它实验动物所不具备的天然优势[4]。 斑马鱼abcb4 基因与人类ABCB1基因的氨基酸序列相似度高达64%[5],且斑马鱼abcb4 基因与药物在体内的吸收与积累量有关[6]。汉防己甲素(Tetrandrine,TET)是中国传统的硅肺、自身免疫性疾病、炎症性肺病、心血管疾病和高血压的临床药物。 大量研究证明,TET 抑瘤作用不明显,但是与化疗药物组合能通过抑制P-gp 转运体逆转化疗药物产生的耐药性,从而增强化疗药物的肿瘤抑制作用[7-9]。 但是汉防己甲素在斑马鱼体内的毒性研究及其对斑马鱼耐药基因abcb4 表达的影响,未见相关报道。 因此,本研究通过研究TET 对Tubingen 野生型斑马鱼胚胎早期发育的毒性作用及TET 与化疗药物长春碱(vinblastine, VLB)和阿霉素(doxorubicin,DOX)联合对多药耐药基因abcb4 表达及功能的影响,以期探讨汉防己甲素在斑马鱼体内逆转多药耐药的作用。
1 材料和方法
1.1 实验动物
Tubingen 野生型斑马鱼为本实验中心自行传代培育[SYXK(黔)2018-0001],采用0~5 d 的斑马鱼胚胎及幼鱼,按照3R 原则给予人道的关怀。
1.2 主要试剂
TET 和VLB 购自美国Sigma 公司;DOX 购自大连美轮;TRIzol 试剂、逆转录试剂First Strand cDNA Synthesis Kit 购自芬兰Thermo 公司;IQTMSYBR Green Supermix 试剂购自美国Bio-Rad 公司。
1.3 实验方法
1.3.1 斑马鱼养殖方法
Tubingen 野生型斑马鱼养殖于(28±5)℃的循环水系统中,光照/黑暗时间比为12/12 h[10]。 3 个月左右斑马鱼发育成熟后进行交配,交配时将雄鱼和雌鱼按比例为1 ∶1或2 ∶1放入缸中,用隔板分隔开,次日光照10 min 后拔板,半小时后收集胚胎并清洗杂质,加入胚胎培养液eggwater(0.06 mg/mL海盐、亚甲基蓝)放置于28℃生化培养箱中培养,每8 h 更换一次新的eggwater,吸出死胚。 幼鱼5 ~7 d左右以草履虫喂养,12~15 d 以后以丰年虫喂养。
1.3.2 毒性实验
将TET 用eggwater 配制成浓度分别为0、2.5、5、10、20、40 μmol/L 的药液,挑选受精后12 h(12 hours post-fertilization,12 hpf)且发育时相一致的斑马鱼胚胎,每组100 枚5 mL 药液于6 孔板内进行药物暴露,将6 孔板放入铝盒中置于生化培养箱中28℃避光培育。 每天更换药液3 次并定时去除死亡的胚胎及幼鱼,观察并统计胚胎或幼鱼在不同时相的死亡、孵化、心率和畸形情况。 通过Excel 软件采用概率单位法计算TET 在斑马鱼上的LC50。
1.3.3 实验处理分组
本实验共设置6 个处理组,每组选取100 枚发育正常并且时相一致的的Tubingen 野生型斑马鱼胚胎。 对照(control, CT)组:不加药液用等体积eggwater 处理;DOX 组:以终浓度为10 μmol/L 的DOX 药液进行处理[5];VLB 组:以终浓度为3.08 μmol/L 的VLB 药液进行处理[11];TET 组:用20 μmol/L 的TET 药液处理;TET 联合DOX 组:以含有20 μmol/L TET 和10 μmol/L DOX 的混合药液进行处理。 TET 联合VLB 组:以含有20 μmol/L TET 和3.08 μmol/L VLB 的混合药液进行处理。 每个组挑选12 hpf 的胚胎开始药物处理。 每8 h 更换1 次药液,直至120 hpf。
1.3.4 实时荧光定量PCR
收集各组120 hpf 药物处理后的野生型斑马鱼幼鱼于1.5 mL Ep 管中(50 尾/管),每管均加入0.2 mL TRIzol 液后用黄枪头充分吹打制成匀浆。 按TRIzol 法提取总RNA,最后用DEPC 水溶解RNA 并逆转录成cDNA。 根据斑马鱼abcb4 基因的mRNA序列(JQ014001,NCBI),设计abcb4 基因引物,F:5 ’-GTTGCTGTATTCTCCTATCG-3 ’, 5 ’-R:ATCTCCAGTCTCG TTCCA-3’,送上海捷瑞公司合成。 根据IQTMSYBR Green Supermix 试剂的反应体系按扩增条件:95℃,10 min;95℃,15 s;55℃,20 s;72℃,20 s;40 个循环进行扩增,并采用2-△△Ct值分析基因相对表达量。
1.3.5 罗丹明123 染色
用eggwater 将罗丹明123 配制成5 mol/L 的染液。 收集各组120 hpf 药物处理后的野生型斑马鱼幼鱼于6 孔板中,每孔50 尾,用eggwater 将幼鱼清洗3 次吸干水分后,每组加入5 mL 罗丹明药液,28.5℃下避光培养2 h。 通过检测罗丹明123 染料在斑马鱼体力的累积量变化情况检测斑马鱼的药物外排功能,从而检测斑马鱼的耐药程度变化[12]。
1.3.6 酶标仪检测幼鱼荧光强度
收集各组经药物处理和罗丹明123 染色后的野生型斑马鱼幼鱼,50 尾/组,用1×PBS 洗涤3 次后再加入350 μL 的1×PBS,用研磨棒研磨胚胎直至在显微镜下看不到明显组织块后,2643 r/min 离心5 min,吸取上清液用多功能酶标仪测定罗丹明123 荧光强度值:激发和发射波长分别为488 nm 和528 nm,每组均设置3 个平行样。
1.3.7 斑马鱼荧光强度观察
收集各组经药物处理和罗丹明123 染色后的野生型斑马鱼幼鱼。 用eggwater 反复洗涤幼鱼3 次后,将其置于共聚焦皿中,加入适量30 g/L 甲基纤维素进行固定,用活细胞工作站进行观察并拍照。
1.4 统计学方法
所有实验均重复3 次或3 次以上, 采用GraphPadPrism 5 软件的单因素方差进行统计学分析。
2 实验结果
2.1 TET 暴露对斑马鱼胚胎发育的毒性效应
当药物浓度低于10 μmol/L 时,胚胎死亡率较低(图1),对照组、2.5 μmol/L 组在各个时间点的死亡率相差不大。 5 μmol/L 组、10 μmol/L 组、20 μmol/L组和40 μmol/L 组在各个时间点的死亡率缓慢上升,40 μmol/L 组胚胎死亡率从48 hpf 开始迅速升高,至120 hpf,40 μmol/L 组死亡率达到90%。 说明TET 对于胚胎的发育毒性较低,但高剂量的TET 对胚胎仍有致死性。 根据胚胎各时间点的死亡率进行统计分析,得到TET 的半数致死浓度LC50=22.12 μmol/L。
2.2 TET 暴露对斑马鱼胚胎孵化率的影响

图1 暴露于不同浓度TET 的斑马鱼胚胎及幼鱼死亡率Figure 1 Mortality rate in zebrafish embryos and larvae exposed to different concentrations of Tetrandrine
48 hpf 时,与对照组相比,2.5 μmol/L 组和5 μmol/L组孵化率无明显变化,当药物浓度大于10 μmol/L时随着药物暴露浓度的增加孵化率逐渐下降(P<0.01);72 hpf 时,2.5 μmol/L 组与对照组相比孵化率无明显变化,当药物浓度大于5 μmol/L时孵化率逐渐下降(P <0.001),当药物浓度为40 μmol/L 时孵化率仅为33.7%(图2)。
2.3 TET 对斑马鱼胚胎心率的影响
药物对斑马鱼心脏功能的影响也是评价药物毒性的一个重要指标,斑马鱼心跳在20 hpf 左右开始出现,心脏大约在48 hpf 左右即可发育完全。 但药物对斑马鱼发育可能存在抑制作用,故选择72 hpf 观察斑马鱼幼鱼的心脏跳动,统计在不同浓度下斑马鱼的心率。 结果显示72 hpf 时斑马鱼的心率在130 ~140 次/分,2.5 μmol/L 组与对照组相比心率变化不明显,当药物浓度增加到5 μmol/L 以上时,随着药物浓度的增加,斑马鱼的心率呈下降趋势(如图3 所示,P<0.001),说明高药物浓度会降低斑马鱼的心率,影响斑马鱼的心脏功能。
2.4 TET 对斑马鱼胚胎畸形率的影响
与对照组相比,斑马鱼幼鱼的畸形率随着药物浓度的增加呈明显的上升趋势(P <0. 001),表明TET 暴露对斑马鱼有发育毒性作用,当药物浓 度 为40 μmol/L 时, 幼 鱼 的 畸 形 率 高 达82. 7%,见图4。
2.5 实时荧光定量PCR 检测结果
不同药物处理组的斑马鱼经实时荧光定量PCR 检测结果(图5)显示,与对照组相比,DOX 和VLB 单独处理组abcb4 基因的mRNA 表达增加(P<0.05)。 TET 和DOX 共同处理组及TET 和VLB 共同处理组相比于DOX 和VLB 单独处理组abcb4 基因的mRNA 表达降低(P<0.01)。

图2 暴露于不同浓度TET 的斑马鱼胚胎孵化率Note. Compared with the 0 μmol/L group,*P<0.05,**P<0.01,***P<0.001.Figure 2 Embryo hatching rate of zebrafish exposed to different concentrations of Tetrandrine
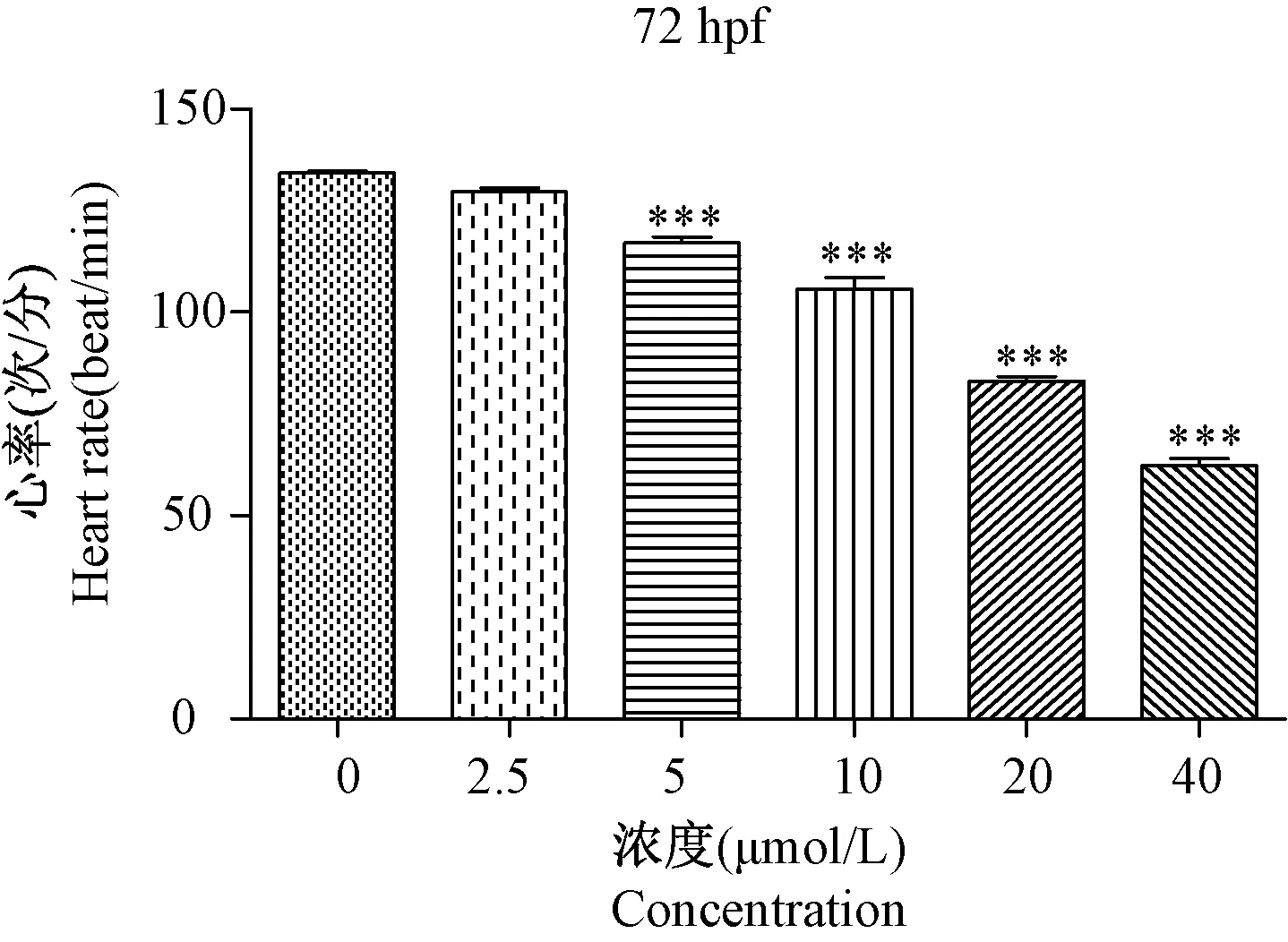
图3 暴露于不同浓度TET 的斑马鱼胚胎心率Note. Compared with the 0 μmol/L group,***P<0.001.Figure 3 Heart rate of zebrafish embryos exposed to different concentrations of Tetrandrine

图4 暴露于不同浓度TET 的斑马鱼幼鱼畸形率Note. Compared with the 0 μmol/L group,***P <0.001.Figure 4 Malformation rate of zebrafish larva exposed to different concentrations of Tetrandrine
2.6 野生型斑马鱼的耐药程度检测结果
不同药物处理组的野生型斑马鱼罗丹明123 染色后经活细胞工作站拍摄(图6A)和酶标仪检测(图6B)结果显示,与对照组相比,DOX 和VLB 单独处理组荧光强度减弱,耐药程度增加(P<0.001)。TET 和DOX 共同处理组及TET 和VLB 共同处理组相比于DOX 和VLB 单独处理组荧光强度增强,耐药程度显著下降(P<0.001)。

图5 不同药物处理后斑马鱼胚胎abcb4基因的mRNA 表达变化Note. The DOX and VLB groups compared with the CT group,*P <0.05. The TET+DOX group compared with the DOX group,**P <0.01.The TET+VLB group compared with the VLB group,***P <0.001.Figure 5 Relative abcb4 mRNA expression of drug-treated wild type zebrafish
3 讨论
目前化疗仍是肿瘤治疗的重要措施之一,化疗过程中ABC 转运体过度表达使药物外排增加引起的多药耐药是导致肿瘤治疗失败的主要原因,而在ABC 转运体中导致多药耐药的首要因素是ABCB1转运体的过度表达[1,13]。 近年来,斑马鱼作为一个新型的模式生物在高通量药物筛选研究方面拥有其它实验动物所不具备的天然优势,且斑马鱼体内的abcb4 基因与人类ABCB1 基因的氨基酸序列高度相似。 因此,本课题基于斑马鱼的优势选择斑马鱼作为实验动物进行研究。
TET 是一种于植物粉防己的块根中提取的双苄基异喹啉类生物碱[14]。 早期因其具有消炎、镇痛、降压、抗纤维化等功效而被广泛应用于临床治疗高血压、矽肺、肝纤维化等疾病,取得非常好的疗效[15]。近年来研究发现,TET 是一种有效的抑制剂,可逆转由P-gp 转运体介导的多药耐药,在抗肿瘤治疗及逆转肿瘤多药耐药方面有良好的应用前景[16]。
本研究利用斑马鱼胚胎进行TET 浓度梯度暴露后,毒性实验结果表明只有高浓度的TET 有明显致畸致死效应,而用中低浓度的TET 药液处理胚胎致畸致死效应不明显。 通过对死亡率的统计分析得出TET 在斑马鱼胚胎发育早期的LC50=22.12 μmol/L。根据该药物浓度选用20 μmol/L 对野生型斑马鱼胚胎进行药物暴露,并收集胚胎进行后续实验。

图6 不同药物处理后经罗丹明123 染色后的野生型斑马鱼耐药程度Note. A, Photograph of live cell imaging system. B, Detection of fluorescent expression of EGFP. The DOX and VLB groups compared with the CT group, the TET+DOX group compared with the DOX group,the TET+VLB group compared with the VLB group,***P <0.001.Figure 6 Drug resistance in drug-treated wild type zebrafish stained with Rhodamine 123
通过实时荧光定量PCR 检测abcb4 耐药基因的mRNA 表达变化,从而判断所用药物是否产生针对abcb4 的耐药。 结果显示,通过用DOX 和VLB 药液单独处理后,斑马鱼abcb4 耐药基因的mRNA 表达增高,说明斑马鱼体内的耐药基因abcb4 被激活使斑马鱼产生了耐药,这与之前报道的DOX 和VLB药物能产生针对于ABCB1 耐药的结果一致[17-19]。此外,还发现TET 联合DOX 及TET 联合VLB 共同处理时比DOX 和VLB 单独处理时斑马鱼abcb4 耐药基因的mRNA 表达降低,提示TET 能逆转DOX和VLB 引起的耐药,这与之前报道的体外试验中TET 可逆转P-gp 介导的多药耐药性结果一致[8,16,20]。 为进一步验证TET 在斑马鱼体内能逆转化疗药物DOX 和VLB 引起的耐药,本研究采用罗丹明123 实验检测不同药物处理后斑马鱼的药物外排功能变化,进一步检测不同药物处理组的野生型斑马鱼的耐药程度变化情况。
罗丹明实验结果显示,经DOX 和VLB 处理后斑马鱼体内罗丹明染液累积量降低,说明斑马鱼体内产生了针对abcb4 的耐药,DOX 和VLB 药物暴露后,abcb4 编码的P-gp 转运体激活将罗丹明染液排出体外从而导致斑马鱼体内罗丹明染液累积量降低,与实时荧光定量PCR 检测到的结果一致。 此外,TET 联合DOX 及TET 联合VLB 共同处理时比DOX 和VLB单独处理时斑马鱼体内罗丹明123 染液累积量增加,提示TET 能逆转DOX 和VLB 引起的耐药,这与实时荧光定量PCR 检测结果一致。 此外,TET 联合DOX共同处理比TET 单独处理时斑马鱼体内罗丹明123染液累积量增加,而abcb4 耐药基因的mRNA 表达量无明显差异,提示TET 联合DOX 时TET 可能通过下调abcb4 的表达量和降低abcb4 转运体的活性两种方式逆转DOX 引起的耐药。
综上所述,本研究首先证实了TET 对斑马鱼具有较低的发育毒性;其次,证实斑马鱼体内的abcb4基因相关耐药机制与人体内ABCB1 基因相关耐药机制高度保守。 最后确定TET 对易引起肿瘤耐药的DOX 和VLB 有逆转耐药的作用,为TET 的临床应用提供有力的实验依据,同时也证实了斑马鱼在药物筛选方面的可行性。
