中性粒细胞与淋巴细胞比值对T3N0M0期食管鳞癌术后辅助治疗预后的预测价值*
2020-06-23张璐彭林王奇峰马士淇曹邦荣韩泳涛
张璐,彭林,王奇峰,马士淇,曹邦荣,韩泳涛
610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 放射肿瘤学四川省重点实验室(张璐、王奇峰、马士淇、曹邦荣),胸外科中心(彭林、韩泳涛)
食管癌是最常见的消化系统肿瘤之一。世界卫生组织、国际癌症研究机构调查的数据显示,2012 年全球约有45.6 万食管癌新发病例,占全部癌症发病的3.2%;死亡病例约 40 万,占全部癌症死亡人数的4.9%[1-2]。在我国,2012年食管癌新发病例为28.7万,占中国全部癌症发病的8.0%,居各部位癌症发病的第5位,食管癌发病率为21.27/10万。食管癌组织病理学上分为食管鳞癌和食管腺癌,食管鳞癌是食管鳞状细胞分化的恶性上皮性肿瘤。我国每年有16~20万人死于食管癌,死亡率居我国所有恶性肿瘤第4位[3]。其中,食管鳞癌占食管癌90%以上。由于早期症状不明显,目前多数食管癌患者在初次就诊时已处于进展期。T3N0M0期食管癌是临床上常见的局部晚期病例,治疗方式以手术联合放/化疗的综合治疗为主。研究显示该期患者中存在一些亚型预后差异较大,提示T3N0M0期食管癌仍具有较大的异质性[4]。虽然按照肿瘤分级程度T3N0M0期食管癌可分为IIA和IIB期,但对患者预后指导有限。因此,迫切需要寻找新的生物标志物对T3N0M0期食管癌预后进行精准评估,为个体化治疗提供依据。
肿瘤相关炎症与肿瘤的发生进展密切相关,炎性细胞通过促进癌细胞增殖、血管生成、粘附和侵入血管导致肿瘤侵袭和转移。中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)作为全身性炎症反应指标,与肺癌[5]、胃癌[6-7]、结直肠癌[8]等多种实体肿瘤的预后相关。高NLR值的食管癌患者与低NLR值的食管癌患者的预后存在差异,差异有统计学意义[9-12],但NLR对T3N0M0期食管癌亚群预后的影响鲜有报道,因此本研究回顾性分析317例T3N0M0期亚群食管鳞癌患者的临床资料,探讨术前NLR与T3N0M0期亚群食管鳞癌患者临床病理相关性及在预后中的价值。
1 资料与方法
1.1 资料来源
回顾性收集2008~2014年在四川省肿瘤医院行根治手术的317例食管鳞癌患者的临床病理资料。纳入标准:(1)病理组织学证实为食管鳞癌;(2)接受根治性手术;(3)术前1~2周血液学资料完整;(4)未接受术前辅助治疗;(5)随访资料完整;(6)术后病理分期为pT3N0M0,病理分期采用美国癌症联合委员会第八版TNM分期。排除标准:(1)术前合并自身免疫性疾病或全身感染的患者;(2)在围术期死亡或非肿瘤死亡;(3)合并血液系统疾病。185例患者术后4~6周接受基于铂类药物的标准化疗方案,或调强放疗,总剂量50~54 Gy(25~30个分割,5分割/周,治疗持续5~6周)。通过电话、短信等定期复查的方式进行随访。总生存期(overall survival,OS)为患者术后至死亡或最后一次随访的时间间隔。无进展生存期(progression-free survival,PFS)为患者术后至第一次发生疾病进展或任何原因死亡的时间。本研究所有患者均签署知情同意,并通过四川省肿瘤医院伦理委员会审查。
通过电子病理管理收集患者临床病例资料,包括患者年龄、性别、肿瘤位置、分化程度、TNM分期、远期生活质量评估(Karnofsky Performance Scale,KPS)分级等。血常规检测采用迈瑞6800全自动五分类血液细胞分析仪,包括红细胞计数、淋巴细胞计数、中性粒细胞计数等。计算术前NLR值,NLR=中性粒细胞计数/淋巴细胞计数。
1.2 统计学方法
分析术前NLR值与T3N0M0期患者的临床病理相关性。按照NLR值中位数(2.14)将患者分为两组,采用卡方检验或Fisher精确检验对不同NLR分组的临床病理指标进行比较分析。单因素分析包括性别、年龄、KPS评分、多癌灶、肿瘤位置、肿瘤分化程度、手术切缘、血管侵犯、神经侵犯、淋巴结清扫数目、TNM分期和术后辅助治疗。对单因素分析中P<0.1的变量进行多因素Cox回归分析。采用Kaplan-Meier曲线和log-rank检验比较NLR<2.14和NLR≥2.14两组患者的OS和PFS。按照NLR进行分层,用Kaplan-Meier曲线和log-rank检验比较手术+辅助治疗与单纯手术组之间的生存差异。统计分析均使用R软件v.3.5.1(https://www.R-project.org/)进行,双侧检验水准P< 0.05,认为差异有统计学意义。
2 结 果
2.1 临床资料
在本数据中,男性258例,女性59例。食管下段癌65例,食管中段癌154例,食管上段癌98例。肿瘤位置、分化程度等均有胸外科医生及病理科医生进行评估并复核。按照食管癌TNM分期标准,IIA期135例,IIB期 182例(表1)。
2.2 不同NLR组的生存分析
Kaplan-Meier分析显示,不同NLR分组患者的OS存在差异,差异有统计学意义(P=0.006),高NLR组患者的OS低于低NLR组(50%vs70%)。同时,不同NLR分组患者的无进展生存率存在差异,差异有统计学意义(P=0.017),高NLR组患者的无进展生存率低于低NLR组(45%vs60%)(图1)。因此,生存分析显示NLR升高与OS、PFS降低有关。
表1 317例食管鳞癌患者的各临床病理特征构成
Table 1. Clinical and Pathological Features of 317 Patients with Esophageal Squamous Cell Carcinoma

VariableN(%)Age (year) <65225 (70.98) ≥6592 (29.02)Gender Male258 (81.39) Female59 (18.61)Karnofsky score 90-100197 (62.15) 70-80120 (37.85)Multifocal tumor No312(98.42) Yes5 (1.58)Differentiation High83 (26.18) Middle126 (39.75) Poor108 (34.07)Tumor location Upper98 (30.91) Middle154 (48.58) Lower65 (20.51)Surgical margin R0303 (95.58) R1/R214 (4.42)Vascular invasion No301 (94.95) Yes16 (5.05)Neural invasion No279 (88.01) Yes38 (11.99)Number of lymph node dissection <1051 (16.09) ≥10266 (83.91)Adjuvant therapy No132 (41.64) Yes185 (58.36)Pathological stage IIA135 (42.59) IIB182 (57.41)
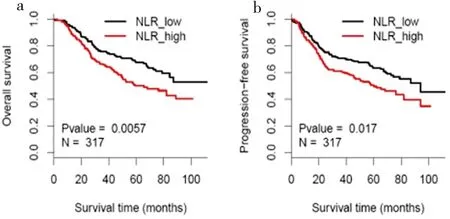
图1 食管鳞癌不同NLR组生存曲线
Figure 1. Survival Time of Patients with Esophageal Squamous Cell Carcinoma in Different NLR Groups
NLR: Neutrophil-to-lymphocyte ratio.
2.3 不同NLR组临床病理特征比较
以NLR中位数2.14为截点,将患者分为高NLR值组(NLR≥2.14)和低NLR值组(NLR<2.14)。其中,高值组159例,低值组158例。两组患者间年龄、性别、食管多灶癌、分化程度、手术切缘、脉管癌栓、神经侵犯、淋巴结清扫组数差异无统计学意义(P>0.05)(表2)。不同NLR分组的KPS评分存在差异,差异有统计学意义(P=0.025);不同NLR分组的肿瘤位置存在差异,差异有统计学意义(P=0.009);不同NLR分组的病理分期存在差异,差异有统计学意义(P=0.026)(表2)。
表2 不同NLR组临床病理特征比较
Table 2. Clinicopathological Features in Different NLR Groups
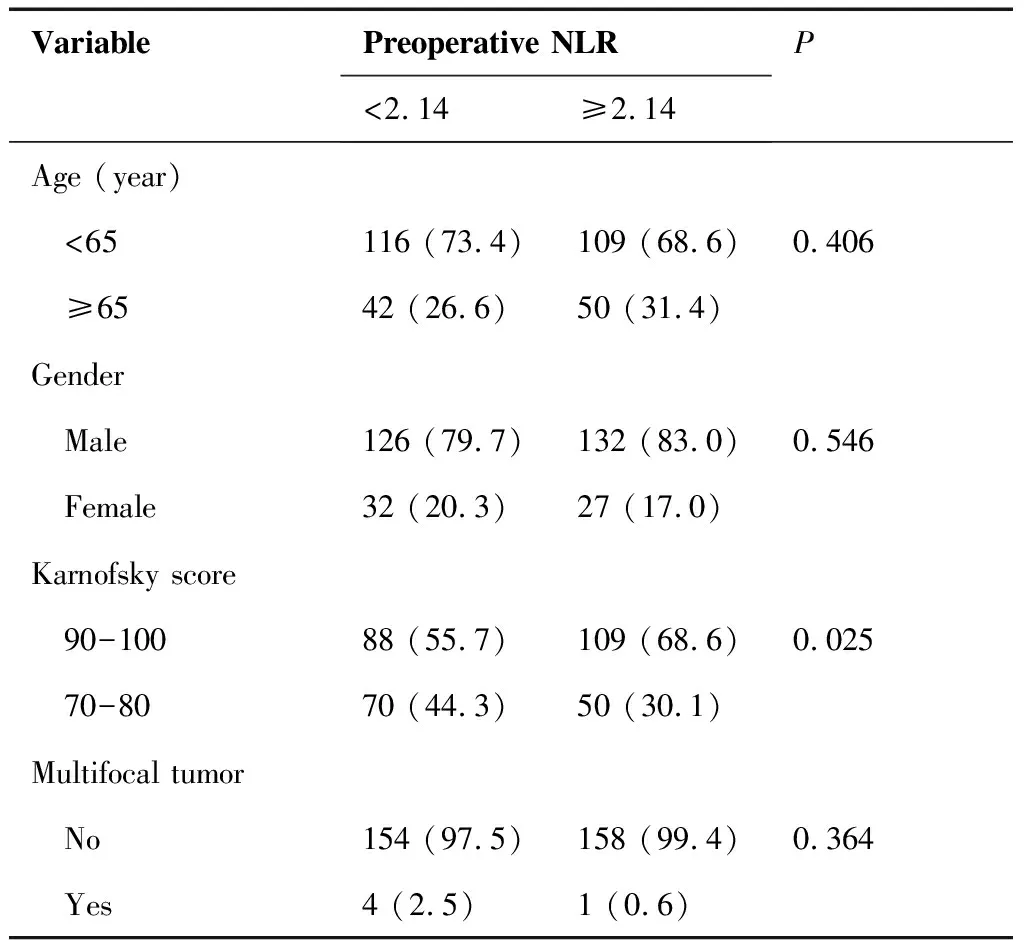
VariablePreoperative NLR<2.14≥2.14PAge (year) <65116 (73.4)109 (68.6)0.406 ≥6542 (26.6)50 (31.4)Gender Male126 (79.7)132 (83.0)0.546 Female32 (20.3)27 (17.0)Karnofsky score 90-10088 (55.7)109 (68.6)0.025 70-8070 (44.3)50 (30.1)Multifocal tumor No154 (97.5)158 (99.4)0.364 Yes4 (2.5)1 (0.6)
NLR: Neutrophil-to-lymphocyte ratio.
2.4 Cox回归分析影响T3N0M0患者的预后因素
多因素Cox回归分析结果发现,淋巴结清扫组数≥10枚的患者发生死亡的风险是淋巴结清扫组数<10枚的0.54倍(HR:0.54, 95%CI:0.36~0.8,P=0.002);接受辅助治疗患者发生死亡的风险是单纯手术治疗的0.63倍(HR:0.63,95%CI:0.42~0.93,P=0.02);NLR≥2.14组患者发生死亡的风险是NLR<2.14组患者的1.43倍(HR: 1.43,95%CI:1.01~2.02,P=0.041)。
多因素Cox回归分析的结果显示,肿瘤分化程度低的患者发生疾病进展的风险是肿瘤分化程度高的1.60倍(HR:1.60, 95%CI:1.05~2.46,P=0.031);淋巴结清扫组数≥10枚的患者发生疾病进展的风险是淋巴结清扫组数<10枚的0.51倍(HR:0.51,95%CI:0.35~0.75,P<0.001);接受辅助治疗患者发生疾病进展的风险是单纯手术治疗的0.62倍(HR:0.62,95%CI0.42~0.93,P=0.017)(表3)。
表3 影响PFS、OS的多因素Cox回归分析
Table 3. Multivariate Cox Regression Analysis of Factors Affecting PFS and OS

VariablePFSOSHR95%CIPHR95%CIPAge (year) <6511 ≥651.110.78-1.580.5761.080.75-1.570.678Karnofsky score 90-10011 70-800.830.55-1.260.3890.720.48-1.090.120Differentiation High1 Middle1.450.92-2.220.093 Poor1.601.05-2.460.031Number of lymph node dissection <1011 ≥100.510.35-0.75<0.0010.540.36-0.800.002Adjuvant therapy No11 Yes0.620.42-0.930.0170.630.42-0.930.020NLR <2.1411 ≥2.140.340.97-1.860.0751.431.01-2.020.041
Variables of the multivariate Cox regression analysis correction included gender, multifocal tumor, tumor location, surgical margin, vessel invasion, neural invasion and pathological stage.
PFS: Progression-free survival; OS: Overall survival; NLR: Neutrophil-to-lymphocyte ratio.
2.5 NLR预测T3N0M0食管鳞癌患者辅助治疗获益
在低NLR值组中,术后辅助治疗与单纯手术治疗患者的5年OS存在差异,差异有统计学意义,术后辅助治疗患者的5年OS高于单纯手术治疗(75%vs45%,P<0.001);术后辅助治疗与单纯手术治疗患者的无进展生存率存在差异,差异有统计学意义,术后辅助治疗患者的无进展生存率高于单纯手术治疗(78%vs40%,P<0.001)(图2-a1、a2)。在高NLR值组中,术后辅助治疗与单纯手术治疗患者的5年OS差异无统计学意义;术后辅助治疗与单纯手术治疗患者的无进展生存率差异无统计学意义(图2-b1、b2)。
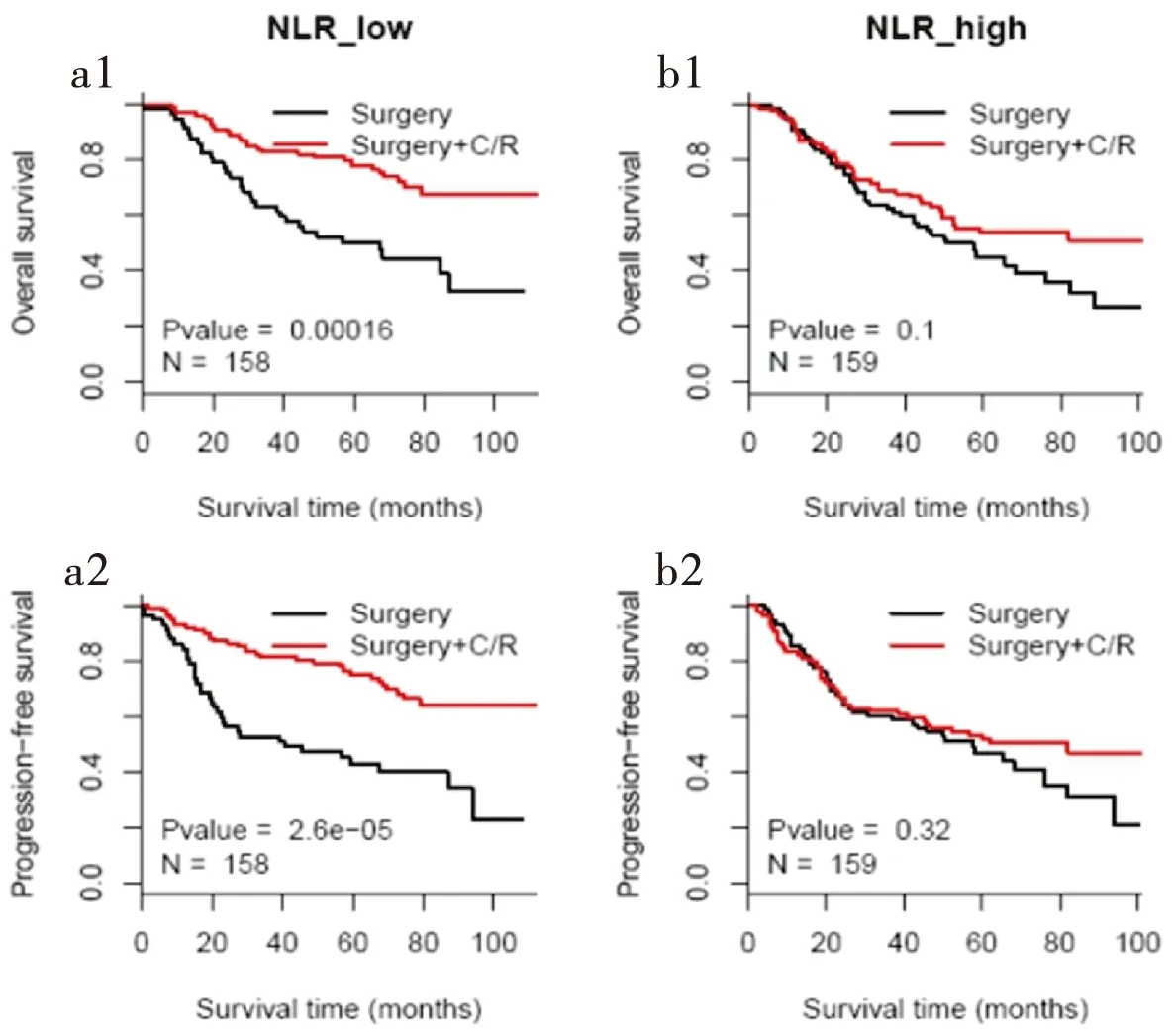
图2 食管鳞癌单纯手术及术后辅助治疗组生存曲线分析
Figure 2. Survival Time of Patients with Esophageal Squamous Cell Carcinoma in Different Groups
NLR: Neutrophil-to-lymphocyte ratio; C/R: Chemotherapy/radiotherapy (postoperative adjuvant therapy).
3 讨 论
本研究回顾性分析了317例pT3N0M0食管鳞癌患者的临床资料,发现以NLR的中位数2.14作为截点,不同NLR分组患者的KPS(Karnofsky)评分、肿瘤位置以及肿瘤分期差异有统计学意义,NLR值越高(NLR≥2.14),5年OS和PFS越低,预后越差。在低NLR值组中,术后辅助治疗与单纯手术治疗患者的5年总生存率存在差异(P<0.001),术后辅助治疗患者的5年总生存率高于单纯手术治疗(75%vs45%);术后辅助治疗与单纯手术治疗患者的无进展生存率存在差异(P<0.001),术后辅助治疗患者的无进展生存率高于单纯手术治疗(78%vs40%)。在高NLR值组中,术后辅助治疗与单纯手术治疗患者的5年生存期的差异无统计学意义,接受术后辅助治疗对生存率无明显改变。NLR是炎性反应指标,而炎性通路异常激活与肿瘤放、化疗抵抗密切相关[13-14]。因此,低NLR的患者可能对放、化疗更敏感,从而拥有较好的治疗预后。
张思思等[12]针对接受食管癌根治术的137例患者行COX分析发现,术前NLR≥2的患者5年总生存率为29%,无病生存率为29%,与NLR<2组相比,两组的5年总生存率差异有统计学意义(P=0.003);术前NLR<2的患者5年总生存率为52.9%,无病生存率为50%,两组的无病生存率差异有统计学意义(P=0.006)。Feng等[15]回顾性分析483例行根治性手术食管鳞状细胞癌患者的临床资料,以NLR=3.5为界限,分为高/低值组,发现高值组总生存率为35.4%,低值组总生存率为57.7%(P<0.001),认为高NLR值是食管癌根治术后患者总生存期的预测因子。Yoo等[16]对138例接受同步放化疗的局部进展期(Ⅱ期或Ⅲ期)的食管癌患者进行随访,结果发现高NLR组(NLR≥2)的无病生存期及总生存期均低于低NLR组(NLR<2),多因素分析显示高水平的NLR是该类患者总生存期及无病生存期的预后指标。以上研究中NLR界限不同,可能与人群、基线以及分期亚组等不同有关。但大多数文献肯定了NLR的预后预测价值,即高水平NLR提示食管癌患者术后预后不佳。我们通过对317例T3N0M0期食管癌患者的分析,进一步证实高NLR在这类患者中的预后价值。
刁鹏等[17]研究NLR与非小细胞肺癌的临床病理相关性,发现男性NLR高于女性,高年龄组(≥60岁)的NLR高于低年龄组(<60岁)。分化程度越差,T分期越晚,肿瘤长径越大,NLR越高。此外,不同病理类型之间,NLR也存在差异。本次研究中,我们发现NLR与T3N0M0期食管癌KPS评分、病理分级、肿瘤位置、TNM分期有关,与上述研究结果具有一致性。
术后辅助治疗可改善局部晚期食管癌患者预后[18-21],但缺乏生物标志物对患者进行精准分层及指导治疗。本研究发现术前NLR<2.14的T3N0M0患者可从术后辅助治疗中获益。而NLR≥2.14的患者中,术后辅助治疗组与单纯手术组的OS和PFS的差异均无统计学意义。该发现与已报道的一篇文章结论相似,但作者研究的是术前新辅助化疗。Sato等[22]对接受新辅助化疗的晚期食管癌患者资料进行分析,以NLR=2.2为分界,发现化疗前低NLR组的缓解率为56%(22/39),而高NLR组的缓解率为21%(9/42),差异有统计学意义(P=0.001)。因此,NLR可能是食管癌患者辅助治疗获益的一个预测指标。
综上所述,术前NLR是T3N0M0期食管癌的一项独立预后因素。低NLR值(<2.14)可能是T3N0M0期食管癌患者从术后辅助治疗获益的一个预测指标。由于本研究为回顾性研究,且样本例数较少,尚存在一定局限性,结论还需要在大样本、前瞻性数据中进一步验证。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
