免疫组织化学法与Sanger测序法对IDH1基因突变检测的比较分析*
2020-06-23吴小延刘小云邵琼龙亚康王芳李月
吴小延,刘小云,邵琼, 龙亚康, 王芳, 李月
510060 广州,中山大学肿瘤防治中心, 华南肿瘤学国家重点实验室,肿瘤医学协同创新中心
恶性神经胶质瘤是起源于中枢神经系统的最常见的颅内恶性肿瘤,占颅脑肿瘤的40%~50%。胶质母细胞瘤(glioblastoma,GBM)可分为原发性GBM和继发性GBM。目前,胶质瘤的标准病理学诊断依据是世界卫生组织(World Health Organization,WHO)制定的分级系统,即根据组织学形态和分子检测结果将其分为Ⅰ~Ⅳ级[1]。IDH1基因突变是2008年Parsons等[2]首次在胶质瘤中发现,并且被各国学者证实为影响胶质瘤预后的重要标志[3]。大量临床胶质瘤的病例-对照研究发现,IDH1基因突变好发于超过75%的低级别胶质瘤(WHO Ⅱ~Ⅲ级)和90%的继发性高级别胶质细胞瘤[4]。因此,IDH1基因突变被认为是胶质瘤发生的早期事件,可能是胶质瘤发生的驱动因子,对胶质瘤的发生和发展具有重要影响[5]。现在普遍认为IDH1突变是初级胶质瘤和sGBM的确定性分子标志物[6]。超过90%的IDH1突变发生于4号外显子上第132位氨基酸碱基序列(CGT突变为CAT),导致其编码的氨基酸由精氨酸突变为组氨酸(R132H)。常规组织病理学在胶质瘤的分型方面具有一定的局限性,而近期研究发现IDH1突变状态可辅助病理及临床医师对胶质瘤进行更加精准的诊断分型[2]。目前,临床常用的IDH1突变检测方法主要为免疫组织化学法(immunohistochemistry,IHC)和Sanger测序法,然而对于二者检测IDH1基因突变一致性的比较分析鲜有报道,方法选择策略尚待明确。
本研究中,我们回顾性地收集了657份胶质瘤患者肿瘤样本,同时利用Leica全自动免疫组化系统与Sanger测序法检测IDH1基因突变,评估两种检测技术的检测效能及一致性,为临床及病理医生在IDH1突变不同检测方法的选择上提供指导依据。
1 材料与方法1.1 标本来源
收集2014年至2019年中山大学肿瘤防治中心手术切除且经病理确诊为胶质瘤及其它神经上皮性肿瘤标本657例,其中男性371例,女性285例,平均年龄(40.5±17.5)岁,范围(1~81岁)。病理分级依据2007年版WHO中枢神经系统肿瘤病理分级标准:Ⅰ级54例(毛细胞星形细胞瘤50例、室管膜下瘤2例、胚胎发育不良性神经上皮肿瘤1例、室管膜下巨细胞星形细胞瘤1例),Ⅱ级192例(星形细胞瘤119例、少突胶质细胞瘤50例、室管膜瘤8例、少突星形细胞瘤4例、多形性黄色星形细胞瘤4例、节细胞胶质瘤4例、中枢神经细胞瘤2例、脑室外神经细胞瘤1例),Ⅲ级118例(间变型星形细胞瘤59例、间变型少突胶质细胞瘤33例、间变型室管膜瘤15例、间变型少突星形细胞瘤5例、间变型毛细胞型星形细胞瘤2例、节细胞胶质瘤1例、间变型多形性黄色星形细胞瘤1例、乳头状脑膜瘤1例、间变型节细胞胶质瘤1例),Ⅳ级293例(原发性胶质母细胞瘤248例、继发性胶质母细胞瘤18例、弥漫中线胶质瘤15例、组织类型未明胶质瘤6例、胶质肉瘤4例、非典型畸胎样/横纹肌样肿瘤1例、髓母细胞瘤1例)。
1.2 IHC
常规石蜡包埋组织切片,厚3~4 μm,65℃烤片1h。使用IDH1-R132H即用型鼠抗人单克隆抗体(福州迈新生物技术开发有限公司),采用Laica全自动免疫组化仪(Leica Microsystems Nussloch GmbH)进行检测。阳性判读标准:≥10%的肿瘤细胞胞浆内有棕黄色或棕褐色颗粒。
1.3 Sanger测序法
常规石蜡包埋组织切片,根据HE染色结果,富集肿瘤细胞区域(大于60%)并按试剂盒说明书进行组织DNA提取(FFPE DNA Kit试剂盒,QIAGENA公司)。IDH1基因4号外显子扩增引物由上海英潍捷基公司合成,IDH1正向引物F:5’-TGCCACCAACGACCAAGTCA-3’;反向引物R:5’-CCTTGCTTAATGGGTGTA-3’,扩增产物长度为290 bp。配置25 μL PCR反应体系:DNA模板5 μL,IDH1引物上下游使用液各(10 μM)1 μL,2×Premix EX TapTM12.5 μL,去离子水5.5 μL。PCR反应条件为94 ℃ 5 min;94℃ 30s,56℃ 30s,72℃ 30s,共32个循环;72℃ 5 min,4℃保温。使用ABI3500XL型测序分析仪进行双向测序,使用Chromas软件分析测序结果,根据碱基信号峰图判定是否存在突变。
1.4 统计学分析
应用R语言软件进行统计学分析,IHC与Sanger测序法的差异及一致性比较采用配对χ2检验及Kappa一致性检验。P<0.05为差异有统计学意义;Kappa≥0.75两者一致性较好,0.4≤Kappa<0.75两者一致性中等,Kappa<0.4两者一致性较差[7]。
2 结 果
2.1 IHC检测IDH1基因突变
IDH1R132H阳性主要分布于细胞浆(图1)。本研究结果显示,35.0%(230/657)标本可见IDH1R132H蛋白表达(表1)。另有49例标本检测结果为少量阳、弱阳等可疑阳性,经Sanger测序进一步验证,其中23例为阳性,26例为阴性。
图1 胶质细胞瘤形态学HE染色及相应的IDH1R132H表达(×100)
Figure 1. HE Staining and CorrespondingIDH1R132H Expression of Gliomas (×100)
Panel A and B show morphology ofIDH1wild-type glioma by HE staining and negative results ofIDH1R132H by IHC staining; Panel C and D show morphology ofIDH1-mutant glioma by HE staining and positive results ofIDH1R132H by IHC staining. HE: hematoxylin eosin.
2.2 Sanger测序法检测IDH1基因突变
在胶质瘤中,IDH1基因最常见突变位点为4号外显子第132位密码子的错义突变(CGT>CAT,R132H)。本研究657例样本中,38.8%(255/657)检测出IDH1R132基因点突变(表1),其中R132H突变251例(98.4%),R132G(132位精氨酸突变为甘氨酸)突变2例(0.8%),R132C(132位精氨酸突变为半胱氨酸)及R132S(132位精氨酸突变为丝氨酸)各1例(0.4%)(图2、3,表2)。此外,11例样本经Sanger测序检测失败进一步行IHC检测,结果显示其中7例阴性,3例为阳性,1例组织掉片无法检测。
图2 琼脂糖凝胶电泳结果
Figure 2. Results of Agarose Gel Electrophoresis Agarose gel electrophoresis shows that PCR amplification products ofIDH1are 290 bp in length. Marker 1-5 are five randomly selected samples ofIDH1mutation. PCR: Polymerase chain reaction.
表1 IHC与Sanger测序法检测结果比较
Table 1. Results of IHC and Sanger Sequencing

Pathological typeWHO gradeNIHCSanger sequencingPositive (%)Mutation (%)Pilocytic astrocytomaI501(2)0(0)SubependymomaI20(0)0(0)Embryogenic dysplastic neuroepithelial neoplasmI10(0)0(0)Subependymal giant cell astrocytomaI10(0)0(0)Total (I)I541(1.9)0(0)AstrocytomaII11972(60.5)85(71.4)OligodendrogliomaII5042(84)44(88)EpendymomaII80(0)0(0)OligoastrocytomaII42(50)2(50)Pleomorphic xanthoastrocytomaII40(0)1(25)GangliogliomaII41(25)2(50)Central neurocytomaII20(0)0(0)Extraventricular neurocytomaII10(0)0(0)Total (II)II192117(60.9)134(69.3)Anaplastic oligodendrogliomaIII5933(55.9)36(61.0)Anaplastic ependymomaIII3327(81.8)27(81.8)Anaplastic ependymomaIII150(0)0(0)Anaplastic oligoastrocytomaIII55(100)5(100)Anaplastic pilocytic astrocytomaIII20(0)0(0)GangliogliomaIII10(0)0(0)Anaplastic Pleomorphic xanthoastrocytomaIII10(0)0(0)Papillary meningiomaIII10(0)0(0)Anaplastic gangliogliomaIII11(100)1(100)Total (III)III11866(55.9)69(58.5)Primary GBMIV24834(13.7)38(15.3)Secondary GBMIV1811(61.1)12(66.7)Diffuse midline gliomaIV150(0)0(0)GliosarcomaIV40(0)0(0)Atypical teratoid/rhabdoid tumorIV10(0)0(0)MedulloblastomaIV10(0)0(0)UncertainIV61(16.7)2(33.3)Total (IV)IV29346(15.7)52(17.7)Total (I-IV)657230(35.0)255(38.8)
IHC: Immunohistochemistry; WHO: World Health Organization.
表2 255例脑胶质瘤中IDH1突变位点分布
Table 2. Distribution ofIDH1Mutations in 255 Cases of Glioma
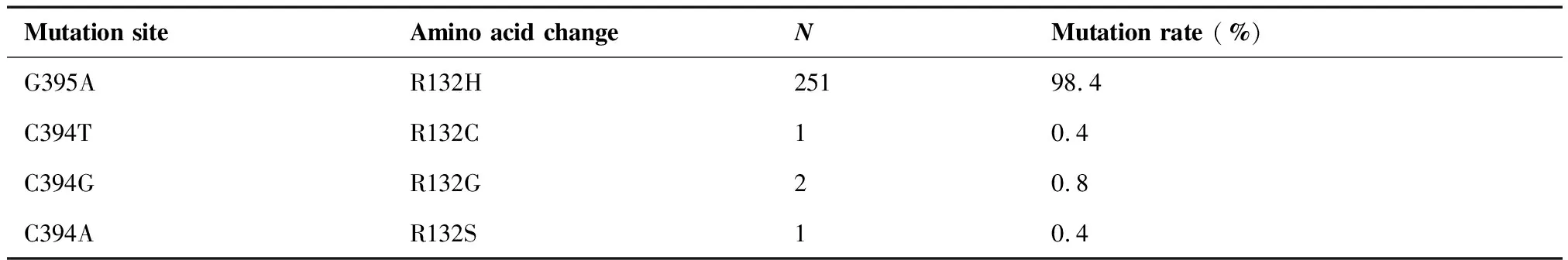
Mutation siteAmino acid changeNMutation rate (%)G395AR132H25198.4C394TR132C10.4C394GR132G20.8C394AR132S10.4

图3IDH1野生型和IDH1突变型的Sanger测序结果
Figure 3. Sanger Sequencing Results of Wild-Type and MutatedIDH1
2.3 IHC与Sanger测序法检测结果比较
本研究共纳入657例标本,其中49例IHC结果可疑、11例Sanger测序失败,共有597例标本同时完成IHC及Sanger测序检测。其中,94.5%(564/597)检测结果一致,仅有5.5%(33/597)两种方法检测结果存在差异。两者检测结果通过配对χ2检验比较,差异无统计学意义(P=0.49,表3);通过Kappa一致性检验分析,两种检测方法的结果具有较好的一致性(Kappa=0.88)。
表3 IHC和Sanger测序法检测结果的配对χ2检验分析
Table 3. McNemar-Bowker Test for Results of IHC and Sanger Sequencing

IHCSanger sequencingPositiveNegativeTotalPositive21314227Negative19351370Total232365597
IHC: Immunohistochemistry.
两种检测方法不一致的33例标本中,14例IHC检测为阳性而Sanger测序为阴性,19例IHC检测为阴性而Sanger测序为阳性。
2.4 高通量测序法验证IHC和Sanger测序不一致标本
本研究中,共有33例样本经两种方法检测后结果不一致,我们对其中11例进行高通量测序验证,其余22例因核酸质量不足而无法进行进一步验证。结果发现,6例原本是IHC阳性、Sanger测序阴性的标本,高通量测序结果为5例阳性,1例阴性;5例原本是Sanger测序阳性、IHC阴性的标本,高通量测序结果全部为阳性(图4,表4)。
表4 高通量测序法验证IHC和Sanger测序结果不一致标本
Table 4. High-Throughput Sequencing Verifying Specimens with Inconsistent Results Detected by IHC and Sanger Sequencing

IDH1NGS+NGS-TotalIHC+Sanger-516IHC-Sanger+505
NGS: Next-generation sequencing; IHC: Immunohistochemistry; Sanger: Sanger sequencing.

图4IDH1R132H 突变型的高通量测序结果
Figure 4. Results ofIDH1R132H Mutations Detected by High-Throughput Sequencing
2.5 原发性与继发性胶质母细胞瘤比较
266例IV级胶质母细胞瘤中,248例为原发性,18例为继发性。检测结果显示,继发性胶质母细胞瘤IDH1基因突变阳性率明显高于原发性胶质母细胞瘤(P=0.025,表5)。继发性胶质母细胞瘤中IDH1基因突变阳性率在IHC和Sanger测序中分别为61.1%和66.7%,原发性胶质母细胞瘤阳性率分别为13.7%和15.3%。
表5 原发性GBM和继发性GBMIDH1基因突变率结果的比较
Table 5.IDH1Mutation Rates of Primary and Secondary GBM

Pathological typeNNumber of positive cases (%)IHCSanger sequencingPrimary GBM24834(13.7)38(15.3)Secondary GBM1811(61.1)12(66.7)
GBM: Glioblastoma; IHC: Immunohistochemistry.
3 讨 论
位于染色体2q33上的IDH1基因,编码异柠檬酸脱氢酶,其作用是催化异柠檬酸氧化为草酰琥珀酸,然后转化为α-酮戊二酸,导致烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)的产生。在人类基因组中编码的5种异柠檬酸脱氢酶蛋白中,至少有3种位于线粒体中,而IDH1位于细胞质和过氧化物酶体内[8]。IDH1蛋白酶形成一个非对称性同源二聚体,是细胞三羧酸循环中重要的限速酶[9],并被认为通过产生NADPH在细胞控制氧化损伤中发挥重要作用,而IDH2与IDH3主要参与细胞的能量代谢[10]。早期研究发现IDH1的突变与脑胶质瘤密切相关[2,11],之后又发现其与前列腺癌、副神经节瘤、大肠癌、胆管癌、软骨肉瘤以及急性髓细胞白血病相关[12]。其致瘤机制为突变的IDH能将α-酮戊二酸转化为2-羟戊二酸,且后者可以抑制前者的靶点,导致这些靶点表达异常而引发癌症。最新的研究发现,在肝内胆管细胞癌中,也有IDH1突变[13]。随着研究的不断深入,越来越多的研究证实,IDH1基因突变与胶质瘤的发生、发展有着重要关系[14]。
IDH1在胶质瘤中突变类型均是碱基错义突变导致单个氨基酸替换,且突变均发生于与异柠檬酸盐结合部位的进化保守区域。本研究发现,90%以上的突变类型是R132H,密码子由CGT突变为CAT,与之前文献报道一致[15]。其它位点可偶见报道,Hartmann等[16]研究表明非R132H突变类型发生率低于5%。本研究结果与既往报道结果相似[17-18],Sanger测序法仅检测到4例(1.6%)R132H以外的点突变类型,分别为2例R132G、1例R132C及1例R132S。本研究显示,这些稀有突变分布在不同的胶质瘤亚型中:2例R132G分别发现于星形细胞瘤和胶质母细胞瘤;1例R132C发现于间变型星形细胞瘤;1例R132S发现于间变型星形细胞瘤,但因例数过少,无法分析少见IDH1突变类型与组织学分型之间是否存在联系,但是有文章发现这些少见突变类型的发生可能有谱系偏爱性[19]。关于这些少见突变是否具有与R132H突变同等重要的鉴别诊断意义及判读预后价值,尚需更加深入的研究。
我们通过两种方法进行IDH1突变状况的分类,结果显示,不同组织病理分型中突变阳性率存有一定的差异性,在54例Ⅰ级胶质瘤中,仅有1例毛细胞型星形细胞瘤可见IDH1基因突变,其发生机制可能与其他低级别胶质瘤不同[20]。另一方面,也提示我们对于低级别星形细胞瘤,当组织病理学诊断不明确,无法区分弥漫性星形细胞瘤和毛细胞型星形细胞瘤时,可通过IDH1基因突变检测加以鉴别,以便给患者带来最适合的治疗方案,取得最好的治疗效果[21]。本研究中,两种检测方法的结果显示,IDH1基因突变阳性率在Ⅱ~Ⅲ级的星形细胞瘤和少突胶质细胞瘤中及Ⅳ级继发性GBM中较高,而在原发性GBM中IDH1基因突变阳性率较低(约15%)(表1),原发性GBM中IDH1基因突变率与国内外文献报道基本一致(11.39%~17.64%)[21-29]。以往的研究表明,继发性与原发性GBM发病机制有所不同,原发性GBM病变迅速出现,恶性前体病变的临床证据比较少,而继发性GBM从低级别的神经胶质瘤发展而来[30]。WHO Ⅱ级中少突星形细胞瘤突变率为50%(2/4)、4例多形性黄色星形细胞瘤突变率为25%(1/4)、4例节细胞胶质瘤突变率为50%(2/4),其他间变型室管膜瘤、间变型毛细胞型星形细胞瘤、间变型多形性黄色星形细胞瘤等其他类型肿瘤中均未发现IDH1基因突变。WHO Ⅲ级中5例间变型少突星形细胞瘤和1例间变型节细胞胶质瘤均可见突变;以上研究说明IDH1突变频繁发生于一些特定类型的胶质瘤,特别是星形细胞瘤、少突胶质细胞瘤及继发性胶质母细胞瘤中,而在室管膜瘤、髓母细胞瘤等其他胶质瘤中罕见发生[31]。
本研究发现,IHC与Sanger测序法检测IDH1基因突变结果具有较好的一致性(Kappa=0.88)。Sanger测序法是目前测定IDH1突变的最常用方法,可检测具体的突变位点,但操作较为繁琐,对实验室环境设备及技术员操作技能要求高。来源于肿瘤周围正常脑组织及淋巴细胞的DNA可能将低丰度的突变序列稀释,导致其低于检测阈值而呈现假阴性结果。另外,Sanger测序法敏感性较低,需要至少20%突变的等位基因才能得出准确的结果[32]。IHC法操作简单,绝大多数病理实验室均可以开展,无论手工还是自动化仪器均可获得较为满意的结果,但有时免疫组化仪染色可能出现背景偏深或局灶少量染色难以明确判读,给病理医师的诊断分型带来困难,甚至产生假阳性结果。本研究中,有49例IHC结果为弱阳性、少量阳性及不确定等难以明确分类的样本,经Sanger测序均得到了明确的判读结果,即23例为突变型,26例为野生型。由此可见,对于IHC结果可疑或无法判读的样本,进一步进行Sanger测序检测有助于明确结果,为临床和病理医师提供更多诊断依据。
本研究中有14例IHC检测阳性,但Sanger测序检测为阴性的病例,Sanger测序假阴性的结果可能与肿瘤细胞含量较低有关。值得注意的是,4例为R132H以外的少见突变位点阳性的样本(1例R132C突变、2例R132G突变及1例R132S突变)均为Sanger测序检测阳性,但IHC为阴性。这是因为IHC所用抗体主要针对R132H位点突变设计,并不适用于其他类型的突变,这会导致少见突变位点漏诊的情况发生。而Sanger测序法则不受此局限,因为它可明确读出目标区域的碱基序列,所以无论是已知突变位点还是未知突变位点都可以检测到。由于常规组织病理在胶质瘤诊断分型方面具有一定的局限性,IDH1-R132基因位点突变检测的辅助诊断价值日益凸显。高通量测序法的验证结果显示,分子病理诊断应用于临床的重要性,而分子标志物对肿瘤分类、预后判断和进展预测都有重要意义。2016年新版《WHO中枢神经系统肿瘤分类》认为组织学与分子病理分类结果存在分歧时首先考虑分子病理诊断,然而组织学分型十分重要,不能单独依据分子病理结果对中枢神经系统肿瘤分类。中枢神经系统WHO肿瘤分级依然按照组织学标准进行[33]。所以在临床实践中,应根据实际情况选择检测方法,必要时IHC与Sanger测序应互为补充,以获得更加精准的检测结果。
基于IDH1基因突变对胶质瘤具有重要的生物学意义和治疗价值,目前靶向IDH1基因突变的药物研发成为医药界的研究热点。例如,小分子化合物AGI-5198和AGI-6780、针对包含IDH1R132H氨基酸123~142的多肽疫苗以及能激活CD8+T细胞的IDH1 R132H的多肽疫苗[34-37]。近年来,有研究发现周细胞也可以作为胶质瘤潜在的治疗靶点[38]。
综上所述,IDH1突变主要发生在WHOⅡ、Ⅲ和Ⅳ级的星形细胞、少突胶质细胞以及继发性胶质母细胞瘤中。IHC和Sanger测序法检测IDH1基因突变的结果具有较高的一致性,两种平台方法都比较成熟,基本上能够满足临床检测需求。目前尚无一种突变检测方法可以完全避免假阴性或者假阳性而完全准确地检测出基因变异结果,各有优势和不足:免疫组化染色简单、快捷、检测费用相对较低且结果稳定,但有时全自动免疫组化仪染色结果背景偏深,易出现判读困难和假阳性现象;Sanger测序可检测已知和未知突变位点,有降低假阴性结果的产生的优势,但Sanger测序耗时长,检测费用高,对实验室环境要求高。在临床实践中,如有必要应结合多种检测方法以得到准确的结果,以更快地辅助病理诊断及临床治疗,也为抗胶质瘤药物的研发提供参考。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
