重症新型冠状病毒肺炎患者的临床特点及其死亡的影响因素研究
2020-06-23李敏刘建雄胡庆兵
李敏,刘建雄,胡庆兵
2019年12月,新型冠状病毒肺炎(COVID-19)迅速席卷全国[1]。2020-01-12,世界卫生组织正式将引起COVID-19的新型冠状病毒命名为“2019新型冠状病毒(2019-nCoV)”。1月20日,国家卫健委正式将COVID-19纳入乙类传染病,并采取甲类传染病的预防、控制措施。2月10日,国际病毒分类学委员将该病毒正式命名为严重急性呼吸综合征冠状病毒2型(SARS-CoV-2),并指出该类病毒传播性极强,主要通过飞沫和接触传播,其较2003年的非典型肺炎疫情更为严重[2]。截至3月31日,我国已累计感染81 518例,死亡3 305例[3]。本研究旨在分析重症COVID-19患者的临床特征及其死亡的影响因素,以为临床诊疗提供参考。
1 对象与方法
1.1 研究对象 回顾性分析2020年2月1日—3月11日黄冈市中心医院黄冈大别山区域医疗中心重症监护室(ICU)收治的重症COVID-19患者46例,均符合国家卫健委发布的《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》中的重型、危重型COVID-19诊断标准[4],符合以下任意1条即可确诊为重型COVID-19:(1)呼吸窘迫,呼吸频率≥30次/min;(2)静息状态下血氧饱和度≤93%;(3)动脉血氧分压(PaO2)/吸入氧浓度(FiO2)≤300 mm Hg(1 mm Hg=0.133 kPa)。符合以下任意1条即可确诊为危重型COVID-19:(1)出现呼吸衰竭,且需机械通气;(2)出现休克;(3)出现其他器官功能衰竭且需ICU监护治疗。
1.2 诊断标准 由经过培训且考核合格的专业人员对疑似患者进行口咽拭子或鼻咽拭子取样,通过实时荧光反转录聚合酶链式反应(RT-PCR)进行2019-nCoV核酸检测,采用2019-nCoV(ORF1ab/N)核酸检测试剂盒(PCR-荧光探针法),具体操作严格按照试剂盒说明书进行。
1.3 治疗方法 所有患者依据常规诊疗方案[4]给予氧疗、抗病毒治疗,维持水电解质平衡及内环境稳定,严重呼吸衰竭者给予呼吸支持(如高流量鼻导管氧疗、无创/有创机械通气)甚至体外膜肺氧合(ECMO)支持治疗,所有治疗方案均经患者及其家属同意并签署知情同意书。
1.4 观察指标 收集患者临床资料,包括性别、年龄、合并症(包括低钾血症、心血管系统疾病、内分泌系统疾病、呼吸系统疾病、神经系统疾病、肿瘤)、首发症状(包括咳嗽、发热、胸闷、腹泻、乏力、咽喉不适、无症状、鼻塞流涕)、体温、多层螺旋CT(MSCT)评分、治疗方法(包括高流量给氧、无创机械通气、有创机械通气、ECMO)、转归(包括死亡、好转)、实验室检查指标〔包括白细胞计数、中性粒细胞分数、淋巴细胞分数、红细胞沉降率、降钙素原(PCT)、C反应蛋白〕、血气分析〔包括动脉血二氧化碳分压(PaCO2)、PaO2〕、脏器功能损伤(包括肾功能、心肌酶、肝功能、凝血功能异常)。所有数据均为患者入ICU后48 h内的最差值。根据转归将所有患者分为死亡组和好转组,比较两组患者性别、年龄、呼吸频率、心率、平均动脉压(MAP)、体温、合并症、血气分析(包括pH值、PaCO2、PaO2、乳酸、钠离子、钾离子、氯离子)、凝血功能〔包括凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、D-二聚体、纤维蛋白原〕、MSCT评分、肝功能〔包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素、直接胆红素、间接胆红素、白蛋白〕、肾功能(包括尿素氮、肌酐)、心脏相关主要指标(包括肌红蛋白、肌酸激酶同工酶、肌钙蛋白、N末端脑钠肽前体)、发病至入ICU时间、血常规(包括白细胞计数、红细胞计数、血红蛋白、血小板计数、中性粒细胞分数、淋巴细胞分数)、C反应蛋白、PCT、红细胞沉降率、气管插管情况。
1.5 MSCT评分标准 参考甲型流感的肺部弥漫性病变的半定量分析方法[5-6]制定COVID-19的MSCT评分方法,半定量分析肺内病变程度,选取主动脉弓层面、气管隆突层面、下肺静脉汇合层面、膈上层面进行扫描。正常肺组织为0分,病变面积<该层面25%为1分,病变面积占该层面的25%~50%为2分,病变面积占该层面的51%~75%为3分,病变面积>该层面的75%为4分。由2名影像科副主任医师采用双盲法共同分析患者影像特征并进行打分。
1.6 COVID-19病情好转标准 同时满足以下条件即可确定为好转:(1)无需无创或有创机械通气,低浓度氧疗即可维持血氧饱和度>95%;(2)血液循环稳定,无需血管活性药物维持血压;(3)内环境稳定,血气分析大致正常。
1.7 统计学方法 采用SPSS 20.0统计学软件进行数据处理。符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验;偏态分布的计量资料以M(P25,P75)表示,两组间比较采用非参数检验;计数资料以相对数表示,组间比较采用χ2检验;采用多因素Logistic回归分析重症COVID-19患者死亡的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 46例重症COVID-19患者中,男36例(78.3%),女10例(21.7%);年龄<30岁2例(4.3%),30~49岁12例(26.1%),50~69岁20例(43.5%), ≥70岁12例(26.1%);合并症:低钾血症14例(30.4%),心血管系统疾病13例(28.3%),内分泌系统疾病11例(23.9%),呼吸系统疾病7例(15.2%),神经系统疾病3例(6.5%),肿瘤2例(4.3%);首发症状:咳嗽28例(60.9%),发热26例(56.5%),胸闷13例(28.3%),腹泻3例(6.5%),乏力2例(4.3%),咽喉不适2例(4.3%),无症状2例(4.3%),鼻塞流涕1例(2.2%);体温:36.0~37.2 ℃ 18例(39.1%),37.3~38.0 ℃ 12例(26.1%),38.1~39.0 ℃ 14例(30.4%),39.1~41.0 ℃ 2例(4.3%);MSCT评分:0~4分6例(13.1%),5~8分 18例(39.1%),9~12分 15例(32.6%),13~16分7例(15.2%);治疗方法:高流量给氧22例(47.8%),无创机械通气11例(23.9%),有创呼吸机通气13例(28.3%),ECMO支持治疗2例(4.3%);转归:死亡12例(26.1%),好转34例(73.9%);实验室检查指标:白细胞计数升高14例(30.4%)、中性粒细胞分数升高37例(80.4%)、淋巴细胞分数下降42例(91.3%)、红细胞沉降率升高44例(95.7%),PCT升高13例(28.3%),C反应蛋白升高33例(71.7%);血气分析:PaCO2>50 mm Hg 7例(15.2%),PaO2<60 mm Hg 9例(19.6%);脏器功能损伤:肾功能异常27例(56.7%)、心肌酶异常24例(52.2%)、肝功能异常13例(28.3%)、凝血功能异常13例(28.3%)。
2.2 死亡组和好转组患者临床资料比较 死亡组患者年龄大于好转组,心率、MSCT评分、ALT、AST、总胆红素、直接胆红素、尿素氮、白细胞计数、血小板计数、中性粒细胞分数及气管插管率高于好转组,淋巴细胞分数低于好转组,差异有统计学意义(P<0.05);两组患者性别、呼吸频率、MAP、体温、合并症、血气分析、凝血功能、间接胆红素、白蛋白、肌酐、心脏相关主要指标、发病至入ICU时间、红细胞计数、血红蛋白、C反应蛋白、PCT、红细胞沉降率比较,差异无统计学意义(P>0.05,见表1)。
2.3 多因素分析 以年龄、心率、MSCT评分、ALT、AST、总胆红素、直接胆红素、尿素氮、白细胞计数、血小板计数、中性粒细胞分数、淋巴细胞分数(赋值:均为连续变量)及气管插管(赋值:是=1,否=2)为自变量,患者转归(死亡=1,好转=2)为因变量纳入多因素Logistic回归方程,结果显示,MSCT评分、尿素氮及气管插管是重症COVID-19患者死亡的独立危险因素(P<0.05,见表2)。
3 讨论
2019 -nCoV属于β属的冠状病毒,其与蝙蝠严重急性呼吸征(SARS)样冠状病毒(bat-SLCoVZC45)同源性达85%以上[5],主要通过呼吸道飞沫传播和密切接触传播,传染性极强。多数患者主要临床症状表现为发热、乏力、干咳,少数患者表现为腹泻等消化道症状,严重者可快速进展至急性呼吸窘迫综合征、脓毒性休克及多器官功能衰竭[7]。尸检报告显示,2019-nCoV主要导致肺实变,肺泡腔内见浆液、纤维蛋白性渗出及透明膜形成[8],Ⅱ型肺泡上皮细胞明显增生,且肺内支气管腔内可见黏液及黏液栓形成[9]。

表1 死亡组和好转组患者临床资料比较Table 1 Comparison of clinical data between death group and survival group
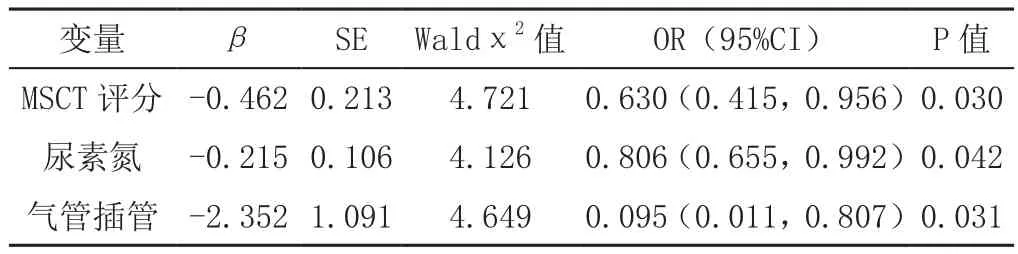
表2 重症COVID-19患者死亡影响因素的多因素Logistic回归分析Table 2 Multivariate Logistic regression analysis of influencing factors of death in patients with severe COVID-19
本研究结果显示,重症COVID-19患者中男性占比78.3%,且各年龄段均易感,其中50~69岁人群占比43.5%,为重症COVID-19主要人群;患者首发症状以咳嗽、发热最为多见,与相关研究结果相似[7]。另外,重症COVID-19患者ICU住院期间以低热为主,38 ℃以下者占65.2%(30/46);患者中性粒细胞分数升高37例(80.4%)、淋巴细胞分数下降42例(91.3%),提示COVID-19患者存在严重淋巴细胞分数降低,不同程度中性粒细胞分数升高,分析淋巴细胞分数降低可能因2019-nCoV作用于淋巴细胞[10]尤其是T淋巴细胞[11]所致,与相关研究结果一致[12];中性粒细胞分数升高可能与住院时间长、机体免疫系统受损、合并其他细菌或真菌感染有关。本研究中,多数患者伴有肺外其他器官功能损伤,主要为肾功能异常(56.7%)和心肌酶异常(52.2%),其次为凝血功能异常、肝功能异常,分析原因为:(1)2019-nCoV在体内诱发细胞因子风暴,导致多器官功能受损;(2)2019-nCoV以血管紧张素转换酶2(ACE2)为靶点导致多器官损伤[13-14],因ACE2同样广泛表达于心脏、肾脏、肝脏、小肠和睾丸等器官的血管内皮细胞[15]。另外,多数重症COVID-19患者红细胞沉降率加快,为44例(95.7%);C反应蛋白升高33例(71.7%),与患者全身炎性反应有关。需指出的是,尽管重症COVID-19患者白细胞计数处于较高水平,但PCT升高并不明显,本研究显示PCT升高13例,仅占28.3%,与相关研究结果相似[16],若患者出现PCT明显升高可能合并严重细菌感染。
本研究结果显示,死亡组患者年龄大于好转组,心率快于好转组,可能与高龄患者身体功能、免疫力下降,对缺氧耐受性下降有关。另外,死亡组患者白细胞计数、血小板计数、中性粒细胞分数高于好转组,淋巴细胞分数低于好转组,提示重症COVID-19患者免疫功能可能明显受损。常见的呼吸道病毒感染患者淋巴细胞分数正常或升高,白细胞计数正常或轻度升高,而2019-nCoV却相反,具体原因目前尚不明确。2019-nCoV与SARS冠状病毒(SARS-CoV)有同源或相似的基因和病毒结果,推测可能与免疫介导损伤、细胞凋亡有关[17]。本研究结果还显示,死亡组患者MSCT评分、ALT、AST、总胆红素、直接胆红素、尿素氮及气管插管率高于好转组,提示死亡患者器官功能损伤更为严重,故气管插管率明显升高。本研究经多因素Logistic回归分析结果显示,MSCT评分、尿素氮及气管插管是重症COVID-19患者死亡的独立危险因素。
气管插管是肺内氧合的间接反映,无创机械通气或高流量吸氧不能维持氧合者或呼吸衰竭者需行气管插管维持肺内氧合,因此气管插管患者病死率高,其肺部损伤较严重且非常难以逆转。肺部影像学改变与病情变化可能一致,国内有研究证实,CT可显示COVID-19肺部病灶的分布、密度、形态和范围,该研究在对肺炎早期、进展期、消散期肺部影像均有描述,与患者病情一致[18];另有研究表明,CT可反映病变进展程度,对评估患者预后有一定帮助[9]。本研究对CT影像进行粗略量化处理,结果显示,MSCT评分是重症COVID-19患者死亡的独立危险因素。本研究结果显示,尿素氮是重症COVID-19患者死亡的独立危险因素。在肺外器官损伤中,可能肾功能损伤对患者预后影响最大。但目前没有更多的研究证实肾功能损伤能反映预后,需要更大的样本量支持。
综上所述,重症COVID-19以中老年男性为主,临床症状以咳嗽、低热为主,且淋巴细胞分数较低,并伴有多器官功能损伤,且入院48 h内MSCT评分、尿素氮及气管插管是重症COVID-19患者死亡的独立危险因素;但本研究为单中心回顾性研究,存在一定局限性,结论还需进一步扩大样本量证实。
作者贡献:胡庆兵进行文章的构思与设计,论文的修订,负责文章的质量控制及审校,并对文章整体负责、监督管理;刘建雄进行研究的实施与可行性分析;李敏进行数据收集、整理、分析,结果分析与解释,撰写论文。
本文无利益冲突。
