经尿道植入导管建立感染性大鼠膀胱炎动物模型的实验研究
2020-06-21周恩谱黄进宝
钱 余,周恩谱,黄进宝,卢 涛
(1.上海市控江医院泌尿外科,上海 200093;2.上海中医药大学教学实验中心,上海 201203)
建立大鼠膀胱炎动物模型对研发各种生化药、中草药,对膀胱炎的治疗,并观察这些药物的潜在不良反应意义深远。本研究通过向雌性SD大鼠膀胱内植入异物+灌注大肠埃希菌液,制作感染性大鼠膀胱炎动物模型,现报告如下。
1 资料与方法
1.1材料及实验分组:雌性成年SD大鼠63只,个体质量(170±10)g,由上海中医药大学动物实验学部提供[动物生产许可证号为SCXK(沪)2009-0021],分笼饲养,自由饮水;随机分为三组,每组21只:实验组(膀胱内植入异物+大肠埃希菌1次灌注)、大肠埃希菌灌注组和生理盐水灌注组。各组大鼠实验开始时体重差异无统计学意义(P>0.05)。膀胱灌注用DH5α大肠杆菌溶液(108-9CFU/100 μl) 由湖南中医药大学第一附属医院检验科提供。
1.2动物模型制作:实验组大鼠腹腔注射2%戊巴比妥钠溶液(10%水合氯醛按0.3 ml/100 g)0.3~0.5 ml,麻醉后将大鼠固定,尿道口用70%乙醇和碘酊消毒,将直径1.4 mm的圆头软质金属导丝沾上无菌甘油后经尿道插入大鼠膀胱内,导丝另一端套上长6~8 mm、直径3 mm聚乙烯材料的导管,再套上推管,顺着导丝用推管把导管推入膀胱并留置,拔出导丝,排空膀胱内尿液,针筒吸入0.5 ml大肠杆菌溶液由推管注入膀胱后,拔出推管结束(见图1)。大肠埃希菌灌注组和生理盐水灌注组在同样的麻醉方法后,将无菌的连续硬膜外导管(PE50管)经尿道插入大鼠膀胱内;排空尿液后分别注入0.5 ml大肠杆菌溶液和0.5 ml生理盐水,间隔24 h后采用同样方法重复操作一次,共3次,相同条件,自由饲养。
1.3观察指标:12 d后处死大鼠,切开腹腔,取出膀胱并剪开,实验组观察异物导管是否残留(见图2),无菌棉拭子涂搽膀胱内壁作细菌培养,剪下部分膀胱组织,行苏木精-伊红染色(HE染色),做成病理切片,分别置于100 倍、200倍显微镜下观察膀胱黏膜固有层炎性细胞浸润情况,膀胱肌层是否有异常病理表现。
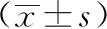

图1 实验组的造模步骤

图2 观察实验组膀胱内导管的情况
2 结果
2.1造模结束时大鼠体重与死亡率比较:实验结束时,各组大鼠无死亡发生,各组大鼠体重差异无统计学意义(P>0.05)。实验组有1例膀胱内导管自行排出。
2.2各组间常规病理切片比较:通过病理切片观察,实验组中18例出现感染性膀胱炎表现,可见黏膜明显水肿、增厚,黏膜及基质内可见大量单核炎症细胞浸润,有聚集成堆的现象,并可见毛细血管充血和出血(见图3);大肠埃希菌灌注组6例膀胱黏膜固有层有炎性细胞浸润,病变程度比实验组轻;生理盐水组除3例固有层有炎性细胞轻度浸润,其他膀胱黏膜上皮基本正常。实验组膀胱炎发生18例,与大肠埃希菌灌注组(6例)及生理盐水灌注组(3例)比较,差异有统计学意义(P<0.01)。见表1。
2.3各组间大肠埃希菌培养结果的比较:实验组膀胱内大肠埃希菌培养阳性16例,与大肠埃希菌灌注组(8例)及生理盐水灌注组(1例)比较,差异有统计学意义(P<0.01)。见表1。

图3 病理切片观察典型的感染性膀胱炎发病情况
表1 各组间大鼠膀胱炎发生情况及细菌培养结果比较[例(%)]

组别例数膀胱炎膀胱内涂片大肠埃希菌培养阳性实验组2118(85.7)16(76.2)大肠埃希菌灌注组216(28.6)①8(38.1)①生理盐水灌注组213(14.3)①1(4.8)①
注:与实验组比较,①P<0.001
3 讨论
目前国内外文献报道制作大鼠膀胱炎动物模型分为无菌性和感染性两种。常用的制作方法有腹腔注射、膀胱灌注及外科手术干预等,差别是药物作用于整体与局部的区别,各种方法所建的膀胱炎模型各有优缺点[1-2]。
腹腔注射方法通常用于制作无菌性膀胱炎动物模型。其操作简单,以环磷酰胺溶液每3天向腹腔注射1 次,建模成功率高,3 次给药后建模成功率为90%,但大鼠状态较差,建模后5 d死亡率可达80%,这与环磷酰胺对大鼠的全身毒性有关。腹腔注射经腹膜吸收,其代谢产物作用于膀胱及全身各器官,产生膀胱过度刺激,同时对其他器官也产生损害,可用于病理及膀胱动力病因学等方面的短期或离体研究[3-5]。
膀胱灌注法可以建立无菌性或感染膀胱炎模型,过程略复杂,常用的灌注剂有环磷酰胺、硫酸鱼精蛋白、大肠埃希菌等。麻醉后自大鼠尿道向膀胱内灌注药物,麻醉期间药物直接作用于膀胱组织,可使药物在膀胱滞留以维持较高药物浓度,对其他器官的影响少,但由于麻醉2~3 h后大鼠清醒自主排尿,排出大部分药物,导致建模成功率较低(约50%)[6-8]。
通过外科手术方式制作感染性膀胱炎模型一般有两种:①切开腹腔暴露膀胱,根据实验需要进一步切开膀胱或膀胱颈部缝合等,这种方式造模成功率100%,但术后5~7 d继发感染大鼠死亡率可达70%[9];②经尿道介入方式建立感染性膀胱炎模型,韩国 HeeYoun Kim等报道采取尿道置入橡皮片,用线缝合固定于阴道壁上,建立了尿道炎模型[10]。日本学者 Yuichi Kurosaka等将长2 cm螺旋状聚乙烯管经尿道植入大鼠膀胱中建立感染性膀胱炎模型[11],但实验中发现雌性大鼠尿道有2 cm长、直径细且螺旋状弯曲,植入操作非常困难且易损伤尿道,难以推广。
本组实验采取经尿道介入方法,在Yuichi Kurosaka等基础上进行改进,方法如下:通过大鼠腹腔注射2%戊巴比妥钠溶液 0.3~0.5 ml麻醉,将直径1.4 mm的圆头软质金属导丝沾上无菌甘油后经尿道插入大鼠膀胱内,导丝另一端套上长6~8 mm、直径2 mm聚乙烯材料的导管,再套上推管(直径3 mm),顺着导丝用推管把导管推入膀胱并留置,拔出导丝,排空膀胱内尿液,针筒吸入0.5 ml大肠杆菌溶液由推管注入膀胱后拔出推管,完成造模过程(见图1)。本实验21例雌性大鼠通过尿道向膀胱内植入导管,操作过程简单,造模后无大鼠死亡发生,术后12 d处死大鼠,病理切片检查发生膀胱炎18例,发生率达到85.7%,与大肠埃希菌灌注组成功6例及生理盐水灌注组成功3例比较,差异均有统计学意义(P<0.01);1例未发生膀胱炎是因为导管排出,另2例原因不详。分析发生感染性膀胱炎机理如下:经尿道注入的大肠杆菌黏附导管表面,形成一个持续感染灶——菌斑,由于导管在膀胱内活动刺激损伤膀胱黏膜,产生了感染性膀胱炎模型。
本实验造模时植入导管过程简便,只需大肠杆菌液一次注入就能达到较高的成功率,通过本实验,为批量制作提供了一种简单、可行性高的感染性膀胱炎动物模型的实验方法。
