应力超声技术确定中重度ARDS患者的最优右室充盈压
2020-06-19郑清江郑义春高艺宾何绍珍程小梅江文婷邱陆阵陈林丽
郑清江 郑义春 高艺宾 何绍珍 程小梅 江文婷 邱陆阵 陈林丽
(福建医科大学附属漳州市医院内科ICU,福建 漳州 363000)
肺内源性以及肺外源性的重症感染可以诱发机体的全身炎性反应,导致干扰素、肿瘤坏死因子、白细胞介绍、组胺等炎性因子瀑布样反应,进而出现肺部损伤,出现肺部的炎症浸润性病变,导致急性呼吸窘迫综合征(ARDS)的发生[1-2],是ICU中常见的重症疾病,也是导致死亡的重要原因之一。病因不同,ARDS发病率也不同,严重感染时ALI/ARDS发病率可高达25%~50%[3]。ARDS的病死率的报道差异较大,达15%~72%[4]。现阶段ARDS的治疗主要以小潮气量高PEEP机械通气、糖皮质激素应用、肺复张、俯卧位通气、体外膜肺等策略,重点强调恢复肺保护通气、改善氧合等治疗理念,往往忽略了右心功能受损的可能性及严重性。中重度ARDS病情危重,病死率高,本实验将CVP与RVFWS联合评价,以确定最优右心充盈压,将有利于协助临床医师指导容量复苏策略,最大限度保护右心功能,降低患者病死率。
1 资料与方法
1.1 一般资料:选择2017年9月至2020年2月福建省漳州市医院MICU的48例因各种原因导致中重度ARDS病例进行研究。患者给予有创机械通气,在俯卧位通气前测量数据152组,包括CVP、RVFWS、平均动脉压(MAP)、静动脉二氧化碳压差(GaPCO2)、深静脉氧饱和度(ScvO2)、氧合指数(PaO2/FiO2)、动脉血乳酸(LAC)指标。以LAC≤2 mmol/L为目标组,测量此时CVP值;当LAC>2 mmol/L,CVP小于目标组CVP时增加补液量,为补液组;LAC>2 mmol/L,CVP大于目标组CVP时减少补液量,为利尿组。研究经福建省漳州市医院伦理委员会批准执行(编号:20181×004)。纳入标准:年龄>18岁,由于疾病导致ARDS,根据2012年ARDS的柏林标准,选取PaO2/FiO2≤150 mm Hg患者,给予有创机械通气,且在俯卧位通气治疗前。排除标准:①PaO2/FiO2>150 mm Hg;②心源性肺水肿;③大量胸腔积液;④妊娠;⑤肺部肿瘤性病变。
表1 三组数据临床基本特征对比结果(±s)
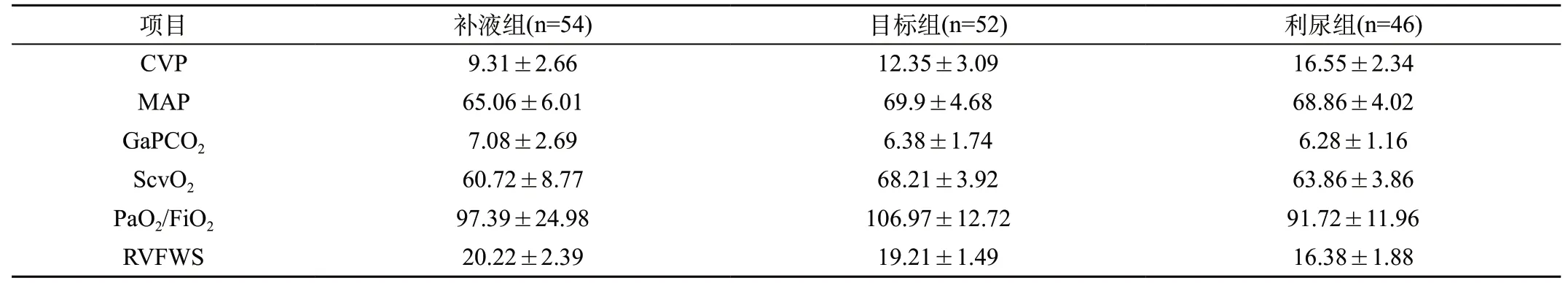
表1 三组数据临床基本特征对比结果(±s)

表2 三组CVP的两两秩和检验
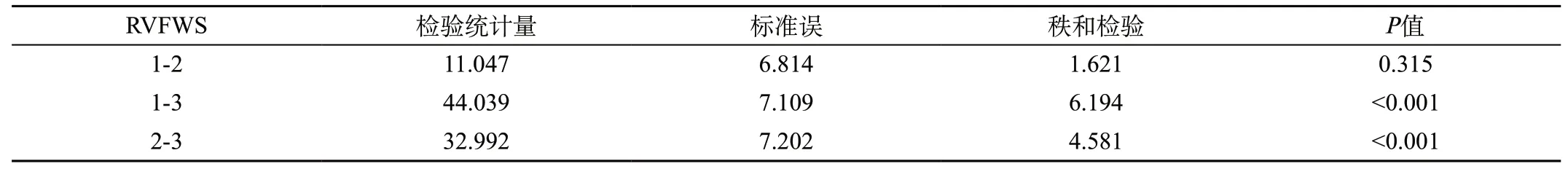
表3 三组RVFWS的两两秩和检验

表4 CVP、MAP、RVFWS及其联合评估的ROC曲线分析
1.2 床旁超声检查方法:在超声科专业医师指导下,由具有重症超声培训合格证的熟练的研究人员对研究对象行床旁心脏超声监测,并行RVFWS测定。检查中及检查后,注意患者伤口污染及探头消毒。利用床旁超声机西门子OXANA1进行检测,利用2~5 MHz心脏探头,患者取左侧卧位(因病情危重无法左侧卧位者取仰卧位),床头抬高30°~45°,获取右室游离壁应力数据。见图1。

图1 中-重度ARDS患者RVFWS进行检测的例图,左图RVFWS:-32%,右图RVFWS:-16%,右心功能较左侧差(正常值约-20%)
1.4 统计学方法:采用SPSS 20.0软件,计数资料(n/%)和计量资料(±s)分别行卡方和t检验,GraphPad Prism 5绘制组间变量散点图及折线图,Medcal软件绘制ROC曲线,P<0.05为差异具有统计学意义。
2 结果
2.1 临床特征分析
2.1.1 基本特征对比:本实验总48例研究对象,收集数据152组。包括男性患者29例,女性19例;平均年龄(68.76±11.86)岁;APACHE-II评分 27.68±1.63分;肺源性ARDS 18例,肺外性ARDS 14例。以LAC≤2 mmol/L为目标组,计算此时CVP;当LAC>2 mmol/L,CVP小于目标组CVP值时增加补液量,为补液组;当LAC>2 mmol/L,CVP大于目标组CVP值时增加补液量,为利尿组。对三组患者的临床数据进行分析,计算各组的均值与标准差。见表1。
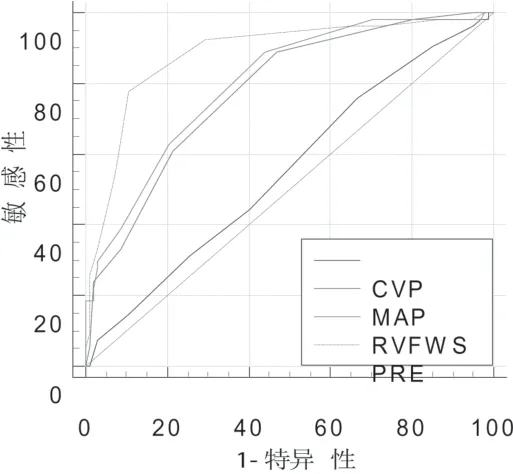
图2 CVP、MAP、RVFWS及其联合评估的ROC曲线
2.1.2 三组间CVP、RVFWS的两两秩和检验:三组的CVP均值两两比较,1组(补液组)、2组(目标组)与3组(利尿组)比较均存在统计学差异(P<0.05)。三组RVFWS的均值两两比较,1组、2组与3组比较均存在统计学差异(P<0.05),1组与2组比较无统计学差异(P>0.05)。见表2、表3。
2.2 CVP、MAP与LAC的相关性分析:传统指标CVP与LAC的相关性较差(Y=-0.1608X+12.88,R2=0.0595),CVP与LAC的相关性较差(Y=-3.764X+77.43,R2=0.1758)。
2.3 CVP、MAP、RVFWS及CVP+RVFWS的联合评估ROC曲线:CVP的cut-off值为≥14 mm Hg,MAP的cut-off值为≥67 mm Hg,RVFWS的cut-off值为>-18%。见图2、表4、表5。
3 讨 论
ARDS是肺间质水肿,导致肺泡内外血管通透性增加、痉挛,增加肺循环阻力,进而导致组织缺氧、酸中毒,并容易出现急性肺动脉高压,导致急性右心衰竭[5]。重症感染往往合并脓毒性休克,需要进行容量复苏,增加右心容量负荷。当不恰当的容量复苏,加之缺氧、酸中毒等综合因素作用下,将导致急性右心衰竭,影响全身血流动力学稳定性,加重治疗难度,显著增加死亡风险[6]。

表5 CVP、MAP、RVFWS及CVP+RVFWS联合评价的对比
因此,如何及时、准确的评估患者最佳的右心前负荷至关重要。目前准确评估右心容量负荷的技术很少,包括CVP、PAWP、RVEDV,这些参数均无法精确评估;而放射性核素扫描作为评估右心容量的金标准因技术复杂、不能床边进行,大大限制了危重患者的适用性。随着重症医学的床旁超声的发展,根据重症超声操作规范,使得重症患者的床旁超声检查更加规范。床旁超声检查具有无创、动态、实时等特点,为临床医师提供了多种客观指标,同时不增加患者的创伤及感染等风险。近年来兴起的右心室应力/应变的技术来评估右心功能及肺动脉压不断得到证实[7],但针对中重度ARDS患者右心功能评估的研究仍很少。因此本研究旨在通过超声应力技术针对右心室游离壁(RVFWS)的检查,确定最优的右心充盈压,进而保护重症患者的右心功能,提高抢救成功率。在中重度ARDS患者中,由于氧合指数改变、高PEEP应用、血流动力学不稳定、肺动脉压力升高、右心室受累等多种因素的影响,传统监测指标,如CVP、MAP与组织低灌注指标(如LAC等)相关性差;需要联合更多指标进行参考,以确定最佳的右室充盈压及右心室功能。
三组RVFWS的均值两两比较,1组、2组与3组比较均存在统计学差异,1组与2组比较无统计学差异。结果提示:右心室前负荷偏低或正常时,右室心肌游离壁应力受容量负荷影响较小,处于正常水平;当右心室前负荷增加时,右室心肌游离壁应力下降,右心室收缩力下降。
分析ROC曲线提示CVP≥14 mm Hg,可能由于保护性肺通气策略的应用,由于高PEEP对胸腔内压的影响,导致CVP的截断值较正常值偏高;RVFWS的截断值为≥-18%,较正常均值偏低,考虑与疾病重症状态,右心功能损伤因素多,较正常人更容易出现右心功能不全;将CVP与RVFWS联合评价,当CVP≥14 mm Hg且RVFWS≥-18%时,AUC值0.84,特异性为88.4%,较CVP或RVFWS单一指标评估右心功能更有特异性,两两比较具有显著统计学差异。
本研究通过评估中重度ARDS患者的严重程度,将右心功能的评估同时纳入ARDS治疗中,确立改善氧合的同时,保护右心功能同等重要为理念。结合国外的研究成果[8],并通过细化中、重度ARDS的不同严重程度的右心功能,确定最佳的CVP,使干预措施更能有的放矢,以期引起临床医师的重视及有利于ARDS患者更优化、个体化的治疗。
本研究的不足在于病例数偏少,无法对肺源性ARDS与肺外性ARDS进行分组比较;且CVP值、RVFWS仅有下限的截断值,根据第3组的统计学数据,估测CVP下限为≥14 mm Hg,上限为(16.55±2.34)mm Hg,待其他更多试验进行证实,并求得两个指标的上限截断值,为临床治疗中提供更好的参考数据。
