83例淋巴结阴性直肠神经内分泌肿瘤的临床病理特征*
2020-06-19韩登苏雯婷李靖涛王超祁志荣罗杰谭煌英
韩登① 苏雯婷① 李靖涛③ 王超 祁志荣 罗杰④ 谭煌英
直肠神经内分泌肿瘤(rectal neuroendocrine neoplasms,R-NENs)是一类起源于肠道神经内分泌细胞的少见肿瘤,多为无功能性,缺乏特异性临床表现;少部分为功能性,肿瘤可分泌活性激素并引起特异性临床表现(如类癌综合征)。近几十年,R-NENs发病率及患病率逐年上升。根据美国SEER数据,R-NENs的发病率为1.10/10万例,患病率从1993年的1/10万例升至2012年的14/10万例[1]。来自亚太地区的数据显示,直肠是消化系统神经内分泌肿瘤中最常见的发病部位,分化良好的早期患者占绝大多数[2-5]。目前国内针对淋巴结阴性R-NENs的临床病理特征认识不足,本文总结2012年12月至2019年12月中日友好医院近8年淋巴结阴性R-NENs患者的临床病理资料,报道如下。
1 材料与方法
1.1 临床资料
回顾性分析2012年12月至2019年12月间中日友好医院就诊的R-NENs地共314例,选择标准为分化良好的R-NENs、患者均通过行超声内镜(EUS)/腹盆CT/核磁或全身奥曲肽扫描等检查、未发现肿瘤周围有异常淋巴结、以及外科治疗后病理提示未见肠周淋巴结转移、临床病理资料完整,共83例患者为研究对象。分析患者的性别、首诊年龄、就诊原因及肿瘤的部位、数目、大小、浸润深度、病理分级、临床分期、治疗方式等,并采用电话、门诊复查、住院等方式对患者进行随访,对所采集的数据行统计学分析。
1.2 病理分级及分期标准
本研究病理分级标准采用2010年世界卫生组织(WHO)对胃肠胰神经内分泌肿瘤的分类分级标准[6],将其分为3 类。1)NET(neuroendocrine tumor):分化良好的神经内分泌肿瘤(G1、G2);2)NEC(neuroendocrine carcinoma):分化差的神经内分泌癌(G3);3)MANEC(mixed adenoneuroendocrine carcinoma):混合性腺神经内分泌癌(G3)。临床分期采用AJCC TNM分期系统(第7版)[7]。
1.3 统计学分析
数据分析使用SPSS 25.0 软件进行统计学分析。计量资料以()表示,计量资料、等级资料、计数资料之间的相关性采用Spearman 等级相关分析,采用Kaplan-Meier 法进行R-NENs 的预后生存状况分析,生存分析终点为复发。以P<0.05为差异具有统计学意义。
2 结果
2.1 患者基本资料
83 例无淋巴结转移的R-NENs 患者中,男性49例(59.0%)、女性34例(41.0%),男女比例约为1.4:1;年龄22~80岁,平均年龄(43.3±11.4)岁;男性与女性年龄之间无显著性差异。61 例(73.5%)出现消化道非特异性症状(腹胀、腹痛、腹泻、便秘、便血、皮肤潮红等),20 例(24.1%)因体检发现肿瘤,2 例(2.4%)因便血行痔疮切除术意外发现(表1)。
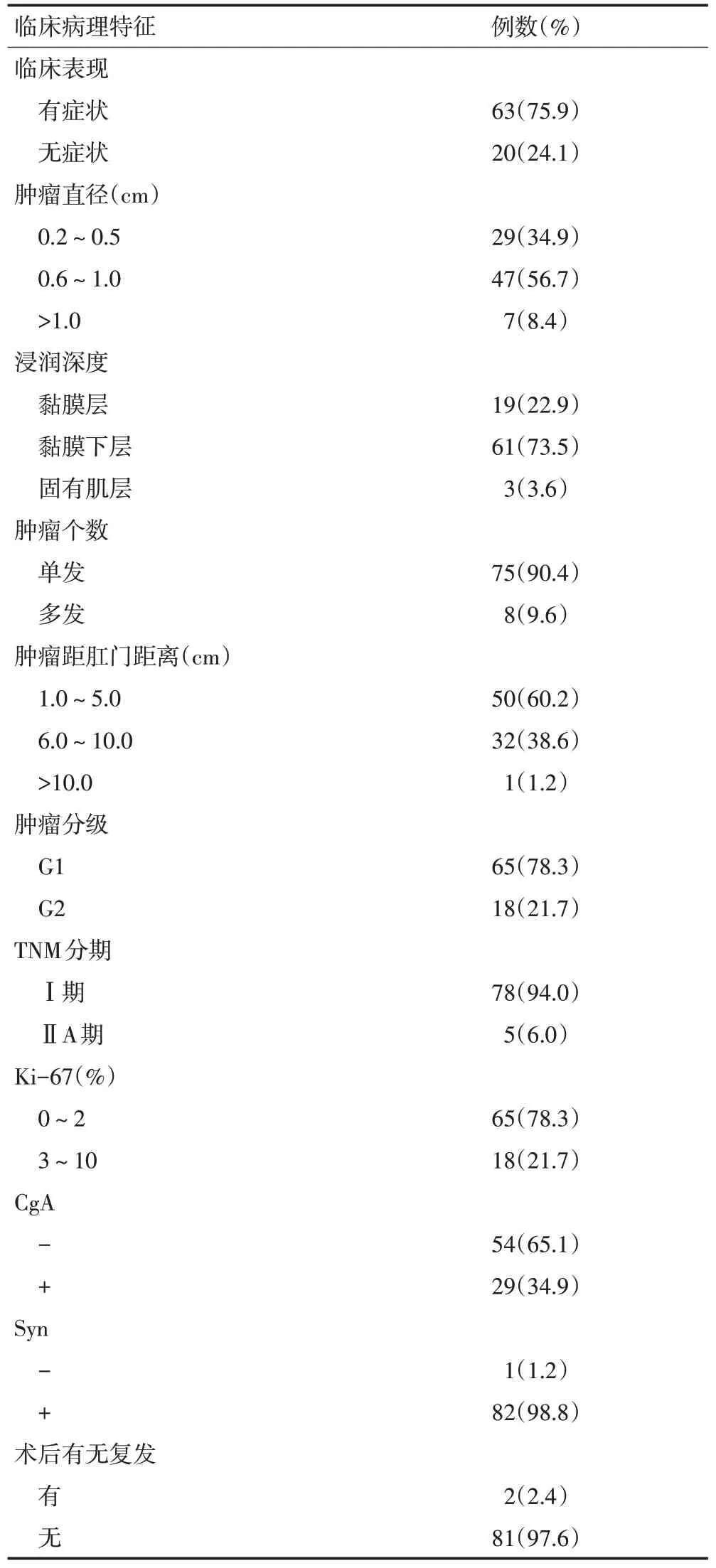
表1 83例淋巴结阴性R-NENs患者临床病理特征
2.2 肿瘤特点分析
内镜下肿瘤发病数目多以单发为主,单枚75 例(90.4%),少数为多发;肿瘤距肛缘范围1.0~15.0 cm,平均距离(5.7±2.6)cm,距肛缘<5.0 cm 50例(60.2%),6.0~10.0 cm 32例(38.6%),>10.0 cm 1例(1.2%);肿瘤直径0.2~5.5 cm,直径≤1.0 cm 76例(91.6%);肿瘤浸润黏膜层及黏膜下层80例(96.4%),浸润固有肌层3例(3.6%,表1,图1)。Spearman等级相关分析提示肿瘤大小与浸润深度具有显著相关性(P=0.030),肿瘤直径越大,浸润深度可能越深。
2.3 病理分级及肿瘤分期
83 例诊断为分化良好的R-NENs,G1 患者65 例(78.3%),G2患者18例(21.7%),Ki-67指数平均值为(2.1±1.7)%;免疫组织化学法检测CgA 阳性29 例(34.9%),阴性54例(65.1%,图2)。
采用Kaplan-Meier 生存法分析得出肿瘤分级G1与G2 差异具有统计学意义(P=0.001),G1 患者预后复发情况好于G2(图3)。Spearman 等级相关分析提示Ki-67 阳性指数与肿瘤浸润深度具有相关性(P=0.032),Ki-67 指数越高,肿瘤浸润深度可能越深;肿瘤分级与肿瘤直径具有显著相关性(P=0.012),肿瘤分级越高,肿瘤直径可能越大。
本研究83例患者中,肿瘤分期Ⅰ期78例(94.0%),ⅡA 期5 例(6.0%),Spearman 等级相关分析提示肿瘤分期与肿瘤数目、术后复发具有显著相关性(P=0.020,P=0.008)。
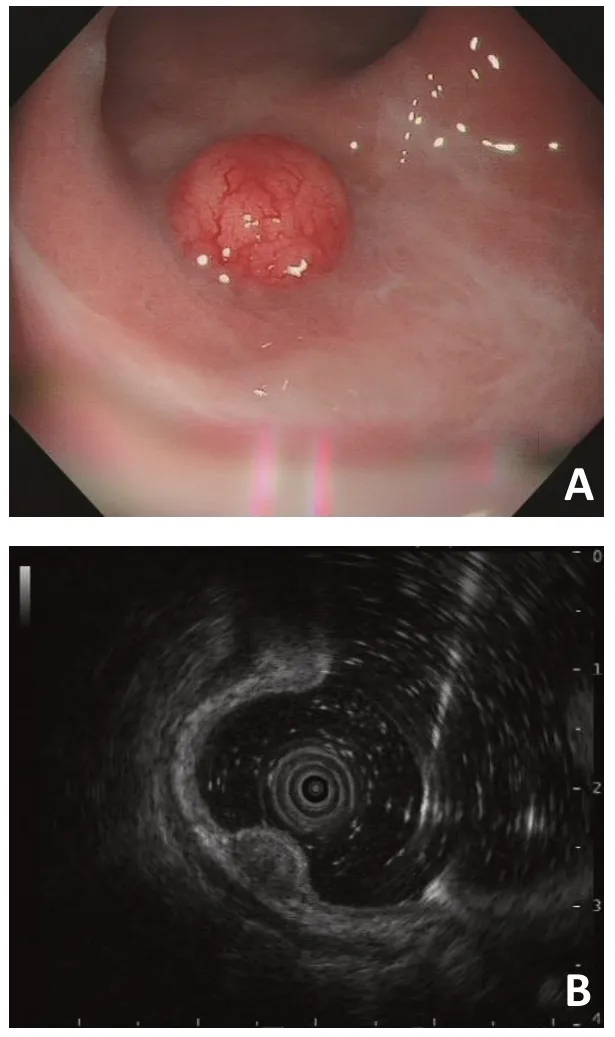
图1 R-NENs超声内镜下表现
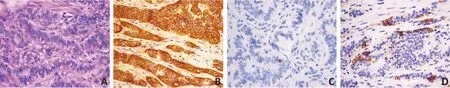
图2 R-NENs的病理学特征
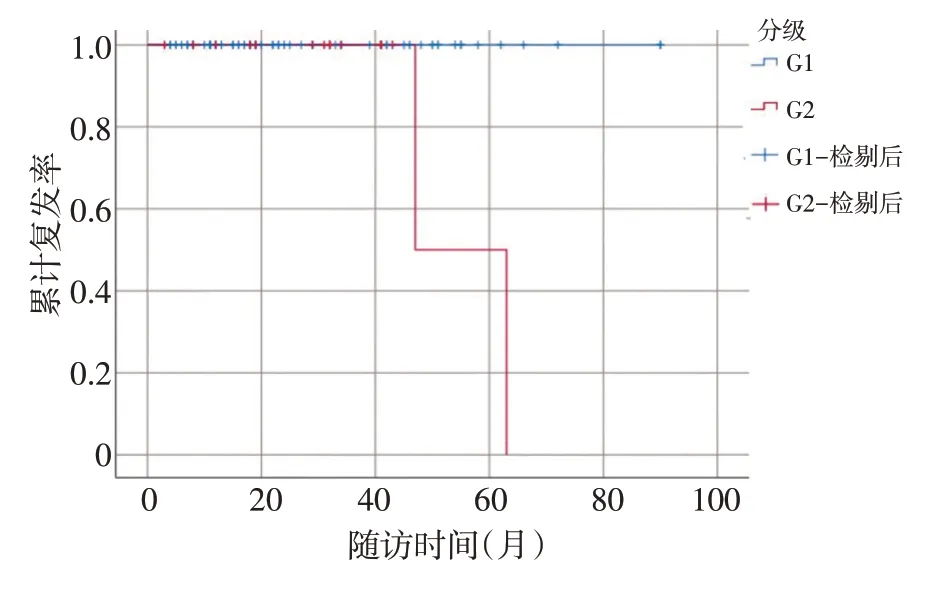
图3 WHO肿瘤病理分级相关生存曲线
2.4 治疗方式
本研究83 例淋巴结阴性R-NENs 患者中,67 例(80.7%)接受内镜下治疗(EMR/ESD),16 例(19.3%)接受手术切除。接受内镜治疗的患者肿瘤直径平均为(0.7±0.3)cm,Ki-67指数平均为(1.9±1.4)%,2例肿瘤浸及固有肌层;接受手术治疗患者平均肿瘤直径(1.3±1.4)cm,Ki-67平均指数为(2.9±2.5)%,1例肿瘤浸及固有肌层。采用Kaplan-Meier 法分析得出内镜下治疗与手术治疗的手术方式比较,差异具有统计学意义(P=0.031,图4)。
2.5 预后分析
随访时间3~90 个月,平均随访时间(30.3±19.8)个月,中位随访时间24个月,5年生存率100%。83例患者中2例复发(2.4%),肿瘤直径分别为5.5、0.8 cm,浸润深度为固有肌层、黏膜下层,Ki-67 阳性指数分别为6%、4%,分级均为G2,临床分期分别为ⅡA 期、Ⅰ期。本研究中83例淋巴结阴性R-NENs 术后复发率较低,预后较好(图5),Spearman 等级相关分析提示肿瘤复发与Ki-67 阳性指数具有显著相关性(P=0.025),Ki-67指数越高,术后越可能复发。
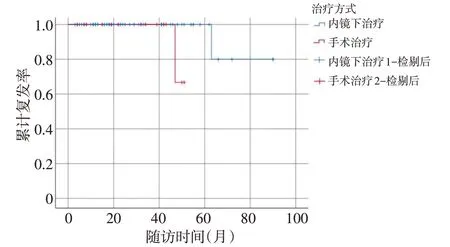
图4 治疗方式相关生存曲线
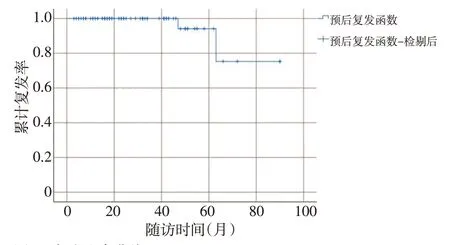
图5 复发生存曲线
3 讨论
R-NENs虽为罕见肿瘤,但发病率呈显著上升趋势,主要原因是结直肠镜的广泛普及使更多的R-NENs在早期即被发现[8]。在R-NENs中,早期分化良好的占绝大多数。黄玉庭等[9]研究5 437例R-NENs患者,肿瘤TNM分期Ⅰ期为79.2%、Ⅱ期为7.5%。本研究83例淋巴结阴性R-NENs患者中,发病年龄多集中在中年,男性多于女性,肿瘤直径大多数≤1.0 cm,浸润深度以黏膜层及黏膜下层为主,距肛缘多数<8.0 cm,多位于直肠下段,肿瘤分级多为G1,TNM分期多数为Ⅰ期。从淋巴结阴性R-NENs的性别、年龄、内镜下表现、分级、分期来看,与国内外大多数报道相比大体一致[9-11]。
R-NENs 发展缓慢,往往在未发生转移时被发现,转移率较低。发生淋巴结转移和远处转移的概率分别为5%、1%[12]。Sohn等[13]发现肿瘤直径及肿瘤病理学分级与淋巴结的转移相关,当肿瘤直径>2.0 cm时,淋巴结转移的概率约60%~80%,而直径<1.0 cm的直肠NENs 仅3%发生淋巴结转移,淋巴结转移的重要危险因素是肿瘤直径>2.0 cm(P=0.003)和病理分级G2,G3,(P=0.001,P=0.008)。本研究中2 例患者肿瘤直径>2.0 cm,其中1例肿瘤直径4.0 cm,Ki-67指数为5%,另1 例患者肿瘤直径5.5 cm,Ki-67 指数为6%。有报道[14]98 例R-NENs 中,G1 为86 例,其中2例转移;G2为8例,其中6例转移;G3为4例,全部转移。Motohiro 等[15]研究显示,200 例R-NENs 中,淋巴结阳性53例,肿瘤平均直径为(1.25±0.35)cm;淋巴结阴性147例,肿瘤平均直径为(0.85±0.38)cm。本研究83例淋巴结阴性R-NENs患者肿瘤平均直径为(0.8±0.7)cm,说明大多无淋巴结转移的肿瘤直径<1.0 cm,G1 为主;当肿瘤直径较大,同时病理分级较高时,肿瘤转移的风险极大,在临床中发现此类患者,应高度警惕,及时行CT或奥曲肽扫描等检测,评估肿瘤是否转移。
EUS对于R-NENs的诊治意义重大,其可以通过对肿瘤起源层次、大小、回声特点等对肿瘤分期评估。欧洲神经内分泌肿瘤学会(ENETS)指南建议使用EUS 评估肿瘤大小、浸润深度、淋巴结受累等[16]。有报道38例R-NENs,平均大小为0.79 cm,通过EUS检查,37 例患者肿瘤浸润为黏膜层或黏膜下层,仅1例浸及固有肌层[17]。本研究83 例淋巴结阴性患者中,肿瘤浸润深度以黏膜及黏膜下层为主,共80 例(96.4%),固有肌层3例(3.6%),浸及固有肌层的3例患者肿瘤直径分别为0.8、1.0、5.5 cm,肿瘤直径与浸润深度呈正相关,直径超过1.0 cm,更容易浸润固有肌层。值得一提的是少数肿瘤直径也可能浸及固有肌层。因此,对于R-NENs 患者建议进行EUS 评估,以决定正确的治疗方式。
对于无淋巴结转移R-NENs 的治疗方法取决于肿瘤直径、浸润深度,选择内镜下切除或手术切除,术后少数发生复发或转移。有研究报道对于肿瘤直径>1 cm,淋巴结转移率较高,建议早期进行淋巴结清扫术[18]。目前美国国立综合癌症网络(NCCN)指南指出,对于直径<1 cm 的R-NENs,因其转移风险低,建议内镜下切除,对于肿瘤直径1~2 cm且浸润黏膜下层以内的建议内镜下切除;肿瘤直径>2 cm,或浸润固有肌层的应行外科手术[19-20]。Joon 等[21]对66 例淋巴结阴性R-NENs患者均通过内镜下切除,术后均未见复发或转移。Sung等[22]对77例淋巴结阴性R-NENs 患者均通过内镜下治疗,仅1 例复发。本研究83例R-NENs 患者中,67 例(80.7%)选择内镜下切除,16 例(19.3%)行手术切除。其中2 例复发(1 例内镜下治疗,1例手术切除),肿瘤分级均为G2。采用Kaplan-Meier法分析得出,对于预后复发患者接受内镜下治疗好于外科手术,原因可能与接受手术的患者肿瘤直径更大,Ki-67指数更高有关。由于本研究病例较少,仍需要更大的样本统计证明两种治疗方式的优劣势。
淋巴结阴性R-NENs生存率高,生存期较长。有报道R-NENs 生存率高至95%[3]。本研究对83 例早期R-NENs 进行随访,随访时间3~90个月,平均随访时间(30.3±19.8)个月,中位随访时间24 个月,5年生存率100%。本研究的患者生存期与国内外报道大体一致[1,9]。
总之,R-NENs中早期分化良好的占绝大多数,无淋巴结转移。虽然肿瘤恶度性较低,但规范化诊治尤为重要。应认识到EUS检查对于淋巴结阴性R-NENs的重要性,肿瘤直径≤1.0 cm,少数患者肿瘤也会浸及固有肌层,因此建议患者早期行EUS检查,评估肿瘤的状况,以决定正确的治疗方式。内镜下治疗为淋巴结阴性R-NENs的主要治疗方式,而对于肿瘤浸及固有肌层的,建议患者行外科手术。多数患者预后良好未复发,但是对于肿瘤直径>2.0 cm并且Ki-67指数较高的患者,其转移或复发的概率相对较大,应密切随访。
