基于质谱的高通量蛋白质组学技术探索肿瘤蛋白标志物的研究进展*
2020-06-19
癌症是全球人类死亡的主要原因之一,占总死亡人数的21%,位居发达国家第2位死因[1]。2012年全球新发肿瘤病例达1 410 万例,预计2030年将增至2 360 万例[1-2]。为了确定肿瘤早期诊断和预测治疗反应的生物标志物,同时制定精准特异的治疗策略,基因组和转录组的研究取得显著进展。尽管如此,大多数癌症患者的长期生存率仍然较低,精准诊断和治疗依然是临床工作者的主要挑战。根据中心法则,蛋白质是生物体生命活动的主要执行者和体现者。近年基于质谱(mass spectrometry,MS)的高通量和高精度蛋白质组学技术的飞速发展使得蛋白质组学在肿瘤研究中得到广泛应用[3-4],主要包括揭示肿瘤发生发展机制、寻找特异性生物标志物、阐明耐药性产生机制和发现新治疗靶点等。生物标志物在肿瘤早期发现、诊断、治疗及预后评估等方面发挥着重要作用。因此,本文将重点综述近年基于质谱的高通量蛋白质组学技术在探索肿瘤特异性蛋白质生物标志物中的研究进展,为肿瘤诊断、治疗提供新思路。
1 常用蛋白质组学定量技术和标本类型
蛋白质组学可以系统全面地研究不同时期和不同条件下细胞内发生的蛋白质变化,具有重要的理论和应用价值。近年来,蛋白质组学研究取得快速进展,其得益于MS 技术的快速发展。目前,常用的蛋白质组学定量技术主要分为非靶向相对定量和靶向绝对定量。在非靶向相对定量中,根据是否进行标记,又分为非标记定量和标记定量技术。常用的非标记定量技术主要包括Lable-free 定量技术和DIA/SWATH(data-independent acquisition/sequential window acquisition of all theoretical mass spectra),标记定量技术主要为同位素标记相对和绝对定量/串联质量标记(isobaric tags for relative and absolute quantification/tandem mass tags,iTRAQ/TMT)技术、同位素亲和标签(isotope-coded affinity tag,ICAT)和稳定同位素标记细胞培养(stable isotope labeling with amino acids in cell culture,SILAC)技术[5-7]。另外,靶向绝对定量技术则主要包括质谱多反应监测/选择反应监测(multiple reaction monitoring/selected reaction monitoring,MRM/SRM)技术、平行反应监测(parallel reaction monitoring,PRM)技术等[5]。不同定量技术的优势、局限性及特定的适用范围如图1所示,在实际应用中应根据具体研究项目加以选择。此外,新近研发的基质辅助激光解吸电离成像技术(MALDI-imaging)将MS 获得的数据与显微技术联系起来,是组织蛋白质组学中的重要工具[8]。
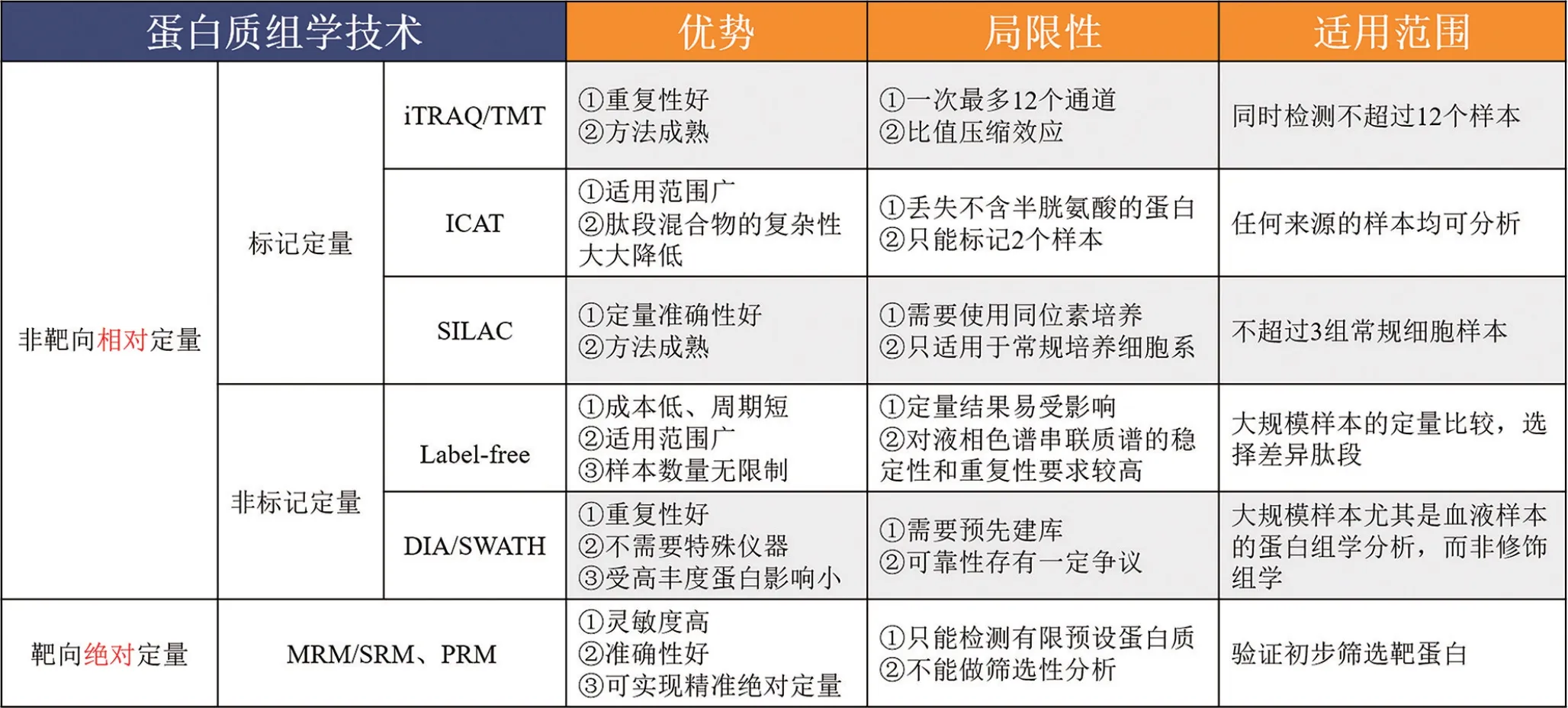
图1 常用定量蛋白质组学技术及优缺点
考虑肿瘤生物标志物的临床实用性和可行性,相关研究主要采用容易获得的标本类型,主要包括血液标本、组织标本、细胞标本和尿液标本等,不同标本类型具有各自优缺点。1)血液标本:创伤小,易收集,成本低,可短时间内重复检测,是首选的标本类型;但血液蛋白成分复杂,个体差异较大,且储存运输困难等问题是其不可忽视的局限性。2)肿瘤组织标本:可通过手术或常规活检获得,蛋白丰度较高,是最直接最准确的标本类型。但标本收集过程中往往创伤较大,成本较高。3)细胞标本:样本新鲜,可研究疾病类型广泛,均一性较好;同时,其存在研究成本较高,获取时间较长等问题。4)尿液标本:以其完全无创、可连续收集、标本容量充足、成本低等优点逐渐受到学者的关注。但其也存在一些局限性,如蛋白浓度低、稳定性差、标本中蛋白浓度易受多种因素影响等。除此之外,针对不同肿瘤的特殊性,其他体液标本正在成为方便无创的可能来源,如各种消化液(胰液、胃液、唾液等)、乳头溢液、痰液、泪液、汗液、脑脊液、关节腔液、精液、粪便、肿瘤间质液等。
2 高通量蛋白质组学技术在探索肿瘤蛋白质标志物中的应用进展
目前,基于MS 的高通量蛋白质组学在多种肿瘤标志物研究中得到广泛应用。其中肺癌、乳腺癌、结直肠癌、肝癌多高发,且恶性程度高,因而受到广泛关注。本文选取发表期刊影响因子较高,研究样本量大、扩大样本量验证或功能验证的文献进行总结,分别从早期诊断、预测预后、化疗耐药等方面阐述蛋白质组学在探索蛋白标志物方面取得的最新进展,进而为实现肿瘤精准诊疗提供新的思路和依据。
2.1 肺癌
肺癌(lung cancer,LC)是发病率最高的呼吸系统恶性肿瘤,也是死亡率最高的恶性肿瘤[9]。多数LC患者在诊断时已发生转移,目前的治疗手段不足以降低肺癌死亡率。基于高通量的蛋白质组学技术可以发现新的肺癌生物标志物,可能是改善现有诊断和治疗状况的重要策略。
2.1.1 早期诊断 Dai 等[10]基于液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LCMS/MS)技术对非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的血清标本进行分析发现,当ENO1(alphaenolase 1)与CEA和CYFRA 21-1联合时,对NSCLC诊断的敏感性可从35.1%提高至84.0%。血清标本中,蛋白质PON1(paraoxonase/arylesterase 1)和AACT(alpha-1-antichymotrypsin)联合检测对早期NSCLC的诊断敏感度为94.4%,特异度为90.2%[11]。另外,Bohnenberger等[12]首次发现了可以区分原发性肺鳞癌和头颈部鳞癌肺转移癌的蛋白质标志物组合,为来源不明的肺鳞癌诊断提供可靠依据。
2.1.2 预测预后 通过对比分析16对NSCLC和癌旁标本的蛋白质组学研究发现,蛋白质CALR(calreticulin)和PDIA3(protein disulfide isomerase family A member 3)的低表达与肺癌患者较差的生存预后呈正相关,提示CALR联合PDIA3使用可能是一种有效的生物标志物,可显著提高对NSCLC 预后的预测效能(P=0.023)[13]。
2.1.3 化疗耐药 Bottger 等[14]选取6 种对顺铂具有不同IC50的NSCLC细胞系,比较分析各细胞系间分泌蛋白质组,304个蛋白质在顺铂敏感和不敏感细胞系之间有显著性差异。进一步在肺癌患者痰液中检测发现,UGGT1(UDP-glucose glycoprotein glucosyltransferase 1)、COL6A1[collagen alpha-1(VI)chain]和MAP4(microtubule associated protein 4)3 种蛋白质组合可以较好地预测患者对顺铂的耐药情况,可作为指导治疗的非侵入性生物标志物。
2.1.4 治疗靶点 基于LC/MS-MS分析,Sung等[15]发现与邻近正常组织相比,肺癌组织中QSOX1(quiescin sulfhydryl oxidase)蛋白表达水平明显增高。进一步研究发现,敲除QSOX1的Lewis肺癌细胞在氧化应激下存活能力、迁移和侵袭能力降低。此外,在小鼠模型中也证明了QSOX1 具有促进肿瘤转移的作用。这表明QSOX1可能是肺癌组织衍生的生物标志物,其参与肺癌的发生发展,可作为肺癌的潜在治疗靶点。
2.2 乳腺癌
乳腺癌(breast cancer,BC)是全球女性癌症相关死亡的主要原因[9]。癌灶远处转移和药物耐药性是目前临床治疗的主要挑战[16]。探索乳腺癌蛋白质组学水平的生物标志物有助于患者的精准诊疗。
2.2.1 早期诊断 基于高通量蛋白质组学技术,Tyanova 等[17]分析了40 例雌激素受体阳性(Luminal 型)乳腺癌、HER-2 阳性乳腺癌和三阴性乳腺癌(triplenegative breast cancer,TNBC)的组织标本,蛋白定量深度>10 000,分析发现19种蛋白质组合可以很好地区分3种亚型,进而针对不同亚型提供特异性治疗方案。另外,有研究[18]表明,OLFM4(human olfactomedin-4)在乳腺癌组织和乳腺癌血清中的表达水平均显著增高,血清OLFM4 在区分BC 与健康对照组时AUC值为0.80(95%CI:0.76~0.84),在区分乳管原位癌与健康对照组时AUC 可达0.87(95%CI:0.81~0.93),其可能是提高现有BC筛查手段敏感性的潜在蛋白标志物。
2.2.2 预测预后 基于对44例TNBC原发肿瘤和10例相应转移瘤组织的蛋白组学研究,有研究[19]发现CYPOR(cytochrome P450 reductase)蛋白高表达是TNBC患者较短无复发生存期的独立预后标志物(P=0.032,HR=2.19,95%CI:1.07~4.47)。类似在组织标本中,Zeng等[20]检测了23例BC患者淋巴结转移灶与其配对原发肿瘤组织的差异表达蛋白发现,EpCAM(epithelial cell adhesion molecule)和αB-crystallin(alpha-crystallin B chain)蛋白的表达水平显著影响乳腺癌淋巴结转移及预后。另外,有研究[21-22]发现,早期乳腺癌组织中,CAPG(macrophage-capping protein)、GIPC1(PDZ domaincontaining protein GIPC1)和DOCK4(dedicator of cytokinesis protein 4)高表达与晚期肿瘤骨转移显著相关,同时,这3种蛋白高表达提示该患者可能对唑来膦酸的治疗更为敏感。
2.2.3 化疗耐药 乳腺癌患者血液标本中的定量蛋白质组学结果显示,蛋白质MUC1(mucin-1)可能是监测乳腺癌EGFR 靶向治疗效果的“效应传感器”[23]。另外,针对雌激素受体阳性乳腺癌患者,FoxO3a(forkhead box class O3a factor)可以间接预测是否对他莫昔芬耐药,并且是内分泌治疗耐药型乳腺癌的新靶点[24]。
2.3 结直肠癌
结直肠癌(colorectal cancer,CRC)是最常见的消化系统肿瘤,位居成年人高发癌症的第3 位[9,25]。鉴于其高发病率和高死亡率,利用基于质谱的蛋白质组学技术对潜在生物标志物进行探索,以期改善肿瘤的早期诊断和治疗。
2.3.1 早期诊断 Yu等[26]采用基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOFMS)技术对127 例CRC 患者和90 例健康对照组的血清标本进行分析,鉴定出候选蛋白标志物MST1(serine/threonine kinase 4),其联合CEA 和粪便潜血试验诊断CRC的敏感性和特异性高达92.3%和100%。类似血清标本中SETD7(SET domain containing lysine methyltransferase 7)也对CRC 具有很高的诊断价值(AUC=0.947 7),敏感度和特异度分别为92.17%和81.08%,进一步的功能实验证实SETD7 缺失可抑制癌细胞增殖和诱导癌细胞凋亡,提示SETD7 与肿瘤发生发展密切相关[27]。因单一标志物诊断效能较为有限,Bhardwaj 等[28]提出1 个可以用于检测CRC 的5种蛋白标志物组合,包括MASP1(mannan-binding lectin serine protease 1)、OPN(osteopontin)、PON3(serum paraoxonase lactonase 3)、TR(transferrin receptor protein 1)、AREG(amphiregulin),其在诊断任意阶段CRC 时AUC 为0.82(95%CI:0.74~0.89)。若进一步区分,其对早期CRC的诊断优于晚期CRC,AUC分别为0.86(95%CI:0.77~0.92)和0.76(95%CI:0.64~0.86)。上述研究均为实现CRC的早期诊断提供重要的参考依据。
2.3.2 预测预后 Mori 等[29]利用iTRAQ 标记蛋白质组学寻找CRC 淋巴结转移的预测因子,多因素分析表明大肠癌组织中高表达的Ezrin 蛋白是CRC 伴淋巴结转移的独立预测因素。Mori 等[30]还提出HSP47(heat shock protein 47)与CRC 进展和预后不良密切相关。另有研究[31]发现,肿瘤细胞中高表达的HLAB(HLA class 1 histocompatibility antigen,B39 alpha chain)、ADAMTS2(a disintegrin and metalloproteinase with thrombospondin motifs 2)、LTBP3(latent transforming growth factor beta binding protein 3)、JAG2(jagged 2 protein)和NME2(nucleoside diphosphate kinase 2)与CRC 进展、侵袭、转移密切相关,可作为预测CRC患者肿瘤转移风险的潜在生物标志物。
2.3.3 化疗耐药 基于对奥沙利铂(L-OHP)耐药结直肠癌细胞(HT-29/L-OHP)和非耐药结直肠癌细胞(HT-29)的对比分析,有研究[32]发现,与HT-29 细胞相比,HT-29/L-OHP 细胞中PCBP1[Poly(C)-binding protein 1]蛋白水平增加了15.6 倍。进一步验证发现,PCBP1 缺失使HT-29/L-OHP 和HT-29 细胞对奥沙利铂敏感,而过表达PCBP1 则使HT-29 细胞对奥沙利铂的抗性增强。此外,在L-OHP 难治性患者的肿瘤样本中,PCBP1 的表达明显高于L-OHP 反应性患者。这些结果提示PCBP1是结直肠癌L-OHP潜在耐药分子标志物。
2.4 肝癌
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的肝癌类型。目前,广泛应用于临床的蛋白标志物甲胎蛋白(AFP)在HCC 诊断、预后、预测等方面均显示出一定价值,但效能有限。亟待探索新型蛋白标志物以促进HCC的早期诊断与精准治疗。
2.4.1 早期诊断 基于多重蛋白质组学分析,有研究[33]发现,血清Trim22(tripartite motif-containing antigen 22)在诊断血清AFP水平正常的HCC时敏感度为90.0%,特异度为85.7%,Trim22、BMP1(bone morphogenetic protein1)和Seprase 3 种蛋白联合诊断HCC 的敏感度和特异度可分别高达95.2%和90.0%。另外,功能验证分析表明抑制Trim22表达将促进人肝癌细胞增殖,而过表达Trim22 则减少肝癌细胞的增殖。另有研究[34]提出,尿液AFP(u-AFP)对HCC的诊断敏感度为62.5%,特异度为95.4%,与血清AFP诊断效能无显著性差异。而u-AFP 和u-ORM1(urinary orosomucoid 1)组合诊断HCC 的敏感度为85.1%,为HCC的无创筛查和早期诊断提供新视角。
2.4.2 预测预后 Gao等[35]利用159对肝细胞癌和癌旁组织,首次对与HBV相关肝细胞癌的蛋白基因组学特点进行表征。研究表明,依据不同蛋白质组亚群可对患者生存状态进行分层。进一步患者生存分析表明,蛋白质PYCR2表达越高,预后越差;ADH1A表达越低,预后越差,提示其可能是HCC潜在的临床预后生物标志物。基于对12个HCC小鼠模型的肿瘤蛋白质组学研究,Hindupur等[36]发现在HCC中,整体蛋白质的组氨酸磷酸化显著上调。组氨酸磷酸酶LHPP(phospholysine phosphohistidine inorganic pyrophosphate phosphatase)在HCC小鼠模型中的持续表达可减轻肿瘤负担,防止肝功能丧失。在HCC患者中,LHPP低表达与肿瘤严重程度增加和总生存期降低有关,提示LHPP可能是HCC潜在预后和抑制因子。
2.4.3 治疗靶点 应用蛋白质组学和磷酸蛋白质组学等技术,Jiang 等[37]针对110 个与HBV 感染相关的临床早期HCC 的成对肿瘤和非肿瘤组织进行分析,发现SOAT1(sterol O-acyltransferase 1)表达水平与肝癌患者较差的预后呈正相关。SOAT1 的一种小分子抑制剂阿伐麦布(avasimibe)在肝癌患者的人源肿瘤异种移植(PDX)模型上表现出良好的抗肿瘤效果,表明阿伐麦布有望成为治疗预后较差HCC患者的靶向治疗药物。
2.4.4 化疗耐药 通过对115例HCC患者血清标本连续分析,Kim等[38]揭示了与索拉非尼获得性耐药相关的蛋白质组层面的变化。研究提出CD5L(comprising CD5)、IGJ(immunoglobulin J)、LGALS3BP(galectin-3-binding protein)3种蛋白质组合可有效预测索拉非尼治疗HCC疗效(AUC>0.95),并且该组合是接受索拉非尼治疗的HCC患者不良预后和疾病快速进展的独立危险因素。
2.5 其他类型肿瘤
除上述几种癌症类型(表1),还有一些肿瘤蛋白质标志物的研究也取得了很多进展,如胰腺癌、肾癌、卵巢癌、甲状腺癌、黑色素瘤等。研究发现,蛋白THBS2(thrombospondin-2)、IGFBP2(insulin-like growth factorbinding protein 2)和IGFBP3(insulin-like growth factorbinding protein 3)可能是提高CA19-9对胰腺癌诊断效能的潜在蛋白标志物[39-40]。Qi等[41]研究发现,SERPINH1(serpin peptidase inhibitor clade H member 1)高表达与肾透明细胞癌患者生存率降低显著相关。基于LC-MS/MS的靶向蛋白质组学研究[42]表明,HSP27(heat shock protein 27)联合CA125可能更有利于上皮性卵巢癌的早期诊断,但其效能仍需进一步评估。为了探索鉴别甲状腺乳头状癌与良性结节的分子标志物,Farrokhi等[43]基于血清蛋白质组学分析发现补体C3和载脂蛋白A4在甲状腺乳头状癌中呈特异性改变,为发现甲状腺癌新的潜在标志物提供了基础。但仍需进一步扩大样本验证。另外,在肺转移相关蛋白的鉴定中,NID1(nidogen 1)被证实可促进黑色素瘤的肺转移,其表达与较差临床预后相关[44]。上述研究均为开发不同肿瘤蛋白标志物给予参考,但研究证据相对较弱,仍需要进一步深入探索以发现效能更高、更便捷的蛋白标志物,最终应用于临床。

表1 基于MS的高通量蛋白质组学技术发现不同肿瘤蛋白标志物

表1 基于MS的高通量蛋白质组学技术发现不同肿瘤蛋白标志物(续表1)
3 结语
目前,癌症精准诊疗的主要挑战是阐明肿瘤的发生发展机制、寻找特异的生物标志物、开展精准的靶向治疗。随着MS 技术的飞速发展,基于MS 的蛋白质组学在肿瘤研究中广泛应用,尤其在发现有助于早期诊断和预测预后生物标志物等方面获得了诸多突破。然而有许多瓶颈和技术难题有待攻克:1)多种技术并存,各有优势和局限性,难以形成如基因组研究比较一致的方法;2)各种策略间缺乏整合和互补以适应不同蛋白质的不同特征;3)研究标本量多较小、统计方法不够严谨、研究设计未从临床应用出发;4)缺乏与其他组学如基因组学、转录组学、代谢组学的交叉;5)缺少多中心联合,鼓励全国多中心联合共同收集具有中国特色的肿瘤标本,亟待建立中国蛋白质表达谱。因此,期待更多的肿瘤蛋白质组学研究能够从临床应用出发,在与其他组学整合分析的基础上,全面系统地阐述癌症相关临床问题。相信随着技术的发展,从临床问题出发的肿瘤蛋白质组学研究以及多组学整合研究将最终惠及广大肿瘤患者,为早期诊断和提高生存率建立理论基础。
