干细胞临床研究的现状及展望
2020-06-19何萍程涛郝莎
何萍,程涛,郝莎
·综述·
干细胞临床研究的现状及展望
何萍,程涛,郝莎
300020 天津,中国医学科学院血液病医院(中国医学科学院血液学研究所)实验血液学国家重点实验室/国家血液系统疾病临床医学研究中心(何萍、程涛、郝莎),科技管理处(何萍、郝莎);300020 天津,中国医学科学院干细胞医学中心/北京协和医学院干细胞与再生医学系(程涛)
干细胞是一类具有自我更新和多向分化潜能的细胞,在一定条件下可以分化为多种功能细胞。根据干细胞所处的发育阶段可分为胚胎干细胞(embryonic stem cell,ESC)和成体干细胞(adult stem cell,ASC);根据干细胞发育潜能可分为全能干细胞(如 ESC)、多能干细胞(pluripotent stem cells,PSCs)和单能干细胞(如造血干细胞、神经干细胞等)。干细胞由于具有再生各种组织和人体器官的潜在功能,因此在医学界常被称为“种子细胞”或“万用细胞”,为许多重大疾病的有效治疗带来了新的希望。
干细胞治疗是利用干细胞的分化潜能,将健康的干细胞移植到患者体内,进而达到组织再生修复的作用。基于干细胞的修复与再生能力的再生医学被誉为继药物治疗和手术治疗之后的第三次医学革命[1]。干细胞治疗对神经、血液、心脑血管、肝脏、肾脏等多个系统相关的重大疾病做了有益尝试,正在成为各国政府、科技界和产业界高度关注和大力投入的战略必争领域。欧美及日本等发达国家和地区均将干细胞研究提升为国家科技发展的重要战略进行科技部署并力推干细胞的临床应用。与此同时,作为干细胞产业转化研发主体的大型医药企业,也已针对干细胞及转化医学的发展趋势做出投资和布局的调整,全球超过 700 家公司正在开展干细胞及转化医学相关的研究,竞争日趋白热化。
本文将对干细胞临床研究及应用的国内外发展现状进行综述,同时,回顾我国干细胞临床研究相关的监管政策,提出我国干细胞行业发展存在的主要问题及对策建议。最后,对干细胞临床应用的前景进行展望,以期对我国干细胞临床研究及应用规范有序地开展提供有益借鉴。
1 干细胞临床研究及应用的国际发展现状和趋势
1.1 干细胞临床研究的国际发展现状
在干细胞研究领域成为前沿热点的背景下,目前全球登记的干细胞临床试验已超过 7000 项,其中有接近 3000 项已完成临床试验研究(数据来源于 Clinicaltrials.gov,截至 2019 年 12 月)。从疾病治疗领域来看,神经系统疾病、癌症和肿瘤类疾病、出生前疾病和异常、血液和淋巴疾病、心血管疾病是目前临床研究数量较多的疾病领域。在干细胞治疗的细胞种类选择上,造血干细胞(hematopoietic stem cell,HSCs)的临床试验数量最多,占干细胞临床试验总数的 48.5%(3707/7637 项),体现出 HSCs 在干细胞临床研究中受到的高度关注;其次为间充质干细胞(mesenchymal stem cells,MSC),总计有 1013 项,占比 13.3%,其数量尤其在近几年持续增加,说明 MSC 的重要性日益增强;在其他类型细胞中,神经干细胞(neural stem cell,NSC)和多能干细胞的治疗研究进入临床试验阶段的项目数量也相对较多,其中神经干细胞被主要应用于中枢神经系统疾病的治疗,而多能干细胞被主要应用于眼部疾病和遗传性疾病的治疗。
1.2 干细胞治疗的国际发展趋势
在造血干细胞移植(hematopoietic stem cell transplantation,HSCT)技术方面。HSCT 至今已经历了 60 余年的发展历程,可以治愈某些血液系统及非血液系统疾病,是最为经典和成熟的干细胞临床应用方案,奠定了干细胞生物学和再生医学的发展基石[2]。欧盟在 2016 年批准了第一个基于造血干细胞基因疗法的产品 Strimvelis,用于治疗由腺苷脱氨酶单基因引起的严重复合型免疫缺陷病。预计在 2020 年底,另外五个基于造血干细胞基因疗法的产品在欧盟或者美国或将通过审批,进入临床应用,并且还有 20 项针对不同基因遗传疾病相关的临床试验也在进行中[3]。
在间充质干细胞治疗方面。目前在全球上市的干细胞治疗产品中,MSC 相关产品的数量占比最多,发展势头强劲。2010 年 7 月,澳大利亚批准 Mesoblast 公司生产和供应自体间质前体细胞,用于受损组织的修复和再生;2011 年7 月,韩国准许由 FCB-Pharmicell 公司开发的心脏病治疗药物 Hearticellgram-AMI 投放市场销售;加拿大在 2012 年 5 月批准美国 Osiris 研发的干细胞药物 Prochymal 上市,用于治疗儿童急性移植抗宿主疾病(graft-versus-host disease,GvHD),之后新西兰于同年 6 月15 日授予该公司干细胞药物营销许可,Prochymal 成为全球首个获准用于治疗全身性疾病的干细胞药物。
在神经干细胞治疗方面。2002 年 4 月美国首次报道了 1 例帕金森病患者接受 NSC 分化的多巴胺神经元自体移植治疗的病例,临床症状得到显著改善;2011 年 3 月,美国 Stem Cells 公司在国际上首先利用 NSC 针对 12 名胸段脊髓损伤的患者开展 I/II 期临床试验,12 名患者中有8 名感觉功能获得恢复[4];2014 年 8 月,美国NeuralStem公司经 FDA 批准从胎儿脊髓中获取 NSC 用于 4 名患者治疗陈旧性颈段及胸段脊髓损伤,结果显示所有受试者耐受性良好,其中有 2 名患者有 1 ~ 2 个神经节段获得改变[5];在中枢神经系统肿瘤的治疗中,2007 年开展了一项 III 期临床研究,主要是探讨关于脑转移瘤患者神经干细胞保护式放疗与普通放疗的优势。
在多能干细胞治疗方面。目前一些利用胚胎干细胞以及诱导多能干细胞分化的细胞也已进入了临床试验阶段。2009 年 1 月,美国 FDA 批准了 Geron 公司全球首例人胚胎干细胞人体试验,针对亚急性胸段脊髓损伤患者移植干细胞产品 GRNOPC1——一种由人胚干细胞分化的少突胶质前体。随后,美国先进细胞公司获准用人胚干细胞分化的视网膜色素上皮细胞进行治疗视网膜黄斑变性病人的试验。一年后,该临床试验也获准在英国开展,成为欧洲首例胚胎干细胞临床试验。2014 年 9 月,日本批准了利用诱导多能干细胞制成视网膜细胞进行眼疾治疗的临床研究。此外,多能干细胞还被应用于药物研发,例如用于研究心脏疾病的发病机制以及筛选相关药物[6]。
1.3 国际干细胞产业的发展现状
随着干细胞临床试验研究的不断增加,全球干细胞产业也迈入了高速发展期。目前全球已有 14 款干细胞药物上市(表 1),适应证包括膝关节软骨缺损、移植物抗宿主病、克罗恩病、急性心肌梗死、遗传性或获得性造血系统疾病、退行性关节炎、赫尔勒综合征、中度至重度角膜缘干细胞缺乏症、血栓闭塞性动脉炎等疾病。而正在全球范围内积极开展的干细胞临床试验预示着未来还将有更多的适应证患者受益。
在获批上市的干细胞药物中,超过一半以上是间充质干细胞治疗产品。根据 Polaris Market Research 发布的最新研究报告,全球间充质干细胞市场前景明朗,在多种综合因素的影响下,整个市场将保持增长趋势;2018 – 2026 年,全球间充质干细胞市场预计以 7.3% 的复合年增长率增长。同样,全球市场调研机构 ARC(Analytical Research Cognizance)发布的报告也显示,全球间充质干细胞市场发展迅速,预计至 2024 年底其市场值将达到 2.2 亿美元。
2 我国干细胞临床研究及应用的发展现状
干细胞治疗一直是生命科学前沿最受重视的领域之一,受到新的研究领域和方法的推动及各国政府政策的支持。目前全球干细胞临床研究主要分布于美国、欧洲等国家或地区。近年来,在国家政策的扶持下,我国干细胞临床研究也与日俱增,在数量上追赶而上,迈入世界领先行列。这预示着中国已进入全球干细胞治疗领域的梯队,与其他国家间的差距在逐步缩小。
2.1 我国干细胞临床研究及应用的监管政策
我国干细胞治疗领域发展至今,其监管经历了数十年变革。为避免对干细胞治疗技术临床转化产生负面影响的不规范现象,促进干细胞治疗技术科学、有序发展,国家陆续出台了一系列规范干细胞治疗临床研究和应用行为的政策和法规(图 1)。
第一阶段:1993 – 2003 年。
1993 年 5 月,原卫生部颁布《人的体细胞治疗及基因治疗临床研究质控要点》,首次将人的体细胞治疗纳入药品的法制化管理;国家药监局(CFDA)成立后,分别于1999 年和 2003 年先后颁布《新生物制品审批办法(局令第 3 号,1999)》和《人体细胞治疗研究和制剂质量控制技术指导原则》,加强对新生物制品研制和审批的管理,明确人的体细胞治疗按新药注册,并进一步完善人体细胞治疗的质量控制技术原则。这是我国人的体细胞治疗领域科学化、规范化、与国际同步的良好发展开端。
第二阶段:2009 – 2015 年。
2009 年 3 月,原卫生部发布《医疗技术临床应用管理办法》,将细胞治疗划分为第三类医疗技术,对其实施准入管理。由此,我国的体细胞治疗全面放开。但由于监管体制相对宽松,部分医疗机构科室在没有经过卫生计生委批准的情况下纷纷开展体细胞治疗项目,各种形式的临床试验和临床应用项目迅速增加。2015 年 7 月,国家卫生计生委按照国务院行政审批制度改革要求,下发《国家卫生计生委关于取消第三类医疗技术临床应用准入审批有关工作的通知》,正式取消第三类医疗技术临床应用准入审批。与此同时,为规范并促进我国干细胞临床研究,国家卫生计生委与食品药品监管总局共同组织制定了《干细胞临床研究管理办法(试行)》和《干细胞制剂质量控制及临床前研究指导原则(试行)》,我国从此开始施行干细胞临床研究备案管理制度,标志着干细胞市场迎来风口。在临床研究方面,干细胞治疗得以从人的体细胞治疗中分类出来,得到明确的专门管理办法,并适用至今。

表 1 全球已上市干细胞药物
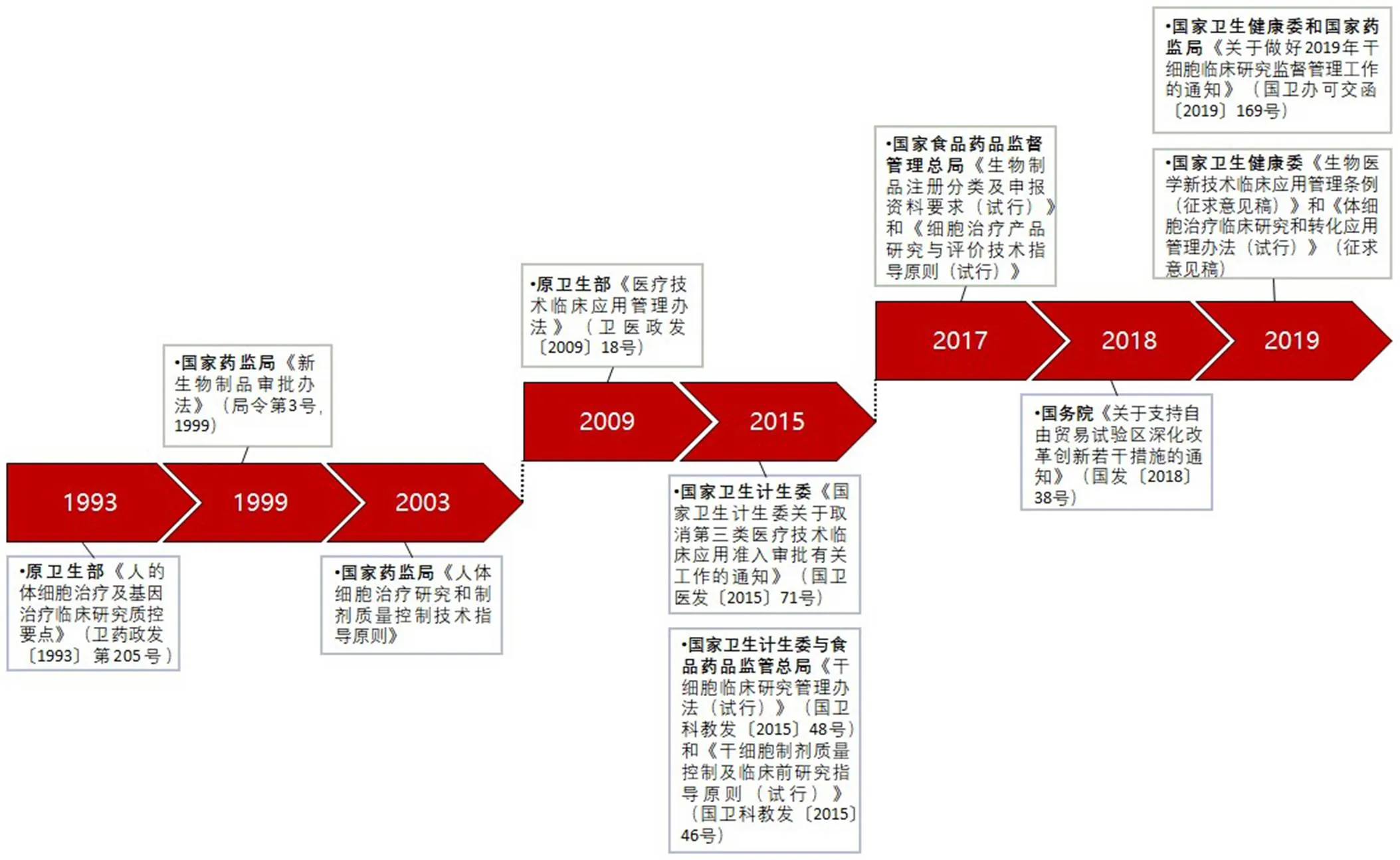
图 1 干细胞临床研究及应用的监管政策变革
第三阶段:2017 – 2019 年。
2017 年 3 月,国家卫生计生委和国家食药监总局在其医学研究备案登记信息系统中公布了首批通过备案的 8 个干细胞临床研究项目。同年 10 月,CFDA 发布《生物制品注册分类及申报资料要求(试行)》,要求将细胞治疗技术按照治疗性生物制品进行申报。同年 12 月,《细胞治疗产品研究与评价技术指导原则(试行)》正式落地,这也意味着国内细胞治疗行业经历整顿和规范后重入正轨。2018 年 11 月,国务院发布《关于支持自由贸易试验区深化改革创新若干措施的通知》,明确提出了自贸试验区的医疗机构可以根据自身的实际情况来开展干细胞临床研究。此通知的颁布,表明我国对于干细胞治疗技术的重视,也极大推动了我国干细胞行业的发展。2019 年 2 月,国家卫生健康委发布《生物医学新技术临床应用管理条例(征求意见稿)》,意见稿中明确:生物医学新技术临床研究实行分级管理。其中,干细胞产品被划分为高风险生物医学新技术,其临床研究和转化应用交由国务院卫生主管部门和国务院药品监管部门管理。紧接着,国家卫生健康委和国家药监局(后文简称“两委局”)联合印发《关于做好 2019 年干细胞临床研究监督管理工作的通知》,明确今后需要同时进行干细胞临床研究机构和项目的双备案,并且干细胞临床研究机构与项目备案自 2019 年起实行动态管理。2019 年 3 月,国家卫生健康委发布《体细胞治疗临床研究和转化应用管理办法(试行)》(征求意见稿),明确指出允许经临床证明安全有效的细胞治疗项目经过备案后在相关医疗机构进入转化应用。
目前,医疗机构开展的干细胞临床研究是由两委局协同共管,以《中华人民共和国药品管理法》为法律依据,遵照《干细胞临床研究管理办法(试行)》和《干细胞制剂质量控制及临床前研究指导原则(试行)》开展专项监督检查。如后续申请药品注册临床试验,可将已获得的临床研究结果作为技术性申报资料提交并用于药品评价,但不能直接进行临床应用。
此外,各地方省市也做出积极响应,相继发布多项利好政策,鼓励干细胞治疗行业规范化蓬勃发展。经过近几年的探索和试点放开,逐渐打造了以珠三角地区、环渤海地区、长三角地区和西南地区为中心向四周辐射的干细胞行业发展格局。
2.2 我国干细胞临床研究及应用的发展现状
我国干细胞行业在国家鼓励性政策的引导下正在蓬勃发展。在干细胞临床研究方面,根据中国医药生物技术协会的公示信息,截至 2019 年 12 月,我国干细胞临床研究备案机构已增至 119 家,其中国家批准干细胞临床治疗研究医院 107 家,军队系统医院 12 家。从地区分布上看(图 2),北京、广东、上海已通过备案研究机构的数量处于领先地位;浙江、山东、云南、江苏和湖北紧随其后。同时,由备案机构提交的干细胞临床研究备案项目已增69 个,部分项目已宣布启动。其中,从涉及的疾病治疗领域来看(图 3),神经系统疾病(占比 19%)和妇产科疾病(占比 16%)是目前最受关注的两个领域,未来有望获得快速突破。
在干细胞临床应用方面,根据国家药品监督管理局药品审评中心(CDE)公示信息显示,2018 年 6 月以来,共有 12 款干细胞新药注册申报获受理,结束了我国干细胞领域在此前长达四年之久的申报受理空白期。2019 年我国干细胞临床转化也获得了实质性进展。在国家药监局收审的干细胞 I 类新药中,有 7 款干细胞新药已获得临床试验默示许可,分别是胎盘、脐带、异体/自体脂肪来源的间充质干细胞,适应证包括了膝骨关节炎、类风湿关节炎、糖尿病足溃疡和GvHD。
目前,我国干细胞的临床应用尚属起步阶段,尽管上述干细胞临床试验已初见成效,但仍有许多问题有待解决,在大规模临床应用前,为确保其疗效和安全性,必须进行严格的质量控制,进行坚实的基础研究和动物模型实验,开展大样本、多中心、随机对照干细胞治疗临床试验等,相信随着干细胞研究的不断深入,在未来的生物科学领域将发挥巨大的作用。
3 干细胞研究和临床应用存在的主要问题及对策建议
干细胞在某些疑难性疾病的治疗效果对其的临床转化起到了巨大的推动作用,但是干细胞治疗真正迈向临床广泛应用仍任重道远。在这个进程中,有两个主要的限制因素。
一是缺乏国家乃至国际统一认证的质控标准。美国为保证干细胞临床试验能够安全有序的开展,其药品监管部门制定了完善的审批和临床试验体系,其中就包括制定细胞供体选择、细胞鉴定等规范[7]。而在我国,国家药品监管部门对干细胞的安全及有效性的评价标准和干细胞技术的标准操作规程是相对缺乏的,对干细胞临床研究的规范也尚未明确[8],这不利于我国干细胞产业化以及干细胞治疗市场的发展。在此背景下,一些国内学/协会开始关注到该问题,启动了组织行业专家制定相关团体标准的工作。
2016 年 10 月,中国医药生物技术协会为规范我国干细胞制剂制备、加强质量管理、促进行业自律,发布《干细胞制剂制备质量管理自律规范》[9],结束了我国多年来在干细胞制剂制备领域中没有质量要求和标准的历史。2017 年 11 月,中国细胞生物学学会干细胞生物学分会发布《干细胞通用要求》[10],该标准围绕干细胞制剂的安全性、有效性及稳定性等关键问题,建立了干细胞的供者筛查、组织采集、细胞分离、培养、冻存、复苏、运输及检测等的通用要求,有力地推动干细胞领域的规范化和标准化。2019 年2 月,中国细胞生物学学会再次发布《人胚胎干细胞》团体标准[11],这是中国乃至国际首个针对胚胎干细胞的产品标准。中国科学院动物研究所周琪院士表示,“这些标准将在干细胞领域标准化建设、保障受试者权益、规范干细胞行业发展、促进干细胞转化应用等方面发挥重要作用”。今后,为进一步应对该发展瓶颈,期待我国建设国家级干细胞质量控制体系,进而开展统一的干细胞制剂的质量及治疗标准化研究,发布国家级质控规范,引领行业质控标准。
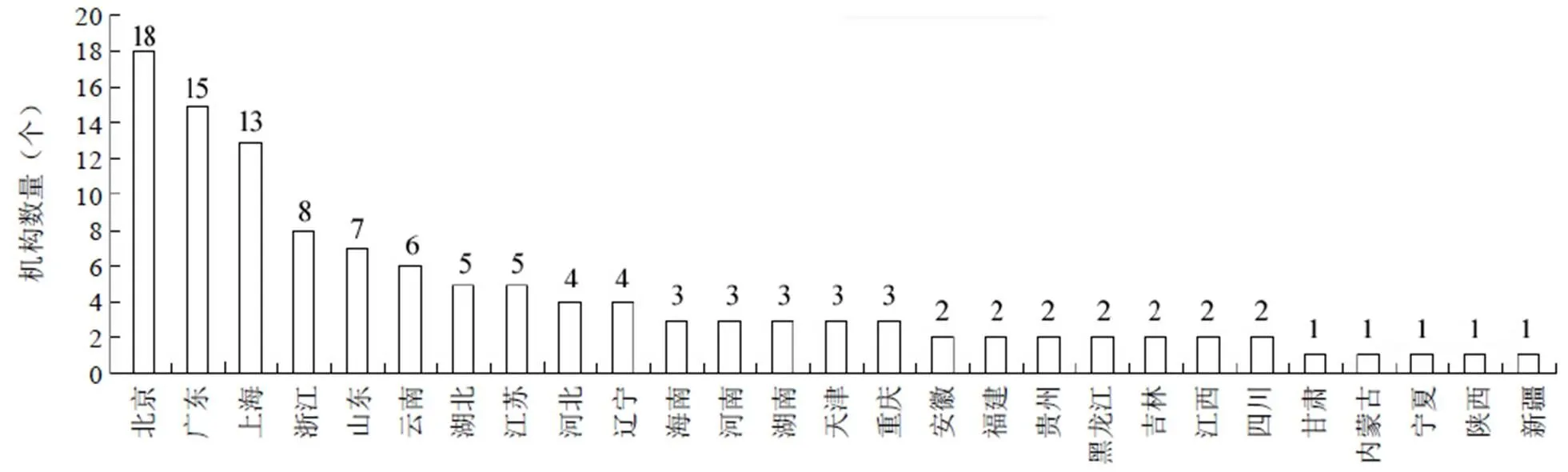
图 2 干细胞临床研究备案机构的全国分布情况
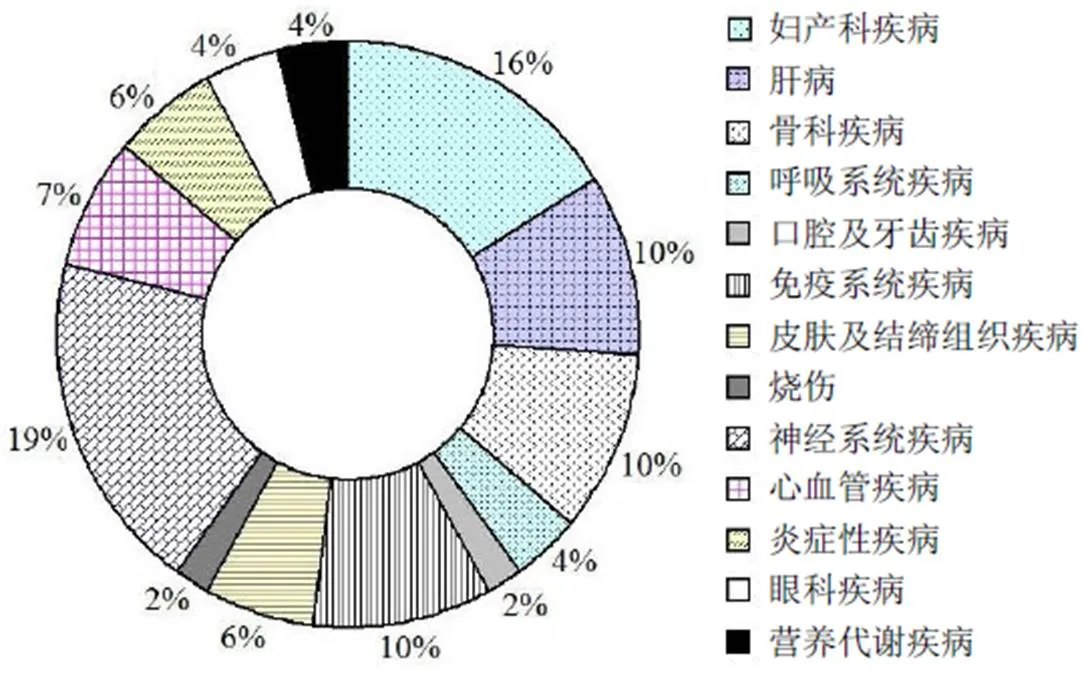
图 3 干细胞临床研究备案项目的疾病领域分布情况
二是缺乏干细胞临床研究及应用的基于风险的分级管理机制。国内干细胞临床药物和治疗应用市场目前受到政策法规的严格管理,中下游产业因技术壁垒高、审批严格,导致转化进程迟缓。美国、欧盟等地的药品监管部门对细胞治疗实行基于风险的分级管理:对“最小化干预”、“同源使用”的自体细胞作为医疗技术使用,不在药品管理法范围,不需要走新药申报程序;对超出“最小化干预”或“非同源使用”的细胞产品作为药品进行临床研究与申报,并制定豁免条款,符合条件的医疗技术允许在授权医院使用。在此分级管理机制下,通过美国 FDA 或欧盟EMA 首次审批,已成功上市了共 8 款干细胞新药,占据全球上市干细胞新药的半壁江山。
基于国际上的监管政策情况,我国已开始在生物医学新技术的临床研究中初步探索建立基于风险的分级管理机制。2019 年 2 月 26 日,国家卫生健康委发布《生物医学新技术临床应用管理条例(征求意见稿)》,将干细胞的临床研究归入高风险生物医学新技术实行监管,未经临床研究证明安全性、有效性的,不得进入临床应用。但针对不同类型的干细胞治疗技术,并未进一步分级。因此,我国是否能进一步探索建立针对干细胞临床转化的创新政策监管体制,加强安全管控,同时鼓励技术创新,推动干细胞产业安全、规范、高质量发展,这也许会是解决转化进程迟缓问题的突破口。
4 展望
干细胞科技的力量正在逐渐为人所知的案例中得以展现[12]。目前已经有上百种疾病的临床研究采用了干细胞,并且从启动的干细胞临床研究项目进展中,我们可以看出干细胞在多种疾病中拥有着巨大的治疗潜力[6]。虽然全球正在进行的干细胞研究大多处于临床早期,但随着临床试验数量的迅速且持续地增加,相信未来有望迎来成果产出的爆发期,为更多难治性疾病的患者带去希望。我国的干细胞行业在国家政策的科学监管下也逐步进入良性发展轨道。根据 IMS 数据预测,到 2020 年,全球干细胞市场将达到 4000 亿美元,中国干细胞市场规模将高达 1200 亿元人民币。但是,考虑到我国干细胞生物技术产业目前主要是上游产业,以干细胞存储为主,干细胞临床转化研究的步伐还有待进一步加快,尤其是在临床级别的干细胞的建立与培养方法、质控体系建立、多能干细胞定向分化/转分化、干细胞体外 3D 培养、遗传和表观遗传的操控等方面加强研究和突破,将对干细胞的应用推广具有重大的临床价值。
总之,干细胞作为一项高新科技,它将给医学、保健事业带来跨时代的颠覆性变革,为人类的健康和高质量生活带来福音。期待在不久的将来,我国首个拥有自主知识产权的干细胞上市新药诞生,为全球干细胞产业发展贡献更多力量。
[1] Zhou Q. Stem cells -- The heart of the new medical revolution// Branch of Tissue Engineering and Regenerative Medicine, Chinese Society of Biomedical Engineering. Proceedings of the sixth national congress of tissue engineering and regenerative medicine. 2013:37. (in Chinese)
周琪. 干细胞--新医学革命的核心//中国生物医学工程学会组织工程与再生医学分会. 第六届全国组织工程与再生医学大会论文集. 2013:37.
[2] Hao S, Dong F, Hu LP, et al. Biology and clinical application research of hematopoietic stem cells. Chin J Cell Biol, 2018, 40(13):2237-2248. (in Chinese)
郝莎, 董芳, 胡林萍, 等. 造血干细胞生物学及临床应用研究概况. 中国细胞生物学学报, 2018, 40(13):2237-2248.
[3] De Luca M, Aiuti A, Cossu G, et al. Advances in stem cell research and therapeutic development. Nat Cell Biol, 2019, 21(7):801-811.
[4] Li JY, Han SF, Xiao ZF, et al. Clinical studies on neural regeneration in traumatic spinal cord injury. Sci China (Ser C), 2019, 49(6):673- 682. (in Chinese)
李佳音, 韩素芳, 肖志峰, 等. 脊髓损伤再生修复的临床研究进展. 中国科学(生命科学), 2019, 49(6):673-682.
[5] Curtis E, Martin JR, Gabel B, et al. A first-in-human, phase I study of neural stem cell transplantation for chronic spinal cord injury. Cell Stem Cell, 2018, 22(6):941-950.
[6] Blau HM, Daley GQ. Stem cells in the treatment of disease. N Engl J Med, 2019, 380(18):1748-1760.
[7] Gao SP, Qu CH, Zhou R, et al. Advances in stem cell research and translational medicine. Acta Laboratorium Anim Scientia Sinica, 2016, 24(4):439-442. (in Chinese)
高舒平, 曲春辉, 周瑞, 等. 干细胞与转化医学研究进展浅析. 中国实验动物学报, 2016, 24(4):439-442.
[8] Chen H. Translational research on stem cells in China. Chin Med Biotechnol, 2011, 6(5):321-322. (in Chinese)
陈虎. 我国干细胞转化医学进程探究. 中国医药生物技术, 2011, 6(5):321-322.
[9] China Medicinal Biotechnology Association. Code of manufacturing quality management for stem cell based-medicinal product. Chin Med Biotechnol, 2016, 11(6):481-490. (in Chinese)
中国医药生物技术协会. 干细胞制剂制备质量管理自律规范. 中国医药生物技术, 2016, 11(6):481-490.
[10] Chinese Society for Stem Cell Research. T11/CSSCR 001-2017 General requirements for etem cells. Beijing: China Standard Press, 2017. (in Chinese)
中国细胞生物学学会干细胞生物学分会. T11/CSSCR 001-2017 干细胞通用要求. 北京: 中国标准出版社, 2017.
[11] Chinese Society for Cell Biology. T/CSSCR 002-2019 Human embryonic stem cell. Beijing: China Standard Press, 2019. (in Chinese)
中国细胞生物学学会. T/CSSCR 002-2019 人胚胎干细胞. 北京: 中国标准出版社, 2019.
[12] Xu L, Wang J, Liu Y, et al. CRISPR-edited stem cells in a patient with HIV and acute lymphocytic leukemia. N Engl J Med, 2019, 381(13): 1240-1247.
中国医学科学院医学与健康科技创新工程基金(2016-I2M- 1-017、2019-I2M-1-006)
郝莎,Email:haosha@ihcams.ac.cn
2019-12-30
10.3969/j.issn.1673-713X.2020.03.011
