组织研磨-QuEChERS-高效液相色谱-串联质谱法测定动物源食品中磺胺类药物残留以及基质效应的研究
2020-06-19张虹艳邱国玉吴福祥许晓辉李晨曦潘秀丽王小乔
张虹艳,邱国玉,吴福祥,许晓辉,李晨曦,潘秀丽,王小乔
(兰州市食品药品检验所,甘肃兰州 730050)
随着人民生活水平的改善,药物残留日益受到关注[1]。磺胺类药物(sulfonamides,SAs)是一类含有对氨基苯磺酰胺结构的广谱抗菌药物,广泛的应用于畜牧和水产养殖。由于养殖户在预防和治疗动物疾病过程中的不规范使用,导致动物源食品中出现抗菌类药物残留[2]。磺胺类药物残留通过食物链进入人体会引起过敏反应、肠道菌群失调等副作用[3]。我国以及欧盟对动物源性食品中磺胺类药物残留限量有严格规定,我国农业部第235号公告要求,动物源性食品以及组织中磺胺类总量最大残留限量为100 μg/kg。
目前,磺胺类药物残留的检测方法主要有高效液相色谱法[4-5]、液相色谱-串联质谱法[6-7]、毛细管电泳[8],免疫分析法[9]。高效液相色谱法通用性强;免疫分析法专属性高、操作简易;毛细管电泳分离效能高、试剂、耗材消耗少,但是上述三种方法均存在灵敏度低的问题,不适用于痕量物质的检测。液相色谱-串联质谱法通过保留时间、特征离子对以及离子对丰度比进行定性定量分析,方法专属性强,灵敏度高,越来越成熟的应用于药物残留检测。药物残留检测中应用较多的前处理技术有固相萃取(SPE)[10-11]、加速溶剂萃取(ASE)[12]、基质分散固相萃取(MSPD)[13-14]、QuEChERS[15-16]、微波辅助萃取(MAE)[17]、磁性固相萃取[18-19]。
上述前处理方法过程复杂,大多数需要经过提取、净化、浓缩等步骤,既消耗了大量的时间和耗材,同时降低了方法的检测灵敏度,磁性固相萃取技术多以石墨烯为材料,成本较高。QuEChERS法具有高通量、低成本、节省试剂和耗材的优势,被广泛应用于果蔬、植物、谷物、肉类的检测,并纳入GB 23200.113-2018(植物源性食品中208种农药及其代谢物残留量的测定)。由于动物源性食品基质复杂,前期的研究大多未考虑不同样品基质对定量结果的影响。基质效应主要指试样中的非待测组分影响待测物浓度或质量测定的准确度,引起待测物响应值增加或减少的现象[20]。不同的前处理方法、不同的样品来源、不同的色谱分析条件、不同的离子源都会产生基质效应。样品中的共流物与目标成分产生离子竞争,从而导致目标物的离子化效率升高或者降低,引起基质效应增强或者基质效应抑制[21],是导致液相色谱-串联质谱法定量分析结果不准确的直接原因。
针对上述情况,本实验以猪肉、牛奶、鸡蛋为研究对象,采用组织研磨仪-QuEChERS-三重四极杆液质联用仪,对动物源性食品中磺胺类兽药残留进行研究。组织研磨仪采用上下垂直高速振荡模式,可以促进细胞快速破碎、细胞裂解、组织匀浆,使得样品研磨更加均匀、充分,样品重复性好,样品之间没有交叉污染,同时节省了时间和人力成本的消耗,是一种高通量高速率高效的样品前处理技术。研究不同条件下,组织研磨仪对磺胺类药物提取效果的影响,并探索猪肉、鸡蛋、牛奶三种动物源性食品的基质效应,为优化兽药残留检测方法、提高兽药残留检测技术提供数据支持和理论依据。
1 材料与方法
1.1 材料与仪器
猪肉(后腿)、牛奶(未脱脂)、鸡蛋 均为兰州市超市采购;磺胺间二甲氧嘧(SDM,纯度≥99.4%)、磺胺邻二甲氧嘧啶(SDX,纯度≥99.1%)、磺胺喹沙啉(SQX,纯度≥98.9%)、甲氧苄啶(TMP,纯度≥99.8%)、磺胺氯哒嗪(SCP,纯度≥99.1%)、磺胺间甲氧嘧啶(SMM,97.0%)、磺胺二甲嘧啶(SM2,纯度≥100.0%)、磺胺甲基嘧啶(SMR,纯度≥99.7%)、磺胺甲恶唑(SMZ,纯度≥99.5%)、磺胺嘧啶(SDZ,纯度≥99.7%) 德国Dr.Ehrenstorfer公司;乙腈 色谱纯,默克公司;QuEChERS萃取盐包(5982-0032)、EMR-Lipids净化管(5982-1010) 安捷伦;EDTA缓冲液(柠檬酸8.4 g,磷酸氢二钠7.1 g,乙二胺四乙酸二钠19.5 g,溶于650 mL水中)。
1290-6460三重四极杆液质联用仪 美国安捷伦;GENO2010组织研磨仪 美国SPEX;5810R冷冻离心机 德国艾本德;VORTEX KB-3涡旋振荡器 中国海门其林贝尔;MS105DU电子天平 美国梅特勒。
1.2 实验方法
1.2.1 标准溶液配制 标准品储备液:准确称取10 种磺胺类药物标准品各10.00 mg,分别用乙腈溶解并定容于10 mL容量瓶中,得到1 mg/mL磺胺类药物标准品的储备液,于4 ℃冰箱中保存。
混合标准溶液:分别精密移取各标准品储备液0.1 mL至100 mL容量瓶中,用乙腈稀释并定容,配成浓度各为1.0 μg/mL的混合标准溶液,于4 ℃冰箱中保存。
基质标准溶液:称取与试样基质相应的阴性样品,加入混合标准溶液适量,与样品同时进行提取和净化。
1.2.2 样品前处理 将猪肉和鸡蛋进行匀浆处理,牛奶直接取样。准确称取2.0 g(精确至0.01 g)以上样品置于50 mL离心管中,加入3 mL EDTA缓冲液,组织研磨仪以1000 r/min的转速提取2 min,准确加入5 mL乙腈,涡旋1 min,加入Bond QuEChERS萃取盐包,涡旋1 min,静置10 min,在4 ℃以8000 r/min低温离心5 min,水和乙腈分层,收集上层液作为提取液。净化管中,加入水2.5 mL,涡旋3 s,准确加入上述乙腈提取液2.5 mL,涡旋1 min,在4 ℃以8000 r/min低温离心5 min,上清液过0.22 μm滤膜,于高效液相色谱-串联质谱仪测定。
1.2.3 分析条件
1.2.3.1 色谱条件 色谱柱:C18(2.1×100 mm,2 μm);柱温:35 ℃;进样量:5 μL;流速:0.3 mL/min;流动相:A为0.1%甲酸溶液,B为乙腈。梯度洗脱程序:0~1.0 min,95% A;1.0~2.5 min,95%~75% A;2.5~5.0 min,75% A~40% A;5.0~6.0 min,40% A;6.0~6.1 min,40% A~5% A;6.1~8.0 min,5% A;8.1~10.0 min,95% A。
1.2.3.2 质谱条件 电喷雾离子(ESI)源;多反应监测(MRM)模式检测;雾化气温度:300 ℃;雾化器流速:11 L/min,喷雾电压:15 psi。其余质谱参数见表1。

表1 10种磺胺类物质的质谱参数Table 1 Mass parameters of the ten sulfonamides
1.3 数据处理
采用安捷伦液质自带数据处理软件MassHunter(B.06)进行数据处理和分析。
2 结果与分析
2.1 流动相优化
分别比较了水-乙腈、0.1%甲酸溶液-乙腈、0.2%甲酸溶液-乙腈、10 mmol/L乙酸铵溶液-0.1%甲酸-乙腈流动相体系梯度洗脱对10种磺胺类药物响应值和分离度的影响,结果如图1,使用水-乙腈梯度洗脱,10种磺胺类药物的响应值和分离度均不佳;使用0.1%甲酸溶液-乙腈、0.2%甲酸溶液-乙腈、10 mmol/L乙酸铵溶液-0.1%甲酸-乙腈梯度洗脱均能有效分离8种磺胺类药物,其中磺胺邻二甲氧嘧啶和磺胺甲恶唑分子结构相近未能基线分离,磺胺间二甲氧嘧啶和磺胺喹沙啉分子结构相近未能基线分离。使用0.1%甲酸溶液-乙腈梯度洗脱和使用10 mmol/L乙酸铵溶液-0.1%甲酸-乙腈梯度洗脱10种磺胺类药物分离度和响应强度没有明显差异,0.2%甲酸溶液-乙腈梯度洗脱响应强度最弱。因为磺胺类药物为弱碱性,在流动相中加入少量的甲酸,可以促进化合物带正电荷,但是酸浓度过高,同样也会抑制其电离。使用0.1%甲酸溶液-乙腈进行梯度洗脱,10种磺胺类药物的响应值增强,峰形和分离度得到改善,因此选择0.1%甲酸溶液-乙腈作为流动相进行梯度洗脱溶液。

图1 10种磺胺类药物总离子流图Fig.1 TIC of 10 sulfonamides standard solution
2.2 组织研磨仪条件优化
传统的涡旋振荡提取方式,动能低,样品均匀性无法得到保证,导致实验结果重现性不好。为了使得样品研磨更加均匀、充分,样品重复性好,保证样品的重现性、有效性、可比性,组织研磨仪可设置研磨时间、研磨速率,保证每次研磨条件的一致性。分别设置不同研磨速率以及研磨时间,对比10种磺胺类药物的回收率,确定最优研磨速率以及研磨时间。以猪肉为实验对象,添加混合标准溶液100 μL(见1.2.1),10种磺胺类药物的添加量为50 μg/kg。
设定研磨速率为1000 r/min,研磨时间分别为0.5、1、1.5、2、3 min,其余步骤按1.2.2进行样品前处理,每个样品平行测定3次,外标法定量。结果见图2,随着研磨从0.5 min逐渐升至3 min,10种磺胺类药物的平均回收率呈现逐渐增大再回落的趋势,研磨时间为2 min时,10种磺胺类药物的平均回收率最高,研磨时间为3 min时,10种磺胺类药物的平均回收率略有降低。因为动物组织随着研磨时间增长,细胞破碎越充分,细胞内蛋白质等物质大量释放,不利于磺胺类药物的提取。

图2 不同研磨时间对10种磺胺类药物回收率的影响Fig.2 Effects of different grinder timeon the recoveries of ten sulfonamides
设定研磨时间为2 min,研磨速率分别为500、800、1000、1200、1400、1600 r/min(最大速率1750 r/min),其余步骤按1.2.2进行样品前处理,每个样品平行测定3次,外标法定量。猪肉在不同研磨速率下均可研磨呈肉糜状,猪肉提取液随着研磨速率升高,组织破碎越细腻均匀,颜色越浅,结果见图3。研磨速率从500 r/min提高至1600 r/min时,10种磺胺类药物回收率呈现整体缓慢增大之后保持平稳的趋势。研磨速率提高至1000 r/min时,10种磺胺类药物的平均回收率最高,研磨速率从1000 r/min提高至1600 r/min,回收率维持在稳定水平,说明当研磨速率提升至1000 r/min时,猪肉组织已研磨均匀,猪肉组织达到平衡状态,因此选择1000 r/min作为最适宜研磨速,如图3所示。

图3 不同研磨速率对10种磺胺类药物回收率的影响Fig.3 Effects of different grinder rateson the recoveries of ten sulfonamides
2.3 基质效应评价
本试验采用空白基质匹配标准校正法进行校正,使标准品和样品在质谱电喷雾接口处具有一致的离子化条件,可以有效的消除基质效应,确保定量结果的准确性相同浓度的基质标准溶液和溶剂标准溶液分别进样3针,化合物的基质效应(ME)=基质标准平均响应值/溶剂标准平均响应值[22]。若ME>1.0,则表示基质对分析物的响应产生增强效应;ME<1.0则表示基质对分析物的响应产生抑制;ME=1.0,则表示不存在基质效应[23-25]。ME偏离1.0的程度越大基质效应越强,ME越接近1.0,基质效应越小。
2.3.1 不同磺胺类药物浓度基质效应评价 本试验以猪肉为研究对象,采用组织研磨-QuEChERS前处理方法,考察了不同浓度的磺胺类药物的基质效应,制备基质标准曲线与对应质量浓度的溶剂标准曲线,对比浓度分别为2、5、10、20、50、100 μg/L六个浓度水平溶剂标准曲线基质效应的差异(对应的基质标准曲线浓度为10、25、50、100、250、500 μg/kg)。结果如图4所示,磺胺氯哒嗪(SCP)在不同浓度下均表现为基质增强,磺胺间甲氧嘧啶(SMM)在不同浓度下均表现为基质抑制,其他8种磺胺类药物在同一浓度水平下基质效应差异不明显。随着目标化合物浓度增大,多数化合物基质效应随之减小,整体呈现出低浓度基质增强,高浓度基质抑制的趋势。可能是因为猪肉含有大量蛋白质和脂肪等成分,与磺胺类药物共流出,导致显著的基质效应。药物浓度小于10 μg/L时(对于的基质标准曲线浓度为50 μg/kg),基质效应显著增强。随着药物浓度增大,基质相对目标化合物的浓度降低,争夺离子能力降低,基质效应降低并趋于稳定,但部分药物由基质增强变为基质抑制,初步推测可能和药物性质有关,目前暂无报道,有待进一步研究。

图4 不同浓度磺胺类药物对基质效应的影响Fig.4 Effects of different concentrationonthe matrix effect of ten sulfonamides
2.3.2 不同样品基质基质效应评价 本试验基于不同样品基质对分析结果的影响进行研究,以猪肉、牛奶、鸡蛋三种动物源食品作为研究对象,添加混合标准溶液,10种磺胺类药物的添加量分别为10、25、50、100、250、500 μg/kg,采用组织研磨-QuEChERS前处理方法,选取其中高中低3个浓度点(10、50、250 μg/kg),以确定其基质效应。如表2所示,待测物浓度较低时(低于50 μg/kg),基质效应显著增强,且猪肉的基质增强效应高于牛奶和鸡蛋,牛奶和鸡蛋的基质效应相当。待测物浓度较高时(高于50 μg/kg),基质效应减弱,且猪肉、牛奶和鸡蛋的基质效应相当。

表2 动物源食品中磺胺类药物在UPLC-MS/MS检测下的基质效应Table 2 Matrix effects for UPLC-MS/MS analysis of sulfonamides in animal-originated goods
猪肉中蛋白质和脂肪含量高于牛奶和鸡蛋,碳水化合物含量低于牛奶和鸡蛋,推测亲脂性成分的存在可能是造成磺胺类药物测定基质效应的重要原因。在同一添加浓度下10种磺胺类药物中磺胺间甲氧嘧啶在不同样品基质中差异明显,不同基质间的差异使用(最大值-最小值)/平均值进行计算,其他9种磺胺类药物在不同基质间的差异在20%以内。
2.4 方法学验证
2.4.1 方法的线性范围及检出限 称取猪肉阴性样品,加入混合标准溶液适量,按1.2.2进行前处理,结果表明,10种磺胺类药物在质量浓度范围内均呈现良好的线性关系,R2均大于0.99,以3倍信噪比计算检出限(LOD),10倍信噪比计算定量限(LOQ),结果见表3。方法检出限以及定量限均低于已有文献的报道[2,7,9]。
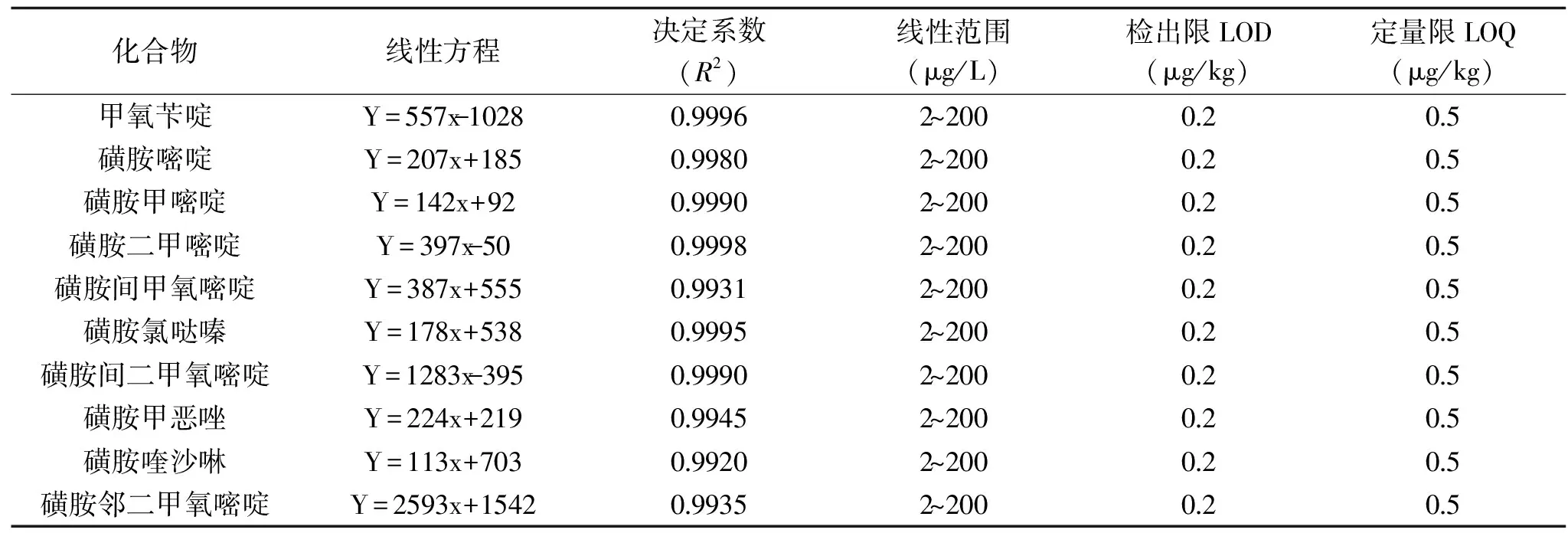
表3 10种磺胺类药物的线性回归方程和相关系数Table 3 Regression equation,correlation coefficient of 10 sulfonamides
2.4.2 方法回收率以及精密度 称取猪肉阴性样品,加入混合标准溶液适量,按1.2.2进行前处理,进行回收率和精密度实验。10种磺胺类药物的添加量分别为10、50、250 μg/kg,每个浓度水平作6个加标实验,使用基质标匹配,考察其回收率以及精密度。结果表明使用基质匹配标准曲线,能够有效的降低基质效应,获得了良好的回收率和精密度,平均回收率在89.4%~111.0%之间,精密度在0.8%~4.9%之间,结果见表4。

表4 猪肉中10种磺胺类药物的加标回收率和相对标准偏差(n=6)Table 4 Recoveries and relative standard deviations(RSDs)of 10 sulfonamides in pork(n=6)
2.5 实际样品分析
利用该方法对兰州市场销售的500批次畜禽肉、牛奶和鸡蛋进行检验,共有11批猪肉样品检出磺胺二甲嘧啶,选取其中1批猪肉,使用国标方法和本方法同时检测,结果见表5,GB/T 21316-2007检出限较高,结果为未检出,农业部1025号公告-23-2008和本试验方法检测值的相对误差为7.5%,该方法简化了国标的前处理方法,操作简单,灵敏度高,适用于动物源食品中磺胺类药物的检测。

表5 本实验方法与其他测定肉类食品中磺胺类药物方法的比较Table 5 Comparison of this method with other methods for the determination of SAs in meat product
3 结论
本实验采用组织研磨-QuEChERS技术结合三重四极杆液质联用仪,对动物源性食品中的磺胺类药物进行分析检测,方法可行。使用组织研磨仪能够有效提取目标化合物,具有高通量、重复性好、方法回收率高、节约体力等特点,通过基质效应分析,适用于动物源性食品中磺胺的检测。动物源性食品基质复杂,组织研磨-QuEChERS技术在检测低浓度样品时(低于50 μg/kg)有明显的基质效益,今后的研究应深入探寻化合物组成与基质效应的关系,部分药物浓度由低到高,其基质效益由基质增强变为基质抑制,初步推测可能和药物性质有关,有待进一步研究。
