转谷氨酰胺酶对大豆分离蛋白酶解物的吸油性与保水性的改善作用
2020-06-19张晓琳徐晨冉韩田露
刘 颖,张晓琳,徐晨冉,王 佳,韩田露,李 聪,张 航
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076)
大豆分离蛋白(Soy protein isolate,SPI)是一种蛋白质含量在90%以上的重要植物蛋白,是具有吸油性、保水性、发泡性、乳化性、凝胶性等多种功能特性的常用食品基料[1-2]。大豆分离蛋白因其较高的营养价值、众多的功能性质和成本低廉的优点,在食品加工领域有着广阔的应用前景[3]。蛋白质的吸油性和保水性是肉制品、面包、蛋糕、冰淇淋等食品加工过程中两项重要的特性和质量控制指标[4]。然而,在这些食品体系中,由于大豆分离蛋白的吸油、保水能力不理想而限制了其在食品工业中的应用,因而越来越多的研究集中在对天然大豆分离蛋白的改性,以期改善其吸油性、保水性[5]。常用的改性方法有物理、化学及酶改性法,其中酶法改性具有高效性、专一性、多样性、温和性和无副产物等优点,对食物营养结构也无破坏作用[6]。
转谷氨酰胺酶(Transglutaminase,TGase)是一种由331个氨基组成的具有活性中心的单体蛋白质,可以催化蛋白质或多肽发生分子内和分子间的共价交联,从而改善蛋白质的结构与功能[7-8],尤其对蛋白质吸油性、保水性、发泡性、热稳定性和凝胶性能等改善效果显著,进而改善食品的口感风味、质地外观等,因此转谷氨酰胺酶在食品加工业中的应用颇受关注[9-10]。将酶水解与酶交联的方法并用,可使大豆蛋白的某些功能特性有更大的提高。Babiker[11]研究了转谷氨酰胺酶催化大豆蛋白酶解物的交联,其起泡性和乳化性有很大的提高,生成的聚合物更耐酸、耐热。Walsh等[12]研究了大豆分离蛋白经水解及TGase交联作用对于蛋白质溶解性的影响,研究表明交联后大豆分离蛋白的溶解性有很大提高。
本实验以大豆分离蛋白(SPI)为原料,通过木瓜蛋白酶酶解获得其酶解物后,再利用转谷氨酰胺酶(TGase)对其酶解物进行交联作用,在不同条件下研究TGase改性对大豆分离蛋白吸油及保水性的影响,采用响应面试验对交联条件进行优化,以期得到吸油性与保水性最优的交联条件,并对改性前后粒径、Zeta电位、自由氨基含量等理化性质与吸油性、保水性之间的相关性进行了探究。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白 临沂山松生物制品有限公司;木瓜蛋白酶(800 U/mg) 北京博奥拓达科技有限公司;转谷氨酰胺酶(130 U/g) 江苏一鸣生物股份有限公司;邻苯二甲醛(OPA) 青岛雅各化学试剂销售有限公司。
BS224S型电子分析天平 赛多利斯科学仪器有限公司;pHS-3C型精密pH计 上海雷磁仪器厂;SY-24型恒温水浴锅 天津欧诺仪器仪表有限公司;202型电热鼓风干燥箱 上海一恒科学仪器有限公司;TG16-WS型台式高速离心机 湖南湘仪实验室仪器开发有限公司;XHF-DY型高速分散器 宁波新芝生物科技股份有限公司;722S型分光光度计 上海光谱仪器有限公司;Malvern激光粒度仪 上海思百吉仪器系统有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白酶解物的制备 取一定量SPI于烧杯中,加入去离子水,配制成质量分数为5%的SPI溶液,室温下搅拌15 min使其混匀,于55 ℃水浴下预热45 min后,加入0.01 mol/L的HCl溶液使其pH维持在6.0,加入8000 U/g木瓜蛋白酶进行酶解,4 h后于90 ℃下灭酶5 min,冷却至室温,用0.01 mol/L的NaOH溶液滴定至pH为7.0,记录消耗的NaOH溶液体积,以控制水解度在6%,获得酶解物后取出,烘干备用[13]。水解度(DH)采用pH-stat法[14]测定。
1.2.2 TGase交联大豆分离蛋白酶解物对其吸油性、保水性的影响 将1.2.1酶解物配制成质量分数为5%的溶液,调整至一定pH后加入一定量的TGase,在一定温度下温度下交联一段时间,交联结束后在80 ℃下灭酶5 min,获得交联物后取出,烘干后测定其吸油性、保水性[15]。
1.2.2.1 TGase添加量 以大豆分离蛋白酶解物溶液为底物,TGase添加量分别10、20、30、40、50 U/g,在pH7.0,交联温度55 ℃,交联时间1 h的条件下进行交联作用,测定TGase改性后样品的吸油性和保水性。
1.2.2.2 pH 以大豆分离蛋白酶解物溶液为底物,分别调节pH至5、6、7、8、9,在TGase添加量20 U/g,交联温度55 ℃,交联时间1 h的条件下进行交联作用,测定TGase改性后样品的吸油性和保水性。
1.2.2.3 交联温度 以大豆分离蛋白酶解物溶液为底物,交联温度分别25、35、45、55、65 ℃,在TGase添加量20 U/g,pH7.0,交联时间1 h的条件下进行交联作用,测定TGase改性后样品的吸油性和保水性。
1.2.2.4 交联时间 以大豆分离蛋白酶解物溶液为底物,交联时间分别0.5、1.0、1.5、2.0、2.5 h,在TGase添加量20 U/g,pH7.0,交联温度55 ℃的条件下进行交联作用,测定TGase改性后样品的吸油性和保水性。
1.2.3 吸油性与保水性的测定 将0.5 g样品与10 mL大豆油或蒸馏水放入已称重的离心管,充分搅拌均匀后静置30 min,于3000 r/min下离心20 min,弃去上层油相或水相,称取离心管及沉淀的总质量[16]。按以下公式计算样品的吸油性(OHC)或保水性(WHC),单位定义为g/g。
式中:M0为样品的质量,g;M1为离心管的质量,g;M2为离心后离心管与所得沉淀的总质量,g。
1.2.4 TGase交联大豆分离蛋白酶解物交联度的测定 使用邻苯二甲醛(OPA)法[17]测定反应体系中自由氨基的含量,以甘氨酸作为标准物[18]绘制标准曲线。TGase作用大豆分离蛋白酶解物的反应程度以交联度表示[19]。
交联度(%)=(原料中自由氨基含量-样品中自由氨基含量)/原料中自由氨基含量
1.2.5 TGase改善大豆分离蛋白酶解物吸油性的响应面优化设计 在相同单因素条件下,TGase对SPI酶解物的保水性改善作用较弱,而对吸油性改善效果理想,因此采用Design Expert 10实验设计及统计分析软件中的Box Behnken程序,以吸油性为指标,进行响应曲面优化实验。并结合单因素实验结果确定酶添加量、pH、交联温度和交联时间四个主要考察因素的水平取值范围,水平编码见表1。

表1 响应面优化吸油性的因素水平编码表Table 1 Factors and levels in response surface design
1.2.6 粒径与Zeta电位的测定 分别取0.1 g SPI原料、SPI酶解物和不同交联时间下的样品溶解于10 mL去离子水中,使用高速分散器均质(5000 r/min,2 min)使其完全混合,离心后(3000 r/min,10 min)取上清液,用0.45 μm膜过滤后,测定粒径及Zeta电位[20]。
1.2.7 自由氨基含量的测定 分别取SPI原料、SPI酶解物和不同交联时间下的样品稀释到一定倍数,取100 μL,使用OPA法[17]测定反应体系中自由氨基含量。
1.3 数据处理
采用Microsoft Office Excel 2007软件绘图,SPSS Statistics 17.0软件统计分析实验数据,每组实验均重复3次,数据结果以平均值±标准偏差表示,采用t检验,当P<0.05 时,表示差异显著。
2 结果与讨论
2.1 TGase改善SPI酶解物吸油性、保水性
2.1.1 SPI原料及SPI酶解物吸油性、保水性测定结果 经过测定与计算,SPI原料的吸油性与保水性分别为3.73和14.52 g/g;SPI酶解物的吸油性与保水性分别为3.98 和14.82 g/g。
2.1.2 交联度测定结果 在TGase添加量20 U/g,pH7.0,交联温度55 ℃,交联时间分别0.5、1.0、1.5、2.0、2.5 h的条件下,测得交联度分别为33.85%、46.46%、66.14%、52.36%、52.75%。
2.1.3 TGase交联SPI酶解物对其吸油性、保水性的影响
2.1.3.1 加酶量对TGase改善SPI吸油性、保水性的影响 图1所示,随着酶添加量的增加,交联样品的吸油性和保水性也随之增强,当酶添加量为20 U/g时均达到最大,分别为5.38和13.83 g/g,而后呈现下降趋势。原因可能是TGase酶的加入使蛋白分子之间发生交联作用,当加酶量达到20 U/g时,SPI酶解物中存在的小分子几乎全部被交联成大分子并形成网状结构,有利于对油和水的束缚,所以吸油性和保水性提高。但TGase酶的过度加入使反应体系中SPI酶解物的纯度下降,限制蛋白分子之间网状结构的形成,不利于持油与持水。研究表明,随着 TGase 酶用量的增加,蛋白会有所膨胀,持油性减小[21]。因此酶添加量为20 U/g较为适宜。

图1 加酶量对TGase交联SPI酶解物吸油性、保水性的影响Fig.1 Effect of TGase addition amount on the oil absorptionand water retention of TGase crosslinked SPI hydrolysates
2.1.3.2 pH对TGase改善SPI吸油性、保水性的影响 图2所示,交联样品的吸油性和保水性均先升高后降低,当pH为7.0时达到最大,分别为5.39和13.86 g/g。由此可分析出,pH对TGase交联SPI酶解物的吸油性和保水性均有影响。pH影响转谷氨酰胺酶的活性和稳定性,过酸或过碱会降低转谷氨酰胺酶的活性,不适宜交联作用的发生,中性环境是转谷氨酰胺酶交联作用的最佳条件[22],因而pH越接近于7.0,其吸油性和保水性越好。另外,pH影响蛋白的溶解性,会改变其网状结构[23],酸碱条件下交联样品的网状结构空隙变大,从而导致其吸油性和保水性的变化。因此交联反应的较优pH为7.0。
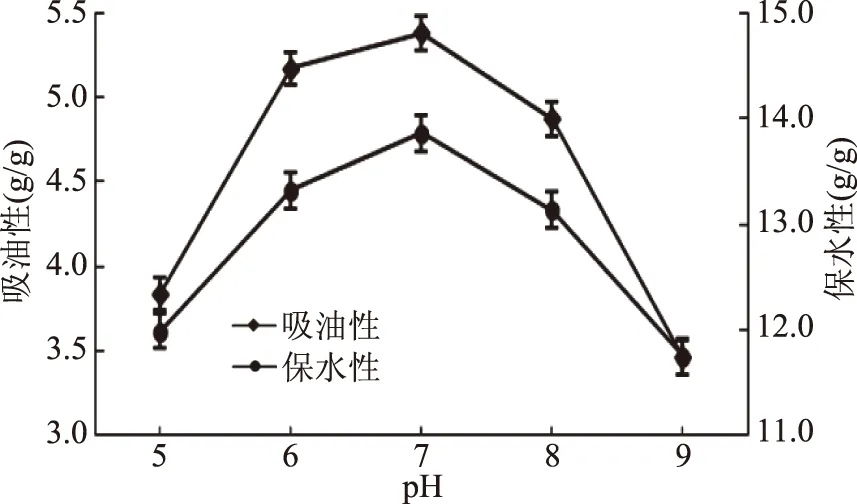
图2 pH对TGase交联SPI酶解物吸油性、保水性的影响Fig.2 Effect of pH on the oil absorption and waterretention of TGase crosslinked SPI hydrolysates
2.1.3.3 交联温度对TGase改善SPI吸油性、保水性的影响 图3所示,吸油性随着温度的升高而增大,当温度为55 ℃时达到峰值,为5.40 g/g,而后有所下降。之所以出现此趋势可能是因为在低温时,TGase的酶活也较低,不利于交联,而温度过高又会使TGase逐渐失活,同时导致反应体系不稳定或蛋白结构发生改变[24],从而使交联反应不能顺利进行,吸油性降低。因此TGase改善SPI酶解物吸油性的最佳交联温度受酶的活性、原料结构和反应体系等原因影响,55 ℃较为适宜。
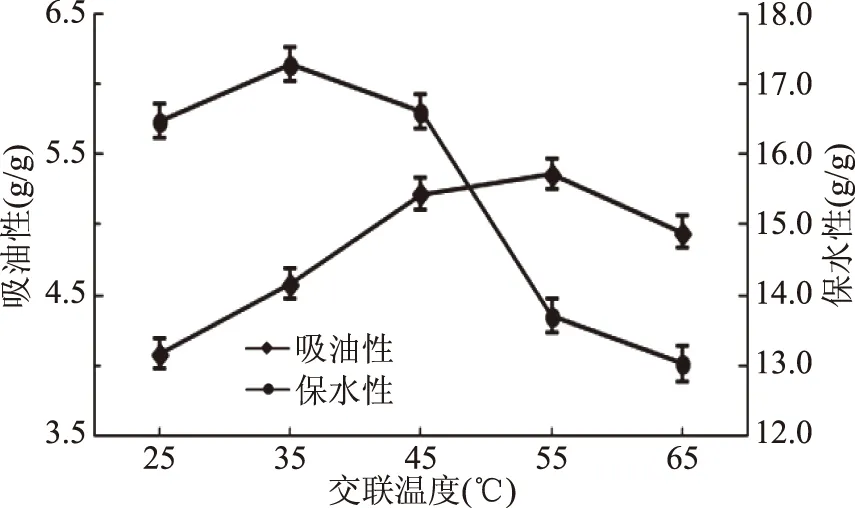
图3 交联温度对TGase交联SPI酶解物吸油性、保水性的影响Fig.3 Effect of crosslinking temperature on the oil absorptionand water retention of TGase crosslinked SPI hydrolysates
保水性在低于45 ℃的交联条件下较为平缓,35 ℃时达到峰值,为17.28 g/g,当交联温度高于45 ℃后急剧下降,说明较低的温度有利于TGase改善SPI酶解物的保水性。一方面可能是因为温度的高低影响着TGase的酶活,从而影响交联程度。另一方面在交联过程中,蛋白侧链的亲水基向水相移动,疏水基向油相移动,温度的高低则影响着基团移动速率,从而导致其疏水性改变[25]。因此,在多重原因的共同作用下,得到TGase改善SPI酶解物保水性的较佳交联温度为45 ℃。
2.1.3.4 交联时间对TGase改善SPI吸油性、保水性的影响 图4所示,随着交联时间的延长,交联样品的吸油性和保水性均随之增强,交联时间1.0 h时达到最大值,分别为5.40和13.20 g/g,而后下降。原因可能是反应时间太短,则不能将SPI酶解物很好交联,还未形成良好结构,所以持油和持水能力较低。随着时间延长,蛋白分子之间逐渐交联成稳定的网状结构[26],益于对油和水的束缚。当交联的时间过长,形成的稳定结构又会遭到不同程度的破坏,从而导致吸油和保水能力变差,因此交联时间不宜过短或过长,1.0 h最为合适。
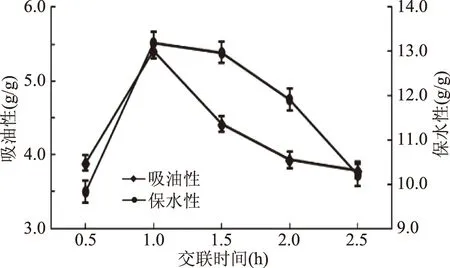
图4 交联时间对TGase交联SPI酶解物吸油性、保水性的影响Fig.4 Effect of crosslinking time on the oil absorptionand water retention of TGase crosslinked SPI hydrolysates
2.2 TGase改善SPI酶解物吸油性的响应面优化设计结果分析
通过单因素实验发现,TGase可以改善SPI酶解物的吸油性,但保水性只有在加酶量为20 U/g,pH为7.0,交联时间为1 h,温度分别为25、35、45 ℃的条件下,较SPI和SPI酶解物有所提高。因此只对TGase改善SPI酶解物吸油性进行响应面优化设计。
2.2.1 试验结果及模型方差分析 响应面试验结果见表2,以回归系数建立大豆分离蛋白酶解物吸油性(Y)与酶添加量(X1)、pH(X2)、交联温度(X3)、交联时间(X4)的响应面回归方程为:
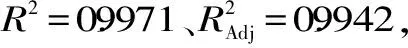
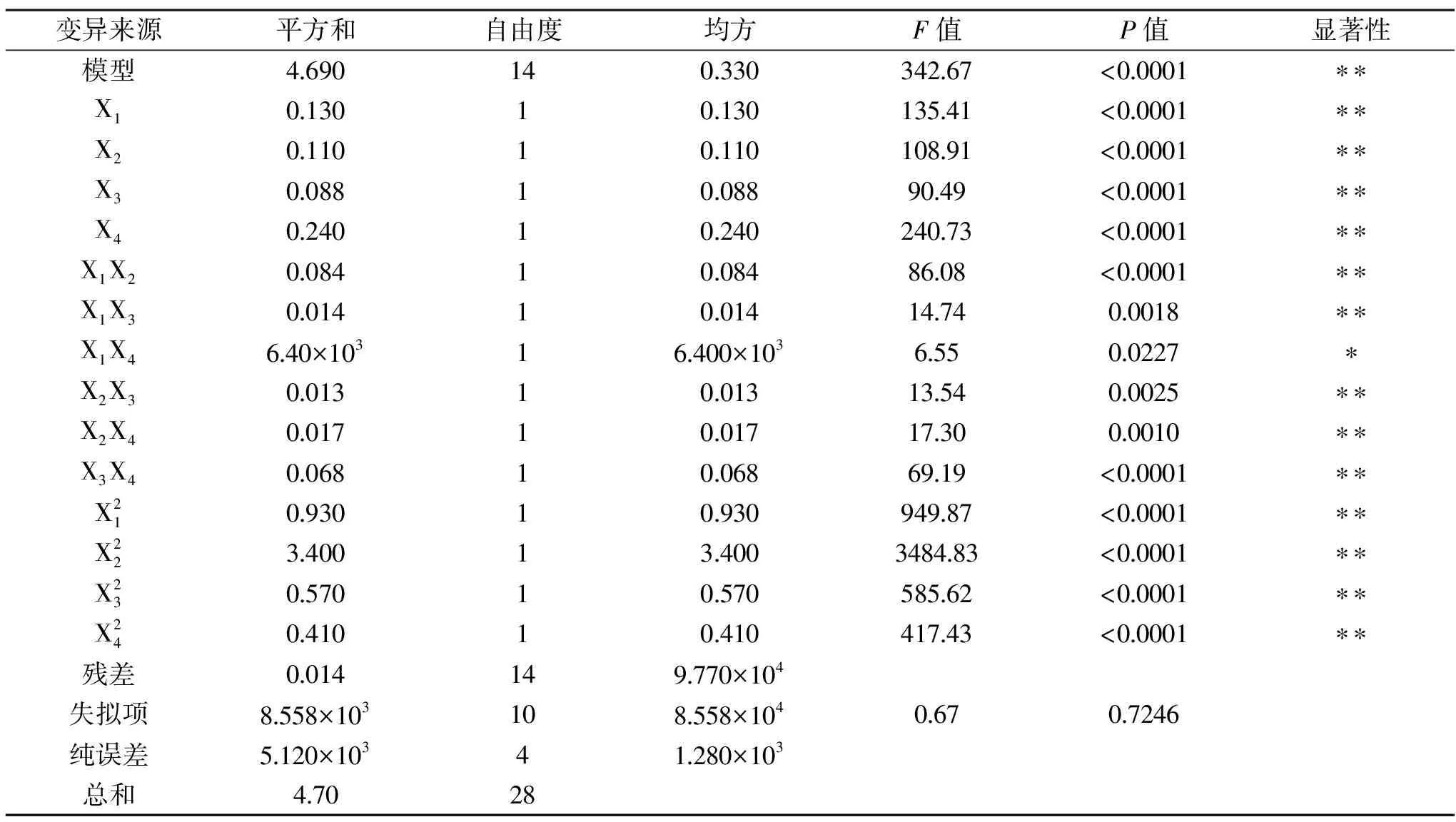
表3 响应面试验设计结果方差分析Table 3 Variance analysis of response surface design
2.2.2 因素交互作用响应面分析 结合二次回归方程及表3可知,二次项X1X4具有显著的交互作用(P<0.05),X1X2、X1X3、X2X3、X2X4、X3X4的交互作用极为显著(P<0.01)。通过3D响应面与等高线可以解释说明自变量与因变量之间的关系,如图5~图10所示。

图5 加酶量与pH交互作用对吸油性的影响Fig.5 Effect of interaction betweenenzyme addition and pH on oil absorption
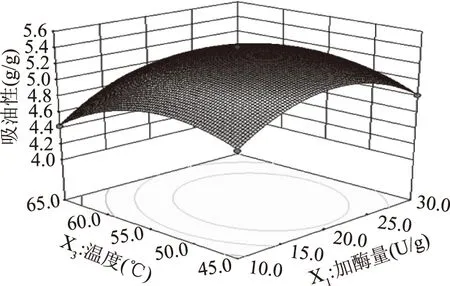
图6 加酶量与温度交互对吸油性的影响Fig.6 Effect of interaction betweenenzyme addition and temperature on oil absorption

图7 加酶量与时间交互作用对吸油性的影响Fig.7 Effect of interaction betweenenzyme addition and time on oil absorption
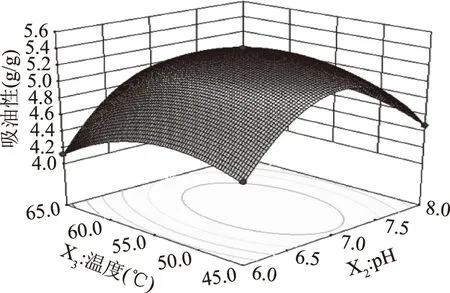
图8 pH与温度交互作用对吸油性的影响Fig.8 Effect of interaction betweenpH and temperature on oil absorption
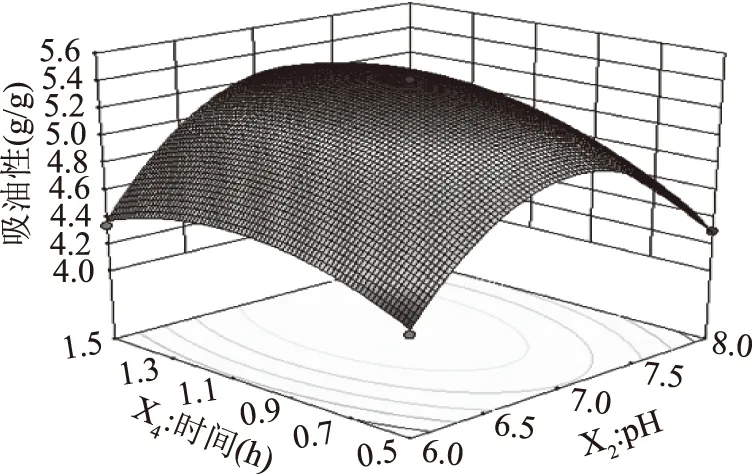
图9 pH与时间交互作用对吸油性的影响Fig.9 Effect of interaction betweenpH and time on oil absorption
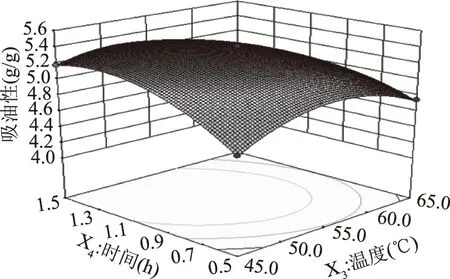
图10 温度与时间交互作用对吸油性的影响Fig.10 Effect of interaction betweentemperature and time on oil absorption
比较酶添加量、pH、交联温度、交联时间四因素的两两交互作用对大豆分离蛋白酶解物吸油性的影响结果发现,响应值呈现抛物线形趋势,均先升高后降低,因此回归方程存在极大值。得到TGase改善SPI酶解物吸油性最优条件:酶添加量21.2 U/g、pH7.1、交联温度53.0 ℃、交联时间1.2 h,重复试验3次并计算出吸油性平均值为5.41 g/g,与理论预测值5.416 g/g相比,其相对误差为0.111%,说明该模型拟合情况良好,结果可靠。
2.3 吸油性、保水性与理化性质之间的相关关系
2.3.1 粒径与吸油性、保水性之间的相关性分析 SPI经酶解后粒径减小,而TGase的交联作用又使SPI酶解物的粒径增大,通过SPSS软件中相关性分析得出,粒径大小与吸油性之间并不存在相关性(r=0.097,P>0.05),如图11a。而粒径大小与保水性之间存在着显著负相关(r=-0.865,P<0.01),如图11b所示,这与杨峰等[27]得出的结论一致。
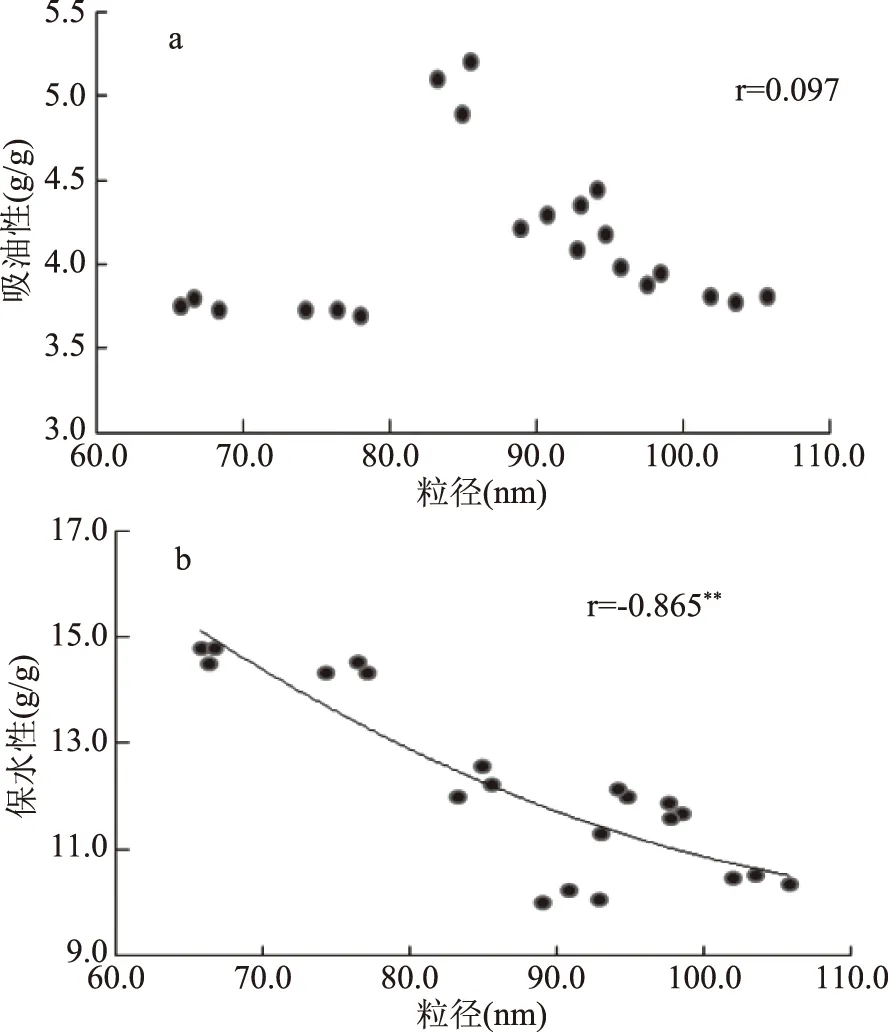
图11 粒径与吸油性、保水性之间的相关性Fig.11 Correlation between particle sizeand oil absorption and water retention
2.3.2 Zeta电位与吸油性、保水性之间的相关性分析 图12a所示,可以看出随着Zeta电位绝对值的增加,其吸油性会出现明显的上升趋势。通过相关性分析得出,Zeta电位绝对值的大小与吸油性之间呈显著正相关(r=0.878,P<0.01)。但Zeta电位绝对值的大小与保水性之间呈负相关(r=-0.531,P<0.05),如图12b所示。
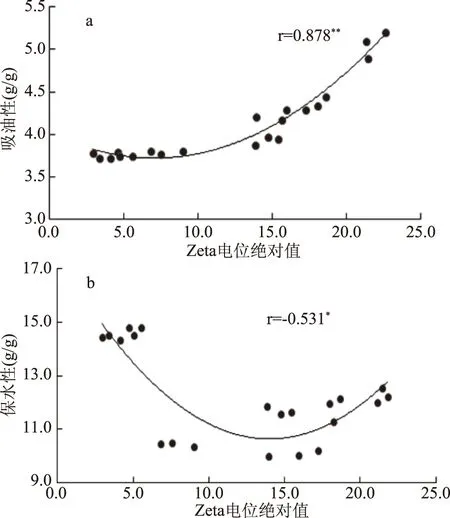
图12 电位与吸油性、保水性之间的相关性Fig.12 Correlation between zeta potentialand oil absorption and water retention
2.3.3 自由氨基含量与吸油性、保水性之间的相关性分析 图13a为自由氨基含量与吸油性之间的关系。由SPSS软件中相关性分析得出,自由氨基含量与吸油性之间呈显著负相关(r=-0.595,P<0.01)。SPI经酶解后自由氨基的含量会增加,再进行不同时间条件下的TGase交联,产物的自由氨基含量变化不同[28]。经TGase改性后的产物自由氨基含量会有所降低,出现此现象是由于TGase是能够催化酰基转移反应的酶,在发生交联作用时会对蛋白质分子产生脱氨作用,从而将肽段上的氨基转变为NH3脱离体系[29]。其次TGase使蛋白质分子赖氨酸上ε-氨基和谷氨酸上的γ-羟酰胺基结合,使得蛋白质分子内或分子间形成ε-(γ-谷氨酰)-赖氨酸肽键,导致自由氨基含量降低[30]。自由氨基含量少,吸油性反而大。自由氨基含量的变化引起其吸油性的显著变化,说明自由氨基的含量可以影响其吸油性能,同时也印证了交联作用的发生。通过分析图13b中自由氨基的含量与保水性相关关系发现,保水性与自由氨基含量之间的相关性较差,自由氨基含量的变化并未导致其保水性能显著的升高或降低。由相关性分析可得出,自由氨基含量与保水性之间无相关性(r=0.062,P>0.05)。

图13 自由氨基含量与吸油性、保水性之间的相关性Fig.13 Correlation between free amino contentand oil absorption and water retention
3 结论
以大豆分离蛋白为实验原料,通过木瓜蛋白酶酶解获得酶解物后,再利用转谷氨酰胺酶在不同条件下交联,结合响应面优化试验确定TGase添加量21.2 U/g、pH7.1、交联温度53.0 ℃、交联时间1.2 h为最优条件,此时吸油性为5.41 g/g,较TGase改性前的SPI酶解物提高35.93%,较SPI原料提高45.04%。
在相同的单因素条件下,发现TGase对SPI酶解物保水性的改善作用较弱,只有当TGase添加量20 U/g、pH7.0、交联时间1.0 h、温度分别为25、35、45 ℃时,保水性高于SPI原料及SPI酶解物,保水性分别为16.48、17.28、16.61 g/g,在交联温度35 ℃时保水性最大,较TGase改性前的SPI酶解物提高16.60%,较SPI原料提高19.01%。
通过分析粒径、Zeta电位、自由氨基含量与吸油性、保水性之间的关系,发现粒径大小与吸油性之间不存在相关性,与保水性之间存在着显著负相关。Zeta电位绝对值的大小与吸油性之间呈显著正相关,与保水性之间呈负相关。自由氨基含量与吸油性之间呈显著负相关,与保水性之间无相关性。
