基质金属蛋白酶抑制因子- 2 基因-418G/C 多态性与房颤性脑梗死患者出血转化风险的相关研究
2020-06-18李卫玲金笑平虞丹沈玉光
李卫玲 金笑平 虞丹 沈玉光
2013 年,脑卒中已经跃居成为我国首位威胁人类健康的疾病[1]。国内最新的流行病学研究表明[2],在过去的30 年,国人脑卒中患病率为每年1114.8/10 万人,发病率和死亡率分别为每年246.8/10 万人和114.8/10 万人,其中急性缺血性脑卒中占每年新发脑卒中的69.6%,占脑卒中患病人群的77.8%。出血转化是急性脑梗死自然病程的一部分,也是常见的并发症之一。出血转化定义为脑梗死后首次头颅CT/MRI 未发现出血,再次头颅CT/MRI 检查发现颅内出血,或根据首次头颅CT/MRI 可以确定是出血性梗死[3]。一旦出现出血转化,可使脑梗死患者产生用药矛盾,病情进展恶化。目前研究发现,心源性脑卒中可增加出血转化风险,尤其心房颤动引起的脑梗死患者[4]。
有研究认为,脑梗死缺血发生后细胞外基质金属蛋白酶(matrix metalloproteinase,MMPs)激活降解细胞外基质(包括胶原蛋白、层黏蛋白),破坏血脑屏障,是导致出血转化的病理机制之一[5]。而组织金属蛋白酶抑制因子(tissue inhibitor of metalloproteinase,TIMPs)作为MMPs 的主要生理性抑制剂,势必参与了这一过程。现有的研究表明,MMP-2、MMP-9在脑梗死后出血转化过程中起到至关重要的作用[6-7]。笔者前期的研究发现TIMP-2 基因-418G/C位点(rs8179090)的多态性与房颤性脑梗死遗传易感性相关,而其是否参与了房颤性脑梗死出血转化目前鲜有报道。本研究旨在探讨TIMP-2 基因-418G/C 多态性与房颤性脑梗死出血转化的相关性,现报道如下。
1 对象和方法
1.1 对象 选择2016 年1 月至2018 年12 月在本院神经内科首次因脑梗死住院的患者272 例,住院期间未启动抗凝治疗前符合《中国急性脑梗死后出血转化专家共识2019》诊断标准[3]的出血转化患者63 例(出血转化组),年龄39~89(67.94±13.01)岁;无出血转化患者209 例(非出血转化组),年龄40~88(67.57±13.76)岁,两组患者性别、年龄比较差异均无统计学意义(均P>0.05),饮酒史、入院行美国国立卫生院卒中量表(National institute of health stoke scale,NIHSS)评分、收缩压、舒张压、纤维蛋白原比较差异均有统计学意义(P<0.05 或0.01),见表1。纳入标准:首次未接受静脉和(或)血管内治疗的脑梗死患者,发病至入院时间在24h 内,均进行头颅MRI+颅脑弥散加权,心电图或动态心电图检查,符合心源性脑卒中的诊断标准[8]。排除标准:肿瘤性卒中、出血性卒中、脑血管畸形、颅内动脉瘤、系统性炎性疾病及自身免疫性疾病、严重外伤(6 个月内)、严重感染(6 个月内)、6 个月内使用糖皮质激素及免疫抑制剂、肝肾疾病、甲状腺疾病、结核、恶性肿瘤、外周血管病、妊娠者和入院前1 个月服用抗血小板药物、抗凝药物和降血脂药物患者。本研究经医院伦理委员会批准,所有研究对象均知情同意。所有患者住院期间首先使用抗血小板病聚集治疗,待病情平稳后根据病情酌情抗凝治疗。
1.2 方法
1.2.1 标本采集 入院第2 天抽取所有患者清晨空腹静脉血2ml,以EDTA-Na2 抗凝,用于基因组DNA提取,保持于-80℃冰箱中冻存备用。人血液基因组DNA 提取试剂盒(离心柱型)、dNTP(10Mm each)、Taq DNA 聚合酶等购自上海捷瑞公司;2×MasterMix购自北京天根生化科技有限公司,限制性内切酶Eco88 I 及其缓冲液为New England Biolabs 公司产品,PCR 产物纯化试剂盒购自上海捷瑞公司,引物由上海基康公司合成(软件Primer5.0 设计引物)。
1.2.2 基因检测方法 (1)DNA 提取:采用低渗溶血-酚-氯仿法从白细胞中提取基因组DNA,适量灭菌双蒸水溶解,核酸定量分析仪测定DNA 浓度和A260/A280 比值,将比值位于1.7~2.0 者作为PCR扩增模板。(2)PCR 扩增TIMP-2 启动子区-418G/C位点及其侧翼区,上游引物:5’-CGTCTCTTGTTGGCTGGTCA-3’,下游引物:5’-CCTCAGTCGACTCTGGAG-3’。PCR 反应体系为上下游引物0.5μl+0.5μl(各20μmol/L),2×MasterMix12.5μl,DNA 模 板0.1μg,加双蒸水至总体积25μl。PCR 反应条件:预变性95℃,2min;变性94℃,45s;退火53℃,30s;延伸72℃,45s,共28 个循环,吸取扩增产物6μl,于1.5%琼脂糖凝胶电泳,溴化乙锭染色,凝胶成像分析PCR 产物特异性。(3)酶切反应:取经纯化后的PCR 产物进行酶切,反应体系包括PCR 产物1μg,10×缓冲液2μl,限制性内切酶Eco88 I 10U,加双蒸水至总体积20μl,置37℃水域酶切16h 后,终止酶切反应,产物经2.5%琼脂糖凝胶电泳后,EB 染色,凝胶成像系统判定结果。
1.3 统计学处理 采用SPSS22.0 统计软件。符合正态分布的计量资料以表示,两组比较采用t检验;不符合正态分布的计量资料以中位数M(P25~P75)表示,组间比较采用Wilcoxon 秩和检验;采用非条件性logistic 回归法筛选房颤性脑梗死患者出血转化的危险因素。采用基因计数法计算两组基因型和等位基因频率,等位基因频率=(2×纯合子数+杂合子数)/(2×受检人数),频率比较采用χ2检验,采用OR及95%CI表示相对危险度。P<0.05为差异有统计学意义。
2 结果
2.1 TIMP-2-418G/C 基因型PCR 检测结果 见图1。
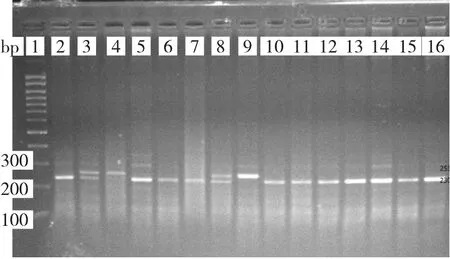
图1 TIMP-2PCR 扩增产物经限制性内切酶Eco88 I 酶切图[泳道1为100bp DNA 标志物;泳道3、8 为GC 基因型(253bp、230bp、51bp 和23bp);泳道4、9 为CC 基因型(253bp、51bp);泳道2、5-7、10-16 为GG 基因型(230bp、51bp、23bp),其中51bp、23bp 已跑出胶外,故图中未显示]
由图1 可见,TIMP-2 PCR 扩增产物为304bp,经限制性内切酶Eco88 I 酶切后,纯合子GG 基因型可见230bp、51bp、23bp 3 个条带,纯合子CC 基因型可见253bp、51bp 2 个条带,杂合子GC 基因型可见253bp、230bp、51bp 和23bp 4 个 条 带,其 中51bp、23bp 的片段由于分子质量小,泳动速度快,已跑出胶外,故图中未显示。
2.2 两组间基因型频率和等位基因频率比较 见表2。
由表2 可见,出血转化组和非出血转化组的TIMP-2 基因型分布,符合Hardy-Weinberg 平衡,表明研究对象具有群体代表性(χ2=2.205、2.520,均P>0.05)。出血转化组中GC+CC 基因型频率及C 等位基因频率与非出血转化组比较差异均无统计学意义(OR=0.864、0.879,均P>0.05)。
2.3 房颤性脑梗死患者出血转化的危险因素分析见表3。
由表3 可见,两组最终进入模型的危险因素为首次收缩压、入院NIHSS 评分(P<0.05 或0.01)。

表2 两组间基因型和等位基因频率比较[例(%)]
3 讨论
出血转化是急性脑梗死自然病程的一部分,也是常见的并发症之一,会导致脑卒中临床症状恶化,加速死亡发生。在一项对245 例未使用溶栓和抗凝治疗的脑梗死患者尸检发现,自发性出血转化发生率为29%[9]。THRACE 研究发现,血管内治疗后出血转化发生率为46%[10],Hao 等[11]研究统计,血管内治疗后出血转化发生率为49.5%。目前研究发现,心源性脑卒中会增加出血转化风险,尤其是心房颤动引起的脑梗死患者[4]。因此,如何从出血转化发生、发展的病理机制出发,对易发生出血转化的患者进行筛选,并施以有效的措施加以预防,对挽救患者生命,降低病死率至关重要。
出血转化发生的病理机制理论研究众多,但确切的发生机制仍不明确。目前被广泛认可的病理机制可能与梗死后缺血损伤[12]、再灌注损伤[13]、凝血功能紊乱[14]、血脑屏障破坏[15]等理论相关。其中血脑屏障破坏理论与MMPs 密切相关,现有研究发现,MMP-2(又称明胶酶-A)在脑梗死后攻击血脑屏障毛细血管内皮下基底膜并降解细胞外基质成分中胶原成分、弹性蛋白等,破坏其完整性,造成血脑屏障通透性增加,促发脑水肿形成、继发性脑出血和神经细胞损伤[6]。Wang 等[7]研究发现,MMP-9 水平与迟发性出血转化有关,且出血量大小与基础MMP-9 水平有关。而作为MMPs 生理性抑制剂TIMPs 势必也参与了出血转化过程。TIMP-2 位于17q23-25 染色体上,是一种相对分子量为21kd 的非糖基化蛋白,含有192 个氨基酸, 可以抑制任意一种MMPs 特异性结合。Krizanac-Bengez 等[16]构建的体外血流灌注血脑屏障模型研究表明,再灌注血流情况下MMP-2、MMP-9 活性提高,TIMP-1 活性部分降低,而TIMP-2 活性完全降低,最终导致血脑屏障通透性增加。近年来,随着基因水平的深入研究,引起蛋白结构缺陷或影响TIMP-2 转录效率的单核苷酸多态性(single nucleotide polymorphisms,SNPs)可能参与脑血管病的发生、发展。现有研究发现,TIMP-2 基因-261G/A 多态性与自发性脑出血的患病风险相关[17]。在缺血性脑卒中方面,Tie 等[18]研究发现,TIMP-2的6 个基因多态性位点(rs2277698、rs2009196、rs7342880、rs11654470、rs2003241、rs4789936)变化与中国南方汉族大动脉粥样硬化性脑梗死人群存在相关性。另外,Park 等[19]研究表明,TIMP-2 启动子-418 位点GC+CC 基因型是烟雾病流行的遗传易感因素。而对于TIMP-2 基因-418G/C 位点(rs8179090)多态性是否与心房颤动引起的缺血性卒中患者出血转化相关尚未明确。
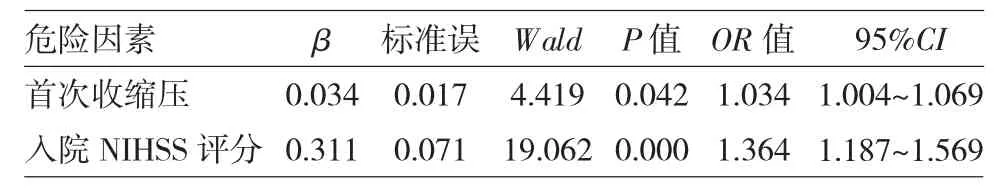
表3 房颤性脑梗死患者出血转化的危险因素分析
本团队前期研究发现,TIMP-2 基因-418G/C位点(rs8179090)的多态性与房颤性脑梗死遗传易感性相关。而在本研究中,272 例房颤性脑梗死患者发生自发性出血转化患者占23.2%,G→C 突变两组间差异无统计学意义。但是,本文一般临床资料比较显示,出血转化组患者收缩压、舒张压、饮酒史、入院NIHSS 评分及纤维蛋白原与非出血转化组比较差异均有统计学意义,这与Whiteley 等[20]的研究相符。本研究还显示,NIHSS 评分为独立的预测出血转化的危险因素,NIHSS 评分越高,说明卒中严重程度越高,出血转化的概率就越大,这也与Tan 等[21]研究相符。
虽然,现有研究发现遗传因素如α2 巨球蛋白、凝血因子XⅡ和XⅢ基因以及白细胞相关6 种基因(双调蛋白、C3HC4 锌指蛋白、SMAD4 蛋白、磷酸肌醇-5-磷酸酶、人多种凝血因子缺乏蛋白2 和血管内皮生长因子Ⅰ)[22]与出血转化可能相关,但TIMP-2 基因-418G/C 位点多态性的变化并未成为预测出血转化的潜在遗传易感基因,这可能因为脑梗死出血转化的发生是多因素共同作用所导致[12-15],并不是单一因素可以直接造成的。另外,患者既往颅内白质疏松情况也与出血转化发生可能相关[20]。况且,TIMP-2 启动子区多态性位点众多,相互之间是否存在干扰也有待进一步研究。因此,如何在众多的相关因素中筛选出简单、易行、方便的预测因子也将成为我们日后研究的方向。
综上所述,在本研究结果表明,TIMP-2 基因-418G/C 多态性与房颤性脑梗死患者出血转化风险无关,但首次收缩压高、高NIHSS 评分可能为房颤性脑梗死患者出血转化的危险因素。