无导线起搏器研究进展
2020-06-18沈法荣何浪
沈法荣 何浪
自1958 年以来,心脏起搏器领域取得了很大的进展,起搏导线从材料到工艺有了较大的进步;脉冲发生器的体积越来越小,电池寿命越来越长,功能越来越智能化,从单腔起搏器到双腔起搏器,从非生理性到生理性起搏,从治疗心动过缓到抗心动过速、治疗心力衰竭的同步化治疗。近来还破解了心脏起搏器不能兼容磁共振的难题,全系列的磁共振兼容起搏器已应用于临床。但传统起搏器存在着一些无法解决的问题,如起搏导线脱位、磨损,起搏器囊袋破溃、感染,皮肤局部瘢痕影响美观和心理健康等。同时,部分患者因病情和静脉系统的缺陷根本无法植入传统起搏器,从而丧失了起搏治疗的机会。因此,摒弃传统起搏导线成为近年来起搏器技术发展的热点之一。
1 传统起搏器的不足
传统起搏器由脉冲发生器及导线构成。脉冲发生器囊袋感染及导线相关并发症是传统起搏器应用中不可回避的问题。研究表明,植入起搏器的患者发生起搏器感染的比例高达0.67%[1],而且每次更换会增加感染的风险[2-4]。一旦发生感染,起搏系统必须移除,使得患者面临拔除术中心脏破裂等风险。据统计,导线植入2~6 个月,并发症发生率高达1.4%~9.5%,主要与起搏器和(或)导线的植入有关[5-6]。另一项研究表明,5.2%的植入起搏器患者会发生导线故障[7]。导线故障会导致阈值升高、失夺获等事件,严重危及患者生命安全。
起搏导线通常经静脉穿刺植入心腔,可能导致气胸、血气胸等并发症。起搏导线还可能增加血栓风险,患者出现植入侧上肢肿胀或疼痛;多根起搏导线植入还可造成血管狭窄和阻塞,有时需要拔除导线才能改善;起搏导线绝缘层损伤引起起搏阈值和阻抗异常,甚至出现起搏导线断裂而不起搏[8]。此外,起搏导线还可能损伤三尖瓣瓣叶,引起三尖瓣关闭不全,也是不容忽视的问题[6]。以上诸多问题已成为传统起搏器进一步改进面临的瓶颈。随着对起搏器研究的不断深入,为了解决特殊患者起搏器囊袋和导线所致的并发症,无导线起搏器应运而生。
2 无导线起搏器的发展历程
针对传统起搏器应用中的不足,相关研究者提出无导线起搏器概念,并成为新的研究热点。早在20 世纪60 年代,人们就开始对无导线起搏器的可行性进行探索。Spickler 等[9]首先成功将无导线起搏器植入犬的右心室中,但由于电池技术的限制未能应用于临床。Goto 等[10]设计了可自动将机械能转化为电能的起搏装置,其产生的电能可驱动起搏器以140 次/min 的频率起搏心室。随着电池技术的进步,高能量密度锂电池应用于无导线起搏器[11]。Koruth 等[12]成功将无导线起搏器植入10 只羊的右心室,起搏时间达90d,并验证了无导线起搏器应用于羊模型中的有效性。
近10 年来,随着工艺技术、高密度能量电池、程控技术及低能耗电子元器件的发展,无导线心脏起搏技术得到进一步的发展。2012 年雅培-圣犹达公司的Nanostim 无导线起搏器(leadless cardiac pacemaker,LCP) 以及2013 年美敦力公司开发的Micra 经皮起搏系统(transcatheter pacing system,TPS)成为当前无导线心脏起搏技术的先驱产品。两款起搏器的面世使无导线起搏成为现实。
3 无导线起搏器的类型和特性
3.1 LCP LCP 长4.14cm,宽0.59cm,重约2g,预期使用寿命可达9~10 年(电池容量248mAh),起搏模式为VVI/VVIR。主动固定方式,其尾端保留接口,以便对起搏器进行位置调整或拔除。在X 线引导下经股静脉穿刺,经由18F 鞘管,使用可调弯递送系统将起搏器植入右心室;LCP 顶部有类似螺旋电极的固定装置,可拧入心肌固定于右心室,经能量转换的无导线起搏通过超声或电磁能量转换成为起搏电脉冲。LCP 通过内置温度传感器进行运动感知,可随温度变化改变起搏心率,均具有良好的频率适应性[13-14]。
3.2 TPS TPS 长2.59cm,宽0.66cm,重约2g,体积较LCP 更小,预期使用寿命可达7~15 年(在1.5 V/0.24ms、60 次/min、阻抗500Ω、100%起搏比率下的预测电池寿命为9.6 年),起搏模式为VVI/VVIR,兼容1.5T 及3.0T 磁共振检查。TPS 与LCP 作用及操作方式相似,但只能通过23F 鞘管植入,顶端有4个镍钛固定翼,释放展开后尖端朝向心腔内,起固定作用。在这两种无导线起搏系统中,阴极均位于起搏器的远端,且均包含类固醇涂层以减少局部炎症反应。TPS 无导线起搏器最佳固定位置为右心室间隔部,其次为右心室心尖部,但应尽量避免固定于右心室游离壁,以降低心肌穿孔的风险。图1 为LCP 和TPS 的外观,表1 为其相关参数。2019 年6月在中国上市。

图1 NanostimTM 起搏器与MicraTM 起搏器的外形与大小
表1 NanostimTM 与MicraTM 两款无导线起搏器的比较
4 无导线起搏器的安全性和有效性研究
2013 年Reddy 等[15]首次进行了Nanostim LCP在人体中的安全性和有效性的临床研究,共入选33例患者,32 例患者植入无导线起搏器(成功率97.0%);随访90d,2 例(6.1%)发生严重不良事件,1例患者出现心脏穿孔,进行外科手术治疗,5d 后因卒中死亡,另1 例患者经未闭卵圆孔将无导线起搏器植入左心室,后成功取出重新植入右心室。在接下来的Leadless Ⅱ非随机临床研究中,共纳入了527 例患者,植入成功率为95.8%;随访12 个月,起搏感知参数良好,90%以上的患者符合既定要求(即R 波振幅≥5.0mV,输出阈值≤2.0V/0.4ms),其中平均R 波振幅(9.2±2.9)mV,起搏阈值(0.58±0.31)V/0.4ms;不良事件发生率为6.5%,其中心脏穿孔8例,起搏器移位6 例,因阈值升高将起搏器拔除4例,血管穿刺并发症(如出血、动静脉瘘、假性动脉瘤等)发生率1.2%[16]。
2013 年12 月开始的Micra TPS 研究是一项前瞻性、非随机、多中心临床研究,共入选725 例患者,将来自6 个临床实验的2 667 例患者作为历史对照组,99.2%(719/725 例)的患者成功植入无导线起搏器,随访6 个月,98.3%的患者输出阈值≤2.0V,其中平均起搏阈值、R 波振幅、起搏阻抗于植入时分别为0.63V/0.24ms、11.2mV、724Ω,6 个月随访时分别为0.54V/0.24ms、15.3mV、627Ω,各项参数于随访过程中均趋于稳定;严重并发症发生率为4%,其中静脉穿刺并发症发生率为0.7%,血栓栓塞并发症发生率为0.3%,心脏穿孔或心包压塞发生率为1.6%,但未出现起搏器移位和感染并发症[17]。随访6 个月,与传统的起搏系统相比,Micra TPS 起博器降低主要并发症发生率51%。Duray 等[18]报道,随访至1 年,无并发症率稳定在96%,新增的4 例并发症患者中,3 例为新发的心功能不全,1 例为起搏器综合征,无起搏器移位、程控失败及感染并发症发生,与历史对照组相比,主要并发症降低了48%。
总体来说,LCP 和TPS 两种无导线起搏器植入成功率高,电学参数稳定,并发症发生率低。目前还没有针对两种无导线起搏器的对比性研究,研究结果显示,两者降低总体并发症的发生率基本相当。
5 无导线起搏器的适应证与禁忌证
目前两款无导线起搏器主要建议适用于行右心室单腔起搏治疗的患者(VVIR):(1)慢性心房颤动伴完全性房室传导阻滞或长RR 间期者;(2)窦性心律伴高度房室传导阻滞且活动量低或预期寿命较短者;(3)窦性心动过缓偶伴窦性停搏者;(4)不明原因的晕厥伴心电生理检查异常(如HV 间期延长)者;(5)对外表要求高的年轻女性患者[19]。主要禁忌证包括:机械三尖瓣;已存在心内膜导线;下腔静脉滤网置入者;醋酸地塞米松过敏者(起搏器头端为激素释放电极);股静脉解剖异常者;肺动脉高压;30d 内发生急性冠状动脉综合征者;极度肥胖以致无法进行起搏器程控询问者。
根据无导线起搏器的优势,有两类患者尤其适用:一类为终末期肾功能衰竭患者,此类患者为血行感染的高危人群,而无导线起搏器体积小、无导线,降低了感染相关并发症,同时保留了中心静脉或周围静脉不被占用,对血液透析患者亦至关重要。另一类为既往植入经静脉起搏器, 反复感染或静脉栓塞、狭窄患者,植入无导线起搏器可有效解决上述问题。
6 无导线起搏技术用于心脏再同步化治疗(cardiac resynchronization therapy,CRT)效果
CRT 是临床治疗心力衰竭的重要方法,但在临床应用中存在较多问题。受冠状静脉解剖限制,CRT 左心室导线植入存在一定的失败率,或难以植入到理想部位。而成功行CRT 患者,也有1/3 出现无反应。另外,左心室心外膜起搏可能会引发非生理性激动、起搏阈值升高、膈神经刺激等问题。而采用无导线起搏技术可改善CRT 中存在的问题,利用超声WiCSTM系统,实现无导线起搏,避免出现CRT 放置位置不理想,减少了非生理性起搏。该系统应用后转化超声信号为起搏能量,进而发挥左心室内膜起搏效果,可用于CRT 放置左心室电极失败者的治疗中。其主要由左心室起搏单元、皮下脉冲发生器以及传统起搏装置组成。图2 为植入体内的WiCSTM系统。
WiCSTM植入术实施前,可先行超声心动图检查,经超声传输确定最佳声窗位置,根据超声传输测定结果,将发射器植入到胸大肌后囊袋,覆盖接收器所处声窗位置。
WiSE-CRT 研究[20]是一项观察WiCSTM系统治疗心力衰竭效果的多中心、前瞻性研究。该研究纳入了17 例心力衰竭患者,其中7 例采用常规方法植入左心室导线失败,2 例为CRT 无反应,8 例为曾植入普通起搏器或植入式心律转复除颤器(implantable cardioverter defibrillator,ICD)升级为CRT。术前平均左心室射血分数为26%,QRS 时间176ms。研究发现,13 例(76%)成功植入无导线左心室导线,平均R 波感知度为(5.6±3.2)mV,平均起搏阈值为(1.6±1.0)V。随访1 个月时,双心室起搏比例83%,QRS 时间较单右心室起搏减少了41ms;随访6 个月时,双心室起搏比例达92%,QRS 时间较右心室起搏减少了42ms,约2/3 患者心功能分级较前改善1 个等级,左心室射血分数较前明显升高(0.31±0.07 比0.25±0.04,P<0.01)。WiSE-CRT 研究证实了无导线超声供能的左心室心内膜CRT 是一种可行有效的心力衰竭治疗方式。为了进一步研究更为安全的治疗方法,还需改进递送系统,解决超声能量传递效能低、电池寿命短等问题[21-22]。
目前,对于心脏抑制型神经源性晕厥患者是否适合植入起搏器尚有争议。故应慎重看待此类患者植入起搏器,无导线起搏器可能适合此类患者。对于年轻起搏器植入患者,若植入传统起搏器系统,由于起搏器在体内留存时间较长,其发生起搏器及导线感染、穿孔、移位的风险升高,导线拔除危险性也较高,故建议年轻患者选择无导线起搏器。
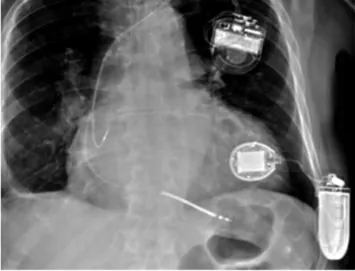
图2 植入体内的WiCSTM 系统
7 无导线起搏器的不足
目前所有无导线起搏器均为心室单腔起搏(微型无导线起搏器)或双心室起搏(左心室仅有超声能量传输方式),尚无传统的DDD 起搏模式,这可能导致房室失同步的非生理性起搏增加。心房起搏由于心房固定部位等问题尚有待研发和应用,而CRT 的VV 间期调整也有待改进。经体表无线能量传输的最大不足在于能量的损耗。
与传统起搏器不同,电池耗竭后无导线起搏器取出时需要取出整个起搏器系统,各起搏器生产厂家也在开发相应的取出工具。对于近期植入的无导线起搏器,其取出相对简单,能在可调弯电生理导管协助下进行。但目前尚无有关取出植入3 年以上无导线起搏器的相关经验数据。由于无导线起搏器体积很小,也可远程调至关闭模式并永久留于右心室。有研究报道,有多达3 个无导线起搏器安全植入同一患者右心室中[23],其累计起搏寿命可达30~40年。目前,无导线起搏器植入患者的平均年龄为70~80 岁,一般植入1 台无导线起搏器即可满足大多数患者的需求。Lee 等[24]报道WiCS 超声能量在产生、传输、转换至电信号的过程中,能量利用率仅有0.03%~0.07%。高能量损耗意味着需要更多的能量输出,即临床上可能更大的器械或更频繁的器械更换。
由于除颤导线与普通起搏导线的结构与工作机制差异较大,目前无导线起搏技术尚不能应用于除颤。近年来逐渐被临床使用的全皮下植入式心脏转复除颤器系统(subcutaneous implantable carioverter defibrillator,SICD)能在一定程度上弥补这一缺憾[25]。
8 结论
无导线心脏起搏技术避免了传统起搏器的囊袋、导线相关并发症,减少了机体的外来物负荷,并使起搏器植入更加便捷,但仍需要长期随访观察和大型随机双盲对照研究证实其长期安全性和有效性。无导线起搏尚存在无法实现生理性起搏、无法应用于除颤、长期植入后取出经验不足等问题,仍需结合更多的临床实践,不断改进无导线起搏技术,使更多患者从中获益。