CircFndc3b对乳腺癌细胞侵袭和迁移的影响及机制预测
2020-06-17牛恒,邱爽
牛 恒,邱 爽
(云南省第一人民医院乳腺甲状腺外科,云南 昆明 650032)
根据2019年国家癌症中心发布的2015年中国恶性肿瘤流行情况分析,乳腺癌已经成为了女性恶性肿瘤中发病率最高的癌症,达到45.29/10万,同时其死亡率达到8.16%[1],严重威胁着女性生命健康。临床研究显示,癌症转移已经成为乳腺癌患者死亡的主要原因[2-3]。大量研究表明,Circular RNA(CircRNA)广泛参与了乳腺癌、肺癌、结直肠癌等恶性肿瘤的发生和发展[4-6]。最近研究显示,Fibronectin type III domain-containing protein 3B circular RNA (CircFndc3b)参与了食管癌、胃癌等肿瘤细胞的增殖、侵袭等生物学过程[7-8]。如Hong等[8]发现CircFndc3b通过调节E-cadherin和CD44的表达,促进胃癌细胞的迁移和侵袭。然而CircFndc3b在乳腺癌细胞中的生物学功能目前研究报道较少。因此,我们探究了CircFndc3b在调控乳腺癌细胞侵袭和迁移中的作用,同时对CircFndc3b的作用机制进行了初步探究,以期为乳腺癌的发病机理研究和临床治疗提供新的靶点。
1 材料和方法
1.1 试剂和仪器
总RNA提取试剂盒和TaKaRa一步法荧光定量PCR试剂盒购自宝生物工程(大连)有限公司;干扰序列和引物的设计和合成由生工生物工程(上海)股份有限公司提供;胎牛血清、Lipofectamine 2000、培养基、实时荧光定量PCR仪购自赛默飞世尔科技公司;Western blotting相关试剂购自上海恪敏生物科技有限公司;E-cadherin鼠单克隆抗体、N-cadherin鼠单克隆抗体、GAPDH鼠单克隆抗体、HRP标记的二抗购自杭州华安生物技术有限公司;RIPA解液购自上海碧云天生物技术有限公司;Transwell实验试剂盒购自康宁生命科学(吴江)有限公司。
1.2 细胞
人乳腺癌细胞系(MCF-7、MDA-MB-231、BT474以及BT20)和MCF-10A人正常乳腺上皮细胞购自美国模式培养物集存库;MCF-7细胞、BT20细胞培养于含有10%胎牛血清的DMEM高糖培养基中,MDA-MB-231细胞培养于含有10%胎牛血清的L-15培养基中,BT474细胞培养于含有10%胎牛血清的RPMI-1640培养基中,MCF-10A细胞培养于含有10%胎牛血清的DMEM/F12培养基中,在37℃和5%CO2培养箱中培养至70%~80%融合度时,进行传代培养。
1.3 转染
对数生长期的MCF7和MDA-MB-231细胞接种于 6 孔板(1×105个/孔)中,70%~80%细胞融合度时进行转染,将含有CircFndc3b siRNA的Lipofectamine 2000和MCF7、MDA-MB-231细胞进行孵育(si-CircFndc3b组),同时设置Ctrl组(仅Lipofectamine 2000处理),48 h后收集MCF7和MDA-MB-231细胞,进行后续相关研究。
1.4 荧光定量PCR实验
收集对数生长期的各组细胞,经过总RNA提取试剂盒提取总RNA后,利用TaKaRa 一步法荧光定量PCR试剂盒检测CircFndc3b以及miRNA-5702和miRNA-7106-5p水平。反应条件:45 ℃,10 min;95 ℃,5 min;95 ℃,10 s;60 ℃,45 s;共40次循环。GAPDH mRNA作为CircRNA内参、U6作为miRNA内参,最后根据2-ΔΔCt法计算相对表达量。引物序列见表1。
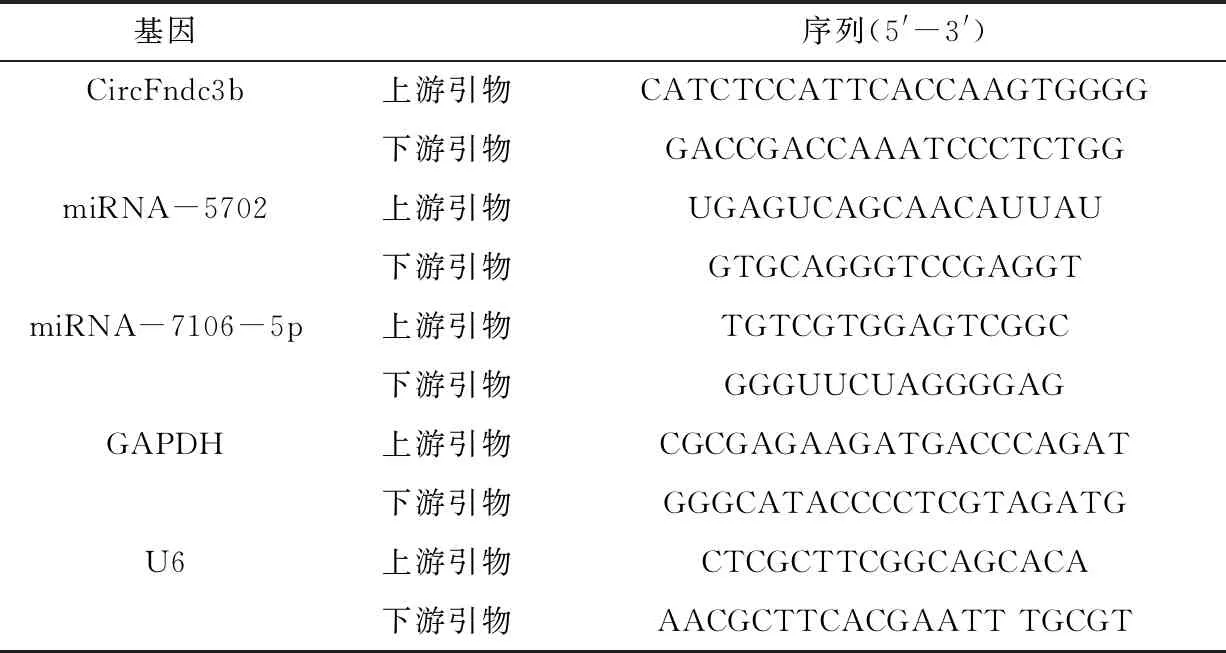
表1 引物序列
1.5 Transwell实验
在Transwell小室底部加入培养基和基质胶(体积比1∶1)的混合物0.1 mL,37 ℃孵育4 h后加入0.1 mL的MCF7和MDA-MB-231细胞悬液(1×106个/mL),同时下室加入培养基0.5 mL,培养48 h后,进行4%多聚甲醛固定和结晶紫室温染色。显微镜下随机选取5个视野进行细胞计数。
1.6 划痕实验
MCF7和MDA-MB-231细胞分别接种于6孔板中,细胞生长至融合度95%以上时,利用移液器枪头(200 μL)在单层MCF7和MDA-MB-231细胞上进行划痕,经PB清洗散落细胞后,加入培养基继续培养24 h(37 ℃),在0 h、24 h时候进行取样拍照并计算迁移程度。迁移程度=(0 h两侧距离-24 h两侧距离)/0 h两侧距离。
1.7 Western blotting实验
收集不同处理的MCF7和MDA-MB-231细胞,经RIPA裂解液处理0.5 h(4 ℃)后,进行总蛋白提取。取蛋白样品50 μg进行SDS-PAGE电泳,转移至PVDF膜后进行5%脱脂奶粉封闭,清洗后加入E-cadherin鼠单克隆抗体、N-cadherin鼠单克隆抗体、GAPDH鼠单克隆抗体,4 ℃摇床孵育过夜后进行TBST洗膜,然后加入HRP标记的二抗,室温孵育120 min,TBST洗膜后进行ECL显色以及曝光和定影。利用Image J软件测定灰度值。
1.8 统计方法
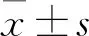
2 结果
2.1 CircFndc3b在乳腺癌细胞中高表达
通过qRT-PCR,发现CircFndc3b在人乳腺癌细胞系(MCF-7、MDA-MB-231、BT474以及BT20)表达水平显著高于MCF-10A人正常乳腺上皮细胞(均P<0.01);且CircFndc3b在MDA-MB-231细胞中水平最高,其次为MCF-7细胞,结果见图1(a)。转染siRNA后,MDA-MB-231细胞和MCF-7细胞中CircFndc3b水平显著降低(均P<0.01),结果见图1(b)。
2.2 CircFndc3b促进乳腺癌细胞侵袭和迁移
Transwell实验结果显示,敲低CircFndc3b表达后,MDA-MB-231细胞和MCF-7细胞的侵袭细胞数量显著降低(均P<0.01),结果见图2。划痕实验表明,敲低CircFndc3b表达后,MDA-MB-231细胞和MCF-7细胞的迁移距离显著低于Ctrl组(均P<0.01),结果见图3。Western blotting检测侵袭和迁移相关蛋白发现,敲低CircFndc3b表达导致MDA-MB-231细胞和MCF-7细胞中E-cadherin表达明显升高,而N-cadherin表达显著降低(均P<0.01),结果见图4。
图1 CircFndc3b在乳腺癌细胞中高表达
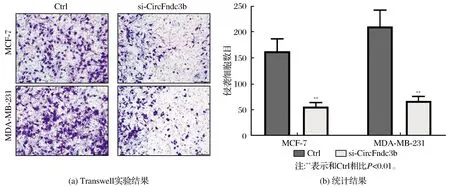
图2 Transwell实验检测CircFndc3b对MDA-MB-231细胞和MCF-7细胞侵袭能力的影响
2.3 CircFndc3b靶点预测及初步验证
利用miRDB数据库,发现CircFndc3b具有47个潜在的靶点miRNAs,其中miRNA-5702和miRNA-7106-5p的评分超过90分,结果见图5(a)。qRT-PCR检测显示,敲低CircFndc3b后,MDA-MB-231细胞和MCF-7细胞中miRNA-5702和miRNA-7106-5p表达水平显著升高(均P<0.01),结果见图5(b)、图5(c)。
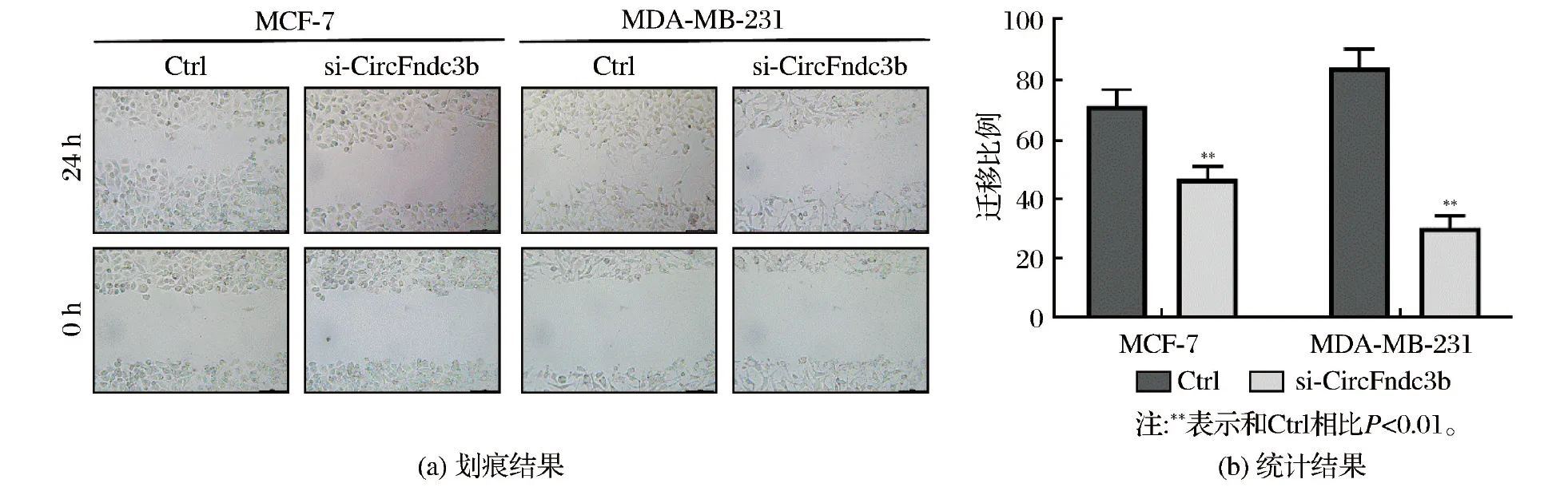
图3 划痕实验检测CircFndc3b对MDA-MB-231细胞和MCF-7细胞迁移能力的影响
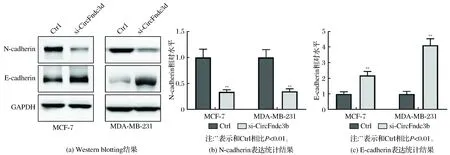
图4 Western blotting检测CircFndc3b对MDA-MB-231细胞和MCF-7细胞E-cadherin和N-cadherin表达的影响
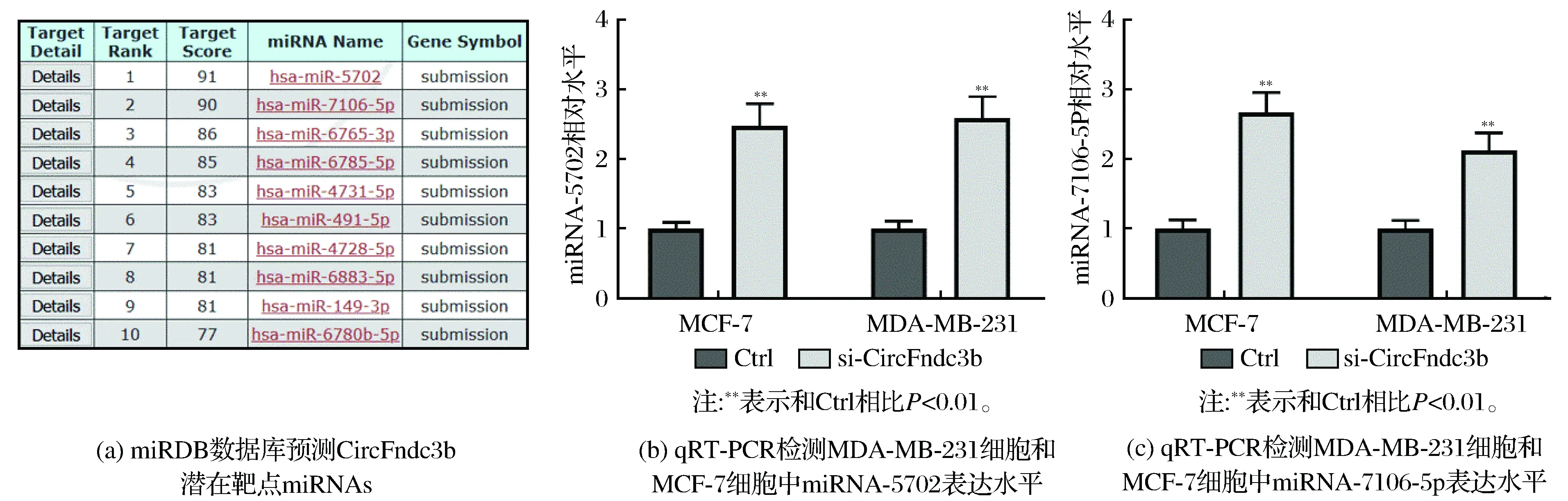
图5 CircFndc3b靶点预测及初步验证
3 讨论
CircFndc3b是一种侵袭相关的circRNA,并且其参与恶性肿瘤细胞的增殖、凋亡、侵袭和迁移等生物学过程[9-10]。Luo等[11]研究发现CircFndc3b促进了食管癌细胞增殖和迁移。然而Liu等[12]则发现侵袭相关的CircFndc3b通过miR-1178-3p/G3BP2/SRC/FAK轴抑制了膀胱癌的进展。此外,CircFndc3b调控乳腺癌细胞侵袭和迁移的作用目前尚未被完全阐明。因此,我们对CircFndc3b调控乳腺癌细胞侵袭和迁移的作用进行了探究,同时对CircFndc3b结合的miRNAs进行了预测和初步验证,以期为乳腺癌的发病机理研究和临床治疗提供新的靶点。
首先,我们探究了CircFndc3b在乳腺癌细胞中的表达。qRT-PCR结果显示4种人乳腺癌细胞系(MCF-7、MDA-MB-231、BT474以及BT20)中CircFndc3b表达水平均显著高于MCF-10A人正常乳腺上皮细胞,和Hong等[8]在胃癌中的研究结果相近,表明CircFndc3b可能作为致癌基因而促进乳腺癌发展。随后我们选取了CircFndc3b表达量较高的MCF-7细胞和MDA-MB-231细胞进行CircFndc3b敲低并探究了CircFndc3b在乳腺癌细胞发生和发展中的作用。
临床研究发现癌症转移是导致乳腺癌患者死亡率较高的主要原因之一[13-14]。因此,了解乳腺癌转移的分子机制有助于新药的研发以及乳腺癌患者的临床治疗。大量研究显示circRNA的异常表达影响了肿瘤细胞的转移能力[15-16]。此外有研究报道显示,提高CircFndc3b表达促进了食管癌细胞以及胃癌细胞的侵袭和迁移能力。但我们的研究结果发现,敲低CircFndc3b表达后,MCF-7细胞和MDA-MB-231细胞的侵袭细胞数量明显减少,同时迁移的距离明显降低,表明CircFndc3b参与了乳腺癌细胞的侵袭和迁移。进一步发现,敲低CircFndc3b表达后,MCF-7细胞和MDA-MB-231细胞E-cadherin表达明显升高,而N-cadherin表达显著降低,从而更加证实了上述结论。因此,检测CircFndc3b表达水平将有助于乳腺癌患者的预后评估以及制定合理的临床治疗方案,同时对阐明乳腺癌转移的分子机制具有重要意义。
研究显示,海绵miRNAs是circRNA发挥调控作用的主要机制之一[17-18]。Liang等[19]的研究显示circ-ABCB10通过海绵miR-1271促进乳腺癌的增殖和进展。此外,CircFndc3b也被发现能够调控miR-1178-3p、miR-99a等miRNAs[7,12]。而利用miRDB数据库进行预测发现,CircFndc3b和47个潜在的靶点miRNAs具有结合位点。进一步检测评分最高的2种miRNAs发现,敲低CircFndc3b表达导致miRNA-5702和miRNA-7106-5p表达水平显著升高,表明CircFndc3b可能通过影响miRNAs表达而发挥促进乳腺癌转移的作用。
综上所述,研究发现CircFndc3b在乳腺癌细胞中高表达,且促进了乳腺癌细胞的侵袭和迁移。CircFndc3b发挥促进乳腺癌转移的作用可能是通过调控miRNAs表达实现的。CircFndc3b为乳腺癌转移、预后评估以及临床治疗提供了新的靶点。然而CircFndc3b在乳腺癌组织中的表达以及通过何种miRNAs发挥促进乳腺癌转移的作用后续仍是研究的重点。
