种痘样水疱病样淋巴组织增生性疾病2例诊治分析并文献复习
2020-06-17黄慧胡云峰刘赛君邓列华
黄慧, 胡云峰, 刘赛君, 邓列华*
(1.暨南大学 附属第一医院 皮肤科/暨南大学皮肤病研究所,广东 广州 510632;2.广州中医药大学 第二临床医学院,广东 广州 510006)
种痘样水疱病样淋巴组织增生性疾病(hydroa vacciniforme-like lymphoproliferative disorder,HV-LPD)是一种慢性EB病毒(Epstein-Barr virus,EBV)相关淋巴增生性疾病,有发展为恶性淋巴瘤的风险.HV-LPD曾被命名为种痘样水疱样T细胞淋巴瘤(hydroa vacciniforme-like cutaneous T-cell lymphoma,HVLL),由于该术语不能代表从经典的自限性种痘样水疱病(hydroa vacciniforme,HV)到HV样淋巴瘤不同时期的临床特征,在2016年修订的WHO淋巴造血组织肿瘤分类中,将HVLL更改为HV-LPD[1].HV-LPD临床表现广泛,且具有可变性,经典型和严重型是其临床表现的两个极端,中间还有从经典型过渡到严重型的各种临床表现.本研究选择的2例典型HV-LPD病例,分别代表了HV-LPD经典型与严重型的两个极端,分析其临床特征及治疗转归,对于临床诊治有一定指导意义.
1 临床资料
病例1,女,24岁,全身泛发红斑、丘疱疹伴反复发热5年余.患者5年前无明显诱因出现头面部、躯干、四肢大小不一红斑,继而红斑中央出现针尖至绿豆大小水疱,部分水疱融合、破溃伴结痂,轻度瘙痒感,愈后遗留凹陷性瘢痕.后皮疹蔓延至头皮、口腔黏膜及会阴部,并出现发热,达38.0 ℃.患者病情反复,无明显季节性,自诉日光照射后皮肤有灼热不适感,蚊虫叮咬后易出现1.0 cm×0.5 cm大小水疱,既往体健,生活规律,无不良嗜好,自患病以来,饮食、睡眠、大小便无异常,否认遗传性及传染性疾病.
体格检查:体温38.0 ℃,一般情况好,颈部、腹股沟可扪及花生米大小淋巴结,质较软,活动度好,无压痛.皮肤科检查:全身散在大小不一红斑、丘疹、丘疱疹,尤以面部为重(图1A、B、C),局部中央水疱破溃、坏死、结痂(图1D),周围可见片状色素沉着斑及点状凹陷性瘢痕.
实验室及辅助检查:血常规白细胞计数升高(11.29×109/L),C反应蛋白质量浓度偏高(22.82 mg/L);外周EBV DNA定量为 2.51×107copies/mL(实验灵敏度为 5.00×102copies/mL),EBV抗体IgG 阳性、IgM 阴性;肝肾功能、血沉、粪尿常规等未见异常;彩超提示:双侧腹股沟、颈部见多个低回声光团,考虑肿大的淋巴结.
皮损组织病理检查:网状角化过度,棘层细胞部分坏死,表皮下水疱形成,疱液中见淋巴细胞为主的炎细胞浸润(图2A);真皮浅层血管及附属器周围较密集的单一核细胞浸润(图2B),部分细胞轻度异型性改变(图2C).免疫组化结果(图3):CD3(+),CD4(+),CD8(+),CD56(-),颗粒酶(granzyme B,GrB)(+),T细胞胞浆内抗原(TIA-1)(+),穿孔素(perforin)(-),Ki67(+)约占10%,EBV(+).
治疗过程:结合患者临床表现、皮肤组织病理及免疫组化等结果,确诊为HV-LPD.给予肌注重组人干扰素500万IU,隔日1次;口服盐酸伐昔洛韦500 mg,每日2次;口服醋酸泼尼松片20 mg/d,患者体温逐渐降至正常值,皮疹缓解.治疗3个月后,皮疹基本愈合,未见新发皮损(图1E、F),EBV DNA定量降为2.97×105copies/mL,定期门诊治疗.
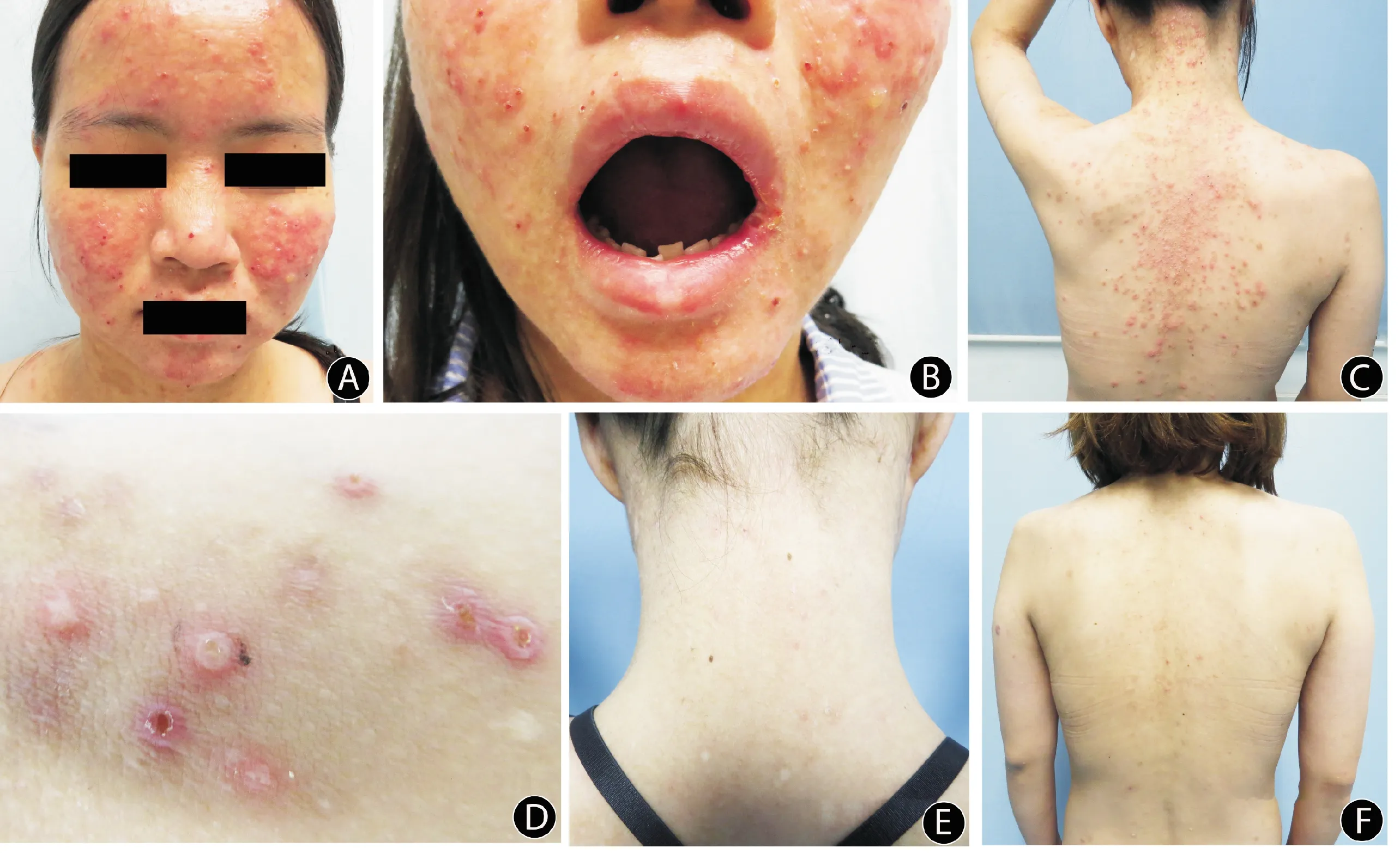
A:面部红斑、丘疹、丘疱疹;B:口腔黏膜溃疡;C:背部类似皮损;D:上肢丘疱疹、结痂;E:治疗后项部皮疹消退,遗留色沉斑及凹陷瘢痕;F:治疗后背部皮疹消退,遗留色沉斑及凹陷瘢痕.
A: Erythema, papule and herpes on the face;B:Ulcers of mouth mucosa;C:Similar skin lesions on the back;D:Herpes and crusts;E: Discolored spots and sunken scars on the neck after rash degraded;F:Discolored spots and sunken scars on the back after rash degraded.
图1 病例1临床表现
Fig.1 Clinical manifestation of case 1
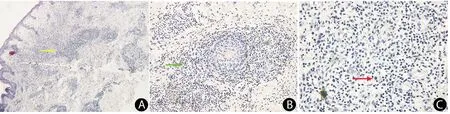
A:表皮下淋巴细胞为主的炎细胞浸润(黄色箭头),HE,×40;B:真皮浅层血管周围炎细胞浸润(绿色箭头),HE,×200;C:部分细胞轻度异型性改变(红色箭头),HE,×400.
A:Most of the inflammatory cells under the epidermis were lymphocytes(yellow arrows),HE,×40;B:Inflammatory cells could be seen around the superficial dermal vessel(green arrow),HE,×200;C:Mild atypical cells(red arrow), HE,×400.
图2 病例1皮损组织病理图
Fig.2 Histopathological examination of skin lesions in case 1
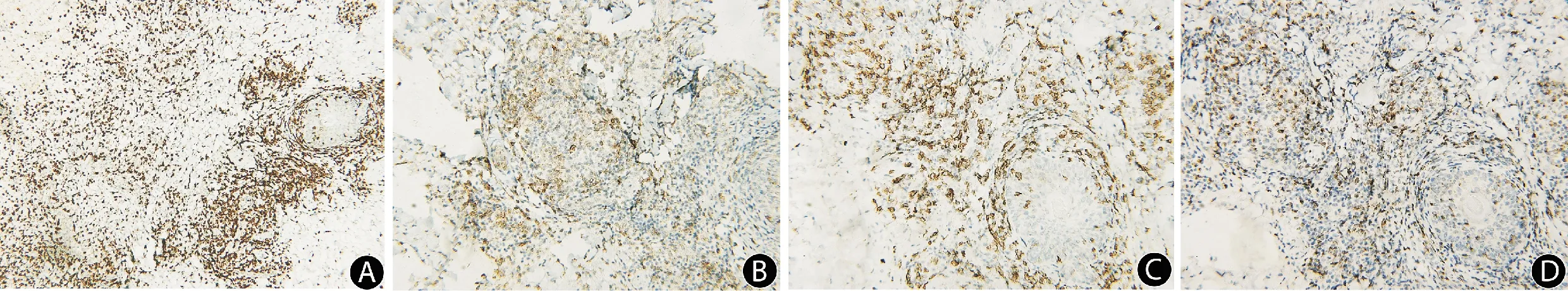
A:CD3阳性(×100);B:CD4弱阳性(×200);C:CD8阳性(×200);D:GrB阳性(×200).
病例2,女,15岁,反复口腔溃疡、面部丘疱疹3年,右髋部溃烂2月余就诊.患者3年前出现反复性口腔溃疡,随后面部、颈项部出现暗红色丘疱疹,有瘙痒感,伴反复性发热,最高体温39.0 ℃,皮损愈合后遗留色素沉着斑,日晒后症状加重.2年前于外院检查EB病毒DNA定量为7.08×105copies/mL,皮损病理检查提示HV-LPD,后开始规律使用干扰素300万IU每周2次和泼尼松片10 mg 每日1次维持治疗,病情稳定.半年前自行停用干扰素20余日,随后出现右侧髋部红肿性斑块,逐渐破溃坏死,伴发热症状.伤口分泌物培养示金黄色葡萄球菌感染,予抗感染治疗1月,无明显好转,溃疡面积继续增大.既往生活规律,否认遗传性及传染性疾病.
体格检查:体温38.9~40 ℃,一般情况可,全身未触及浅表淋巴结肿大.皮肤科检查:面部、躯干及双下肢散在红色斑丘疹,部分肿胀、破溃(图4A、B),上覆痂皮及磷屑,散在色素沉着斑,右侧髋部见一深大溃疡,8 cm×6 cm大小,黄色厚浆痂附着,周围红肿明显,中间见黄白色分泌物,压痛明显(图4C).
实验室及辅助检查:肝功能示乳酸脱氢酶(lactate dehydrogenase,LDH)较高:525 U/L;EB病毒DNA定量:2.17×107copies/mL;血常规、C反应蛋白、生化全套等基本正常;病毒六项(HBeAg、Anti-HBe、Anti-HBc、Anti-HCV、Anti-HIV、TPHA)、肿瘤五项阴性;右侧髋部溃疡处分泌物培养:金黄色葡萄球菌阳性.彩超提示:脾脏增大,未见占位,肝胆胰未见异常.骨髓涂片提示刺激性骨髓象;骨髓活检病理:骨髓增生活跃,三系造血细胞均可见,未见明显异型细胞.
皮损组织病理检查:部分表皮坏死,浅表溃疡形成,真皮层及皮下脂肪见大量淋巴样细胞浸润(图5A、B),细胞异型性改变明显(图5C),可见大量坏死及出血.免疫组化结果(图6):CD4(-),CD7(+),CD8(-),CD56(+),CD20(-),CD79a(-),GrB(弱+),TIA-1(+),穿孔素(+),Ki67(+)约占80%,EBV(+).
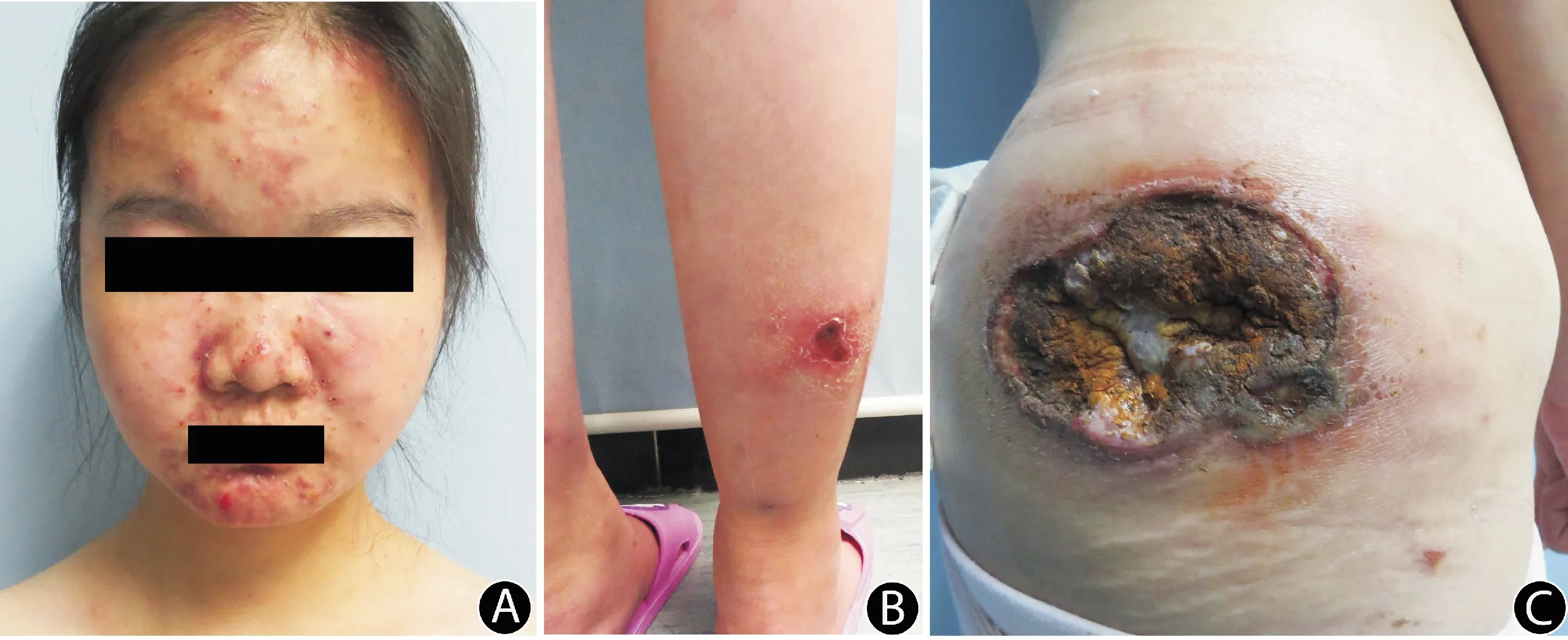
A:面部红斑、丘疹、丘疱疹;B:右小腿红肿性斑块;C:右侧髋部深大溃疡,中间黄白色分泌物.
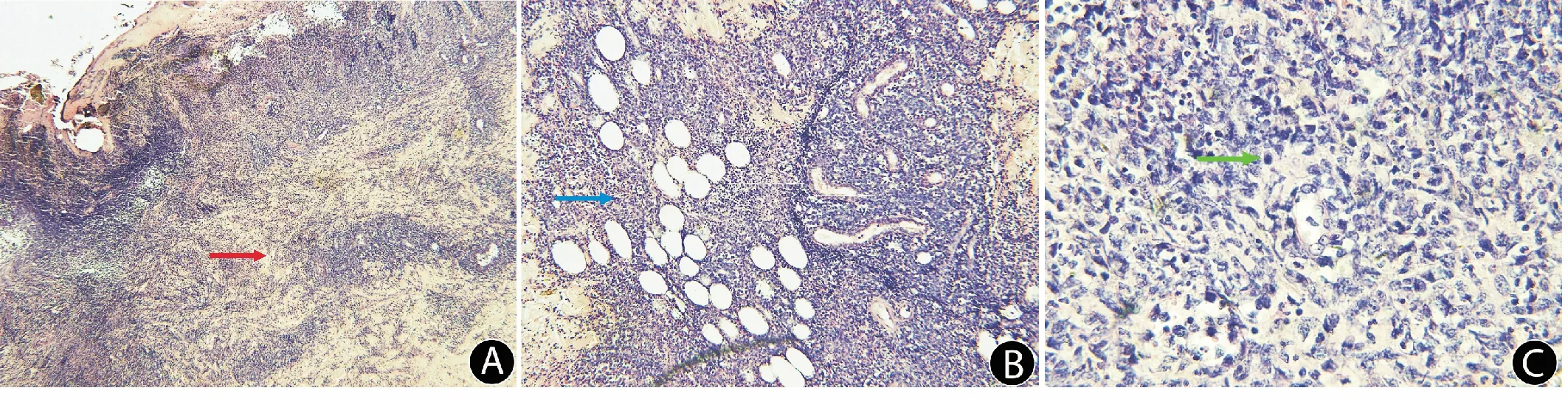
A:真皮层炎细胞浸润(红色箭头),HE,×40;B:皮下脂肪间大量淋巴样细胞浸润(蓝色箭头),HE,×100;C:明显异型性改变细胞(绿色箭头),HE,×400.
A: Infiltrating inflammatory cells in the dermis(red arrow),HE,×40;B:massive lymphocyte infiltration could be seen among subcutaneous fat(blue arrow),HE,×100;C:obviously atypical cell(green arrow),HE,×400.
图5 病例2皮损组织病理图
Fig.5 Histopathological examination of skin lesions in case 2
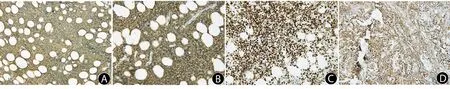
A:CD7阳性(×100);B:CD56阳性(×200);C:Ki67阳性约占80%(×200);D:EBV阳性(×200).
治疗过程:结合临床表现、皮肤组织病理及免疫组化等结果,患者已由HV-LPD进展为T/NK细胞淋巴瘤.给予CHOP化疗方案联合干扰素及替考拉宁抗感染等治疗,右臀部、右小腿后侧肿瘤性溃疡局部放疗:5 000 cGy/25f.治疗2周后,体温降至38.0~38.4 ℃,右臀部溃疡处疼痛缓解,但溃疡面形态较前无明显变化,EBV 定量降低不明显.治疗6周后,患者一般状况可,但持续发热,溃疡部位较前减小,要求出院休养,出院前EBV DNA定量升至20.7×107copies/mL.后未再复诊,半年后随访,患者已死亡.
2 讨论
HV-LPD属于罕见疾病,患者几乎均来自于亚洲(中国大陆、中国台湾、日本、韩国)及拉丁美洲(墨西哥、巴西、秘鲁、玻利维亚),儿童和青少年多见,偶见成年病例报道[1-2].HV-LPD尚无明确的病因和发病机制,可能与EBV慢性活动性或潜伏性感染,以及蚊虫叮咬超敏反应[2]等有关,没有明显季节性和自愈倾向,反复发作,进行性加重.
EBV是一种嗜人类淋巴细胞的γ-疱疹病毒,血清EBV DNA定量高的患者发展为侵袭性肿瘤的风险更高[2].HV-LPD白种人患者由于EBV DNA水平相对较低,不易患EBV全身性疾病且预后较好[3].原因可能是EBV编码的基因转录物BZLF1mRNA,可诱导EBV再活化,引发异常的免疫应答反应,BZLF1mRNA也被认为是 EBV相关淋巴组织增生性疾病单变量分析的预后不良因素[4].还有报道GATA2基因缺陷降低了对EBV的免疫监控[5],以及EBV免疫缺陷的遗传易感性等说法.此外,日晒会诱发或加重病情,可能与紫外线诱导IL-10分泌增加,加强了机体的免疫抑制作用有关[6].
HV-LPD具有可变性的临床表现,分为经典型和严重型,代表了两个极端[7](表1).经典型表现以面部曝光部位的丘疹、丘疱疹为主,也可累及躯干及四肢,丘疹破溃后形成溃疡和浆痂,愈后遗留凹陷性瘢痕,也有最初表现为面部红肿、反复口腔溃疡[8]以及进行性眶周水肿的报道[5,9],没有全身症状;严重型在反复性丘疱疹的基础上出现深大皮肤溃疡,同时伴有系统损害,如发热、贫血、淋巴结和肝脾肿大等[10],骨髓涂片示巨噬细胞比例增加[11].大多数HV-LPD病例表现出非常缓慢的临床病程,但最终可发展为皮肤EBV阳性T/NK细胞淋巴瘤[12].高血清EBV DNA定量[2]、细胞减少症,乳酸脱氢酶升高,多器官损害是不良的预后因素[13].
HV-LPD确诊依赖于典型的临床表现、组织病理、免疫组化和基因重排.HV-LPD组织病理多见表皮破溃,真皮至皮下脂肪内弥漫或团块状分布的淋巴细胞浸润,多位于血管周围,轻度异型性.向淋巴瘤转化时可出现非典型的淋巴细胞浸润,具有促血管性和血管中心性[12].有研究显示,HV-LPD淋巴细胞表型中,CD4+T细胞占37%,CD8+占26%,CD56+占37%[13],其中NK细胞表型患者发展为全身性淋巴瘤的风险更高[14],而Ki67增殖越高,预后越差[15].
对于HV-LPD的治疗,目前没有明确的治疗指南,总的原则是不首选化、放疗方案,建议保守治疗[2].临床表现较轻的患者可在光保护后缓解[11];免疫调节剂如干扰素IFN-α[16]、糖皮质激素、沙利度胺、环孢素等和抗病毒药物如阿昔洛韦[7]可缓解病情.至于化疗或放疗,KIMURA等以较大样本数据报道化疗只是暂时缓解病情,不能维持长期疗效,甚至会出现高于预期的死亡率[7,14].同种异体基因造血干细胞移植可使66%患者病情得到长期缓解[7],并有使EBV PCR检测转为阴性的可能[17].近来研究显示,程序性细胞死亡蛋白-1(programmed cell death protein 1,PD-1)及程序性细胞死亡蛋白-1 配体(programmed death-ligand 1,PD-L1)在EBV相关的T/NK细胞淋巴组织增生性疾病中显著高表达,PD-1/PD-Ls 信号通路可能成为其免疫治疗的潜在新靶点[18].
本研究中两个亚洲病例属于EBV感染的T/NK细胞型.二者EBV DNA定量均明显升高,从单个个体看,其定量高低与患者的临床症状严重程度呈正相关.2个病例均以面部红斑、丘疹、丘疱疹为始发症状,病例1有蚊虫叮咬过敏史,病例2有反复口腔溃疡病史,二者均出现日晒后病情加重现象,符合HV-LPD临床特征.病例1患者临床表现倾向于经典型HV-LPD,病例2患者早期发病时被诊断为HV-LPD,逐步进展为严重型HV-LPD,最终转化为EBV阳性T/NK细胞淋巴瘤.回顾既往文献报道的临床表现与转归,再结合本研究两个病例的典型临床表现,按十分制总结出HV-LPD临床症状分值表(表1),分值越高,病情越重,有利于临床直观清晰地分析患者病情.但疾病发展的具体阶段仍需要结合病理检查,病例1真皮浅层血管及附属器周围浸润的淋巴细胞轻度异型性改变,符合HV-LPD一般病理特征;病例2真皮及皮下脂肪间致密淋巴细胞浸润,细胞异型性明显,真皮内血管破坏明显,免疫组化示CD7、CD56阳性,Ki67(+)约占80%,已进展为T/NK细胞淋巴瘤.病例1患者采用保守治疗,疗效稳定;病例2患者选择放化疗方案治疗,疗效不佳.当然,这也与患者本身的疾病进展情况有关.

表1 HV-LPD临床症状分值表
有无典型皮疹(±1分),有无发热症状(±1分),有无血液学变化或肝功能代谢障碍(±1分),病理活检有无细胞异形性改变(±1分),系统症状有无多器官损害(±1分).
总而言之,HV-LPD治疗困难,条件允许可早期行造血干细胞移植,可能有较好的远期效果.当转化为严重型HV-LPD或T/NK细胞淋巴瘤等恶性肿瘤时,可选择化疗,大多数以CHOP为主,局限性肿瘤也可应用放疗,但疗效均欠佳,一般在6个月或更短的时间内死亡,显示出病情严重且预后不良[9,19].
