四倍体人参组培苗与其同源八倍体叶片超微结构特征
2020-06-17宋娟姚丽娜崔丽丽王英平郑培和
宋娟,姚丽娜,崔丽丽,王英平,郑培和※
(1.中国农业科学院特产研究所,吉林 长春 130112;2.吉林农业大学,吉林 长春 130118)
植物染色体加倍研究有着较长历史,大量植物的染色体加倍获得成功,而在药用植物中染色体加倍研究相对较少,多为伞形科和百合科等,如当归、川贝母和黄芩等珍贵药用植物[1]。药用植物多倍体诱导最常用的技术为化学诱导,其中以秋水仙素试剂的效果最好。秋水仙素用于处理植物体细胞分裂状态活跃的器官组织及生长点[2],如芽、花蕾、幼苗、萌动的种子和愈伤组织等。现代科学将化学诱变技术与植物组织培养技术相结合,集合了组培技术可控培养条件和缩短植物生长周期的优势,更有利于快速繁殖诱导成功的多倍体材料,以满足育种和科研需求[3-4]。通过组织培养技术,用秋水仙素处理培养材料,经离体诱导培养后可获得加倍的多倍体植株,如白菜型油菜与甘蓝型杂交后F1 代种子经秋水仙素处理,通过离体培养得到了混倍体植株[5]。
人参(Panax ginseng)是五加科人参属重要药材[6],具大补元气、生津养血和补脾益肺等功效。本实验室已具备成熟的人参组培技术,现将秋水仙素处理后的人参种子,经离体培养得到八倍体人参植株,其可用于育种研究工作。本研究通过透射电镜观察比较四倍体人参组培苗和八倍体人参组培苗的叶片显微结构,旨在为人参育种工作提供数据支撑。
1 材料与方法
1.1 材料
材料为中国农业科学院特产研究所药用植物资源与育种团队的人参组培苗,四倍体材料是由人参种子离体诱导分化得到的组培苗,八倍体材料是由四倍体种子经秋水仙素处理后离体分化培养得到的组培苗,人参种子取自中国农业科学院特产研究所野生资源观测站。诱导和继代培养基为MS基本培养基附加2 mg/L BA、4 mg/LGA、0.5 g/L 水解乳蛋白、30 g/L 蔗糖和5.5 g/L琼脂。
1.2 方法
1.2.1 倍性鉴定方法 选取继代培养40 d 的四倍体和八倍体人参组培苗以及作为对照的大田人参叶片,剪取形态正常、生长健壮且充分展开的叶片0.5 cm2一块置于6 mm 培养皿中,加入0.4 mL 细胞核提取缓冲液(Sysmex,05-5002),用刀片将样品快速切碎,静置1 min 后将得到的样品悬浮液用500 目的过滤网过滤,再加入1.6 mL细胞核染色液(Sysmex,05-5002),暗处染色5 min 后,即可上机(Sysmex,PA)测倍性。采用Flowjo10 进行倍性分析。
1.2.2 透射电镜观察法 选取继代培养40 d 的四倍体和八倍体组培苗,切取叶片1 cm2若干,将材料放入2.5%固定液中,进行抽气处理,使材料尽快沉底,后室温固定48 h。后用1%锇酸固定液4 ℃固定24 h,梯度乙醇脱水,丙酮过渡,环氧树脂包埋,LKB-I 型超薄切片机切片,醋酸铀和柠檬铅双重染色,观察,拍照。并于菲利浦EM400T 透射电镜下观察叶片横切结构。
2 结果与分析
2.1 流式细胞仪检测结果
本研究选用未经加倍处理的四倍人参组培苗和加倍后得到的人参组培苗(大田人参叶片作对照),3次重复测试,记录细胞G1 期峰值。由流式细胞仪检测的倍性结果如图1:对照的G1 期稳定峰值为100 道,四倍体的G1 期稳定峰值为100 道,而加倍后的人参组培苗的G1 期稳定峰值为200 道。加倍材料的G1 期峰值是四倍体的G1 期峰值的2 倍,可推测该加倍后的人参组培苗材料被加倍成八倍体。

图1 人参组培苗四倍体、八倍体和对照人参叶片倍性检测结果Fig.1 The leaf ploidy detections of tetraploid,octoploid in vitro and control ginseng in filed
2.2 四倍体和八倍体人参组培苗特征比较
由图2、表1 可知,加倍后离体培养的人参组培苗与四倍体表型特征有着显著差异:四倍体植株生长旺盛,有与大田植株近似的掌状叶,叶较狭长;不同倍性人参组培苗在植株数、幼芽数和株高方面存在显著差异,四倍体显著大于八倍体,但在叶宽和叶长方面,八倍体叶片显著增大,叶片颜色加深[7-9],存在部分叶片表现畸形。

图2 不同倍性人参组培苗Fig.2 The tissue culture seedlings of different ploidy ginseng

表1 不同倍性人参组培苗性状比较Table 1 The characters of the tissue culture seedlings of different ploidy ginseng
2.3 四倍体和八倍体人参组培苗叶片结构比较

图3 不同倍性人参组培苗叶片电镜结构Fig.3 The leaf electron microscopy structure of different ploidy ginseng in vitro
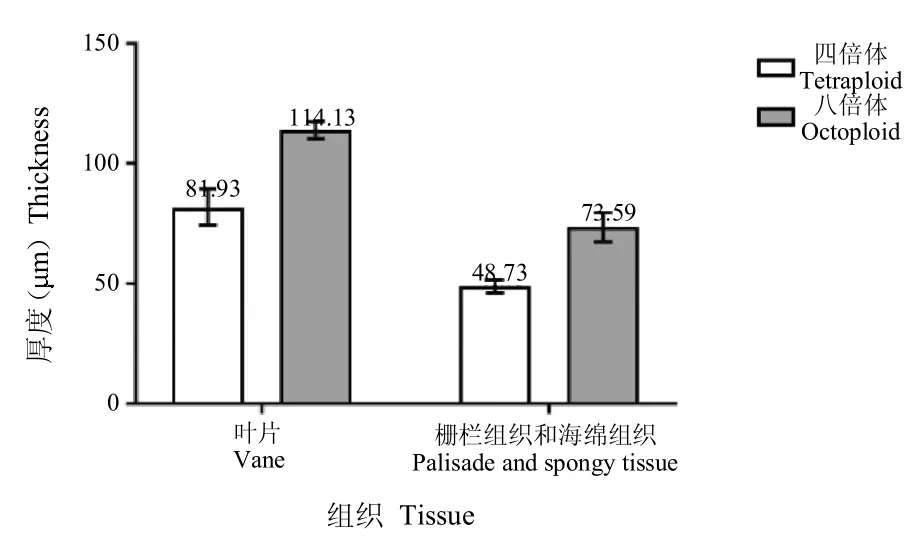
图4 不同倍性人参组培苗叶肉组织结构特征Fig.4 The characters of mesophyll tissues structure of different ploidy ginseng in vitro
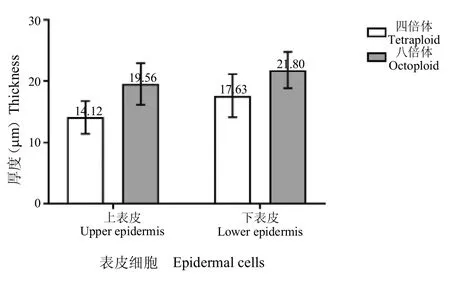
图5 不同倍性人参组培苗叶片表皮细胞厚度Fig.5 The epidermal cell thickness of different ploidy ginseng in vitro
2.3.1 四倍体和八倍体人参组培苗叶片组织结构的比较 电镜下观察四倍体和八倍体人参组培苗叶片横切面结构(图3A 和D),发现四倍体和八倍体人参组培苗叶片上下表皮细胞均为单层,但四倍体叶片多为5层细胞构成,而八倍体叶片多为7 层;四倍体和八倍体人参组培苗叶片厚度都不均匀,且四倍体和八倍体组培苗叶片的栅栏薄壁组织和海绵薄壁组织均分化不明显[10],八倍体的细胞增大,细胞大小差异增大;八倍体叶片厚度、栅栏薄壁组织和海绵薄壁组织总厚度分别较四倍体增加了约39.30% 和51.02%(图4),八倍体栅栏薄壁组织和海绵薄壁组织的细胞层数增加,但细胞大小差异较大;八倍体人参组培苗叶片的表皮细胞相较于四倍体增厚,上下表皮厚度分别增加了38.53%和23.65%(图5)。
2.3.2 四倍体和八倍体人参组培苗叶片细胞超微结构的比较 透射电镜下观察四倍体和八倍体人参组培苗叶片细胞结构,叶肉细胞内均含丰富的细胞器(图3B、3C、3E、3F)。对比发现,在四倍体和八倍体人参组培苗的细胞中均含有大量叶绿体,且其内可见由基粒片层组成的基粒和数量、大小不等的淀粉粒、嗜锇颗粒。八倍体人参组培苗叶肉细胞中叶绿体数量多,且体积小于四倍体,其内富含的淀粉粒数量多于四倍体。四倍体人参组培苗叶肉细胞中叶绿体内含有大量清晰的基粒且形状规则,基粒片层垛叠紧密且垛叠厚度较大;而八倍体人参组培苗叶绿体内基粒片层垛叠较少,其光合产物运输效率较低,光合产物积累过剩会抑制光合速率[11]。因此,加倍得到的八倍体人参组培苗叶绿体结构的光合特性相对于四倍体较弱,这与其组培苗形态特征表现一致。
3 讨论
离体诱导法[12]即组织培养诱变法,是对植物某一离体部位进行秋水仙素处理,再进行组织培养,或在组织培养过程中进行染色体加倍处理的方法。该方法已经应用在很多药用植物中获得同源多倍体,如黄芩、决明和丹参等材料的愈伤组织。陈素萍等[13]通过在培养基中加入秋水仙素直接诱导种子加倍,再通过胚轴组织培养的方法获得四倍体植株。本研究也是通过秋水仙素处理人参种子,再通过组织培养的方法获得八倍体组培苗。
多倍体植物具有一种特殊的形态特性,与正常倍性植株相比,根、茎、叶、花和种子等器官表现出巨型性[14]。加倍后离体培养的人参组培苗的特征表型与其他植物,如矮牵牛、郁金香、黄瓜和板蓝根等[15]多倍体的表现基本一致,叶片厚度增加、叶片增大、颜色加深等,但植株数量减少,部分叶片畸形。在腋花杜鹃组培苗的倍性诱导中发现有叶片肥厚、叶片畸形扭曲和茎段明显变粗3 种形态变异的过半为多倍体[16];四倍体小黧的柄增长,开花时间较二倍体延长[17]。可见,在多倍体育种研究中,加倍后的植株与原正常植株相比存在很多不同,多表现在根、茎、叶、花和果实等表型特征上。
叶片作为植物进行光合作用的主要器官,其形态结构直接影响着植物的光合作用,本研究中,初步对四倍体和八倍体人参组培苗叶片解剖和显微结构进行研究。从叶片组织结构来看,八倍体人参组培苗叶片较四倍体厚39.30%;栅栏组织和海绵组织细胞层数增加,细胞增大且差异增加;八倍体上下表皮细胞厚度较四倍体也明显增加,这都是多倍化效应导致的[18-20]。在对四倍体和八倍体人参组培苗叶片叶肉细胞显微结构的初步研究中发现,细胞器中以叶绿体的差异较明显:八倍体人参组培苗叶片的叶绿体内的基粒数量和基粒片层垛叠数量都远小于四倍体。张虹等[21]发现,可能是较高的染色体拷贝数致使细胞结构功能异常、生命代谢活动受阻,从而影响了黑果枸杞八倍体叶片的叶绿素含量,使其显著低于二倍体和四倍体。本研究仅对四倍体和八倍体人参组培苗叶片的叶绿体进行了初步分析,针对倍性变化对人参组培苗内叶绿体的影响还需进一步研究。
