乳腺癌组织及癌旁组织HER2基因CpG岛甲基化水平及其mRNA表达的研究
2020-06-16蔡骁垚闫佩毅
金 姝, 朱 琪, 朱 元, 袁 亚, 蔡骁垚, 张 骥, 闫佩毅
(1.上海市普陀区人民医院检验科,上海 200060;2.上海市普陀区人民医院外科,上海 200060;3.上海市普陀区人民医院病理科,上海 200060;4.上海市普陀区人民医院中心实验室,上海 200060)
乳腺癌是女性最常见的恶性肿瘤[1]。人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)定位于染色体17q21,编码相对分子质量为185 000的跨膜蛋白,是表皮生长因子受体(epidermal growth factor receptor,EGFR)家族的成员,具有细胞内酪氨酸激酶样活性,通过不同的信号传导通路,最终导致细胞无序增殖和恶性转化。HER2的高表达发生在乳腺癌、胃癌、卵巢癌和肺癌中[2],与肿瘤侵袭性生长和患者较差的预后相关。HER2的高表达与HER2基因扩增有关,然而在10%~20% HER2高表达的乳腺癌、胃癌和绝大部分HER2阳性的肺癌患者[3]中,HER2的高表达发生在没有增加基因拷贝数的情况下,提示HER2转录失调可能是HER2高表达的机制之一,其中表观遗传学机制,如启动子高甲基化可阻碍基因转录。尽管HER2高表达与患者预后不良有关,但对HER2基因启动子甲基化和HER2基因表达机制的研究甚少。金姝等[4]采用甲基化特异性聚合酶链反应(methylation-specific polymerase chain reaction,MSP)研究发现,HER2阳性乳腺癌组织HER2基因启动子CpG岛非甲基化率高于HER2阴性乳腺癌组织[4],但该方法为定性研究,大量信息未能被发掘。因此,本研究采用焦磷酸测序方法,定量检测HER2基因启动子CpG岛甲基化率,并比较癌组织与癌旁组织甲基化率和HER2 mRNA表达的差异,分析HER2基因启动子CpG岛甲基化水平与HER2基因活化机制的关系。
1 材料和方法
1.1 研究对象
选取2009年1月—2010年12月于上海市普陀区人民医院手术治疗并经病理确诊的乳腺癌患者50例,均为女性,年龄35~89岁,临床资料完整。按美国癌症联合委员会(American Joint Committee on Cancer,AJCC)TNM分期标准(第6版)将50例乳腺癌患者分为0期5例、Ⅰ期14例、Ⅱ期25例、Ⅲ期6例。术后立即取癌组织样本和癌旁组织[距离肿瘤边缘>1~<2 cm处、肉眼观察示外观正常,避开坏死、炎症部位,切片显示乳腺组织占比>40%,经病理检查确认)样本置液氮冻存备用。
1.2 试剂和仪器
Gene Quant Ⅱ型RNA/DNA计算器(瑞典Pharmacia Biotech公司),Neofuge 15R型高速冷冻离心机[力新仪器(上海)有限公司],S1000 thermal cycler PCR扩增仪(美国Termo Fisher公司),Tanon 1600R凝胶成像分析系统(上海天能科技有限公司),LightCycler480荧光定量PCR仪(瑞士罗氏公司)。2 mmol/L each dNTP Mix、Taq DNA Polymeraser、RevertAid First Strand cDNA Synthesis Kit购自美国Fermentas公司。琼脂糖购自生工生物工程(上海)股份有限公司。SYBR Premix Ex Taq购自日本TAKARA公司。TRIzol Reagent购自美国Invitrogen公司。FlexiGene DNA Kit和QIAGEN EpiTect Bisulfite购自美国QIAGEN公司。
1.3 方法
1.3.1 DNA抽提 采用FlexiGene DNA Kit抽提基因组DNA,严格按说明书操作。
1.3.2 甲基化修饰 采用QIAGEN EpiTect Bisulfite进行甲基化修饰,严格按说明书操作。
1.3.3 甲基化修饰后的聚合酶链反应(polymerase chain reaciton,PCR)HER2基因有不同的转录子,在genecard上可以查到2个启动子序列,长度分别为929和1 100 bp。本研究分别为2个启动子序列各设计了一套引物,根据引物的分值选择第2个启动子序列作为靶序列,由深圳华大基因科技有限公司合成引物。引物序列见表1。反应体系:总体积50 μL,上、下游引物(50 pmo/μL)各1 μL,dNTP(10 mmol/L)1 μL,模版2 μL,Taq(5 U/μL)0.2 μL,5×buffer 10 μL,用去离子水补足体积。反应条件:预变性95 ℃ 3 min;变性94 ℃ 30 s,退火51 ℃ 30 s,延伸72 ℃ 1 min,40个循环;72 ℃ 7 min。
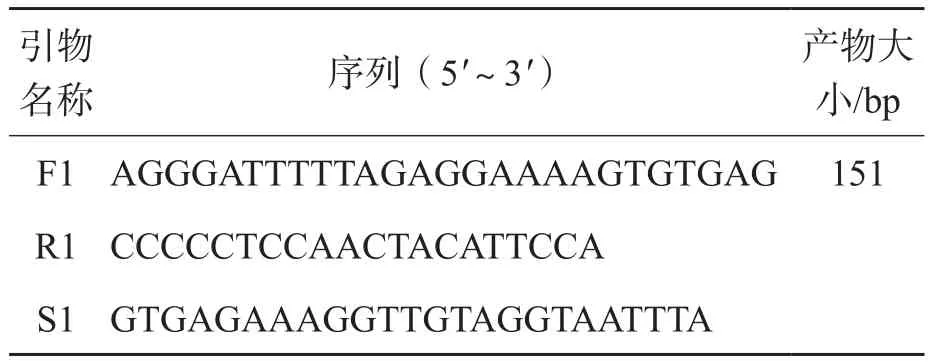
表1 甲基化修饰后的PCR和焦磷酸测序引物序列
1.3.4 焦磷酸测序 测序引物起始位点位于1 100 bp启动子的694 bp处。序列见表1中的S1引物。分析的6个甲基化位点位于720~757 bp处,长度为38 bp,见图1。测序由晶能生物技术(上海)有限公司完成。
1.3.5 RNA提取 采用TRIzol Reagent提取RNA,按试剂盒说明书进行操作。测定RNA浓度后-80 ℃保存备用。
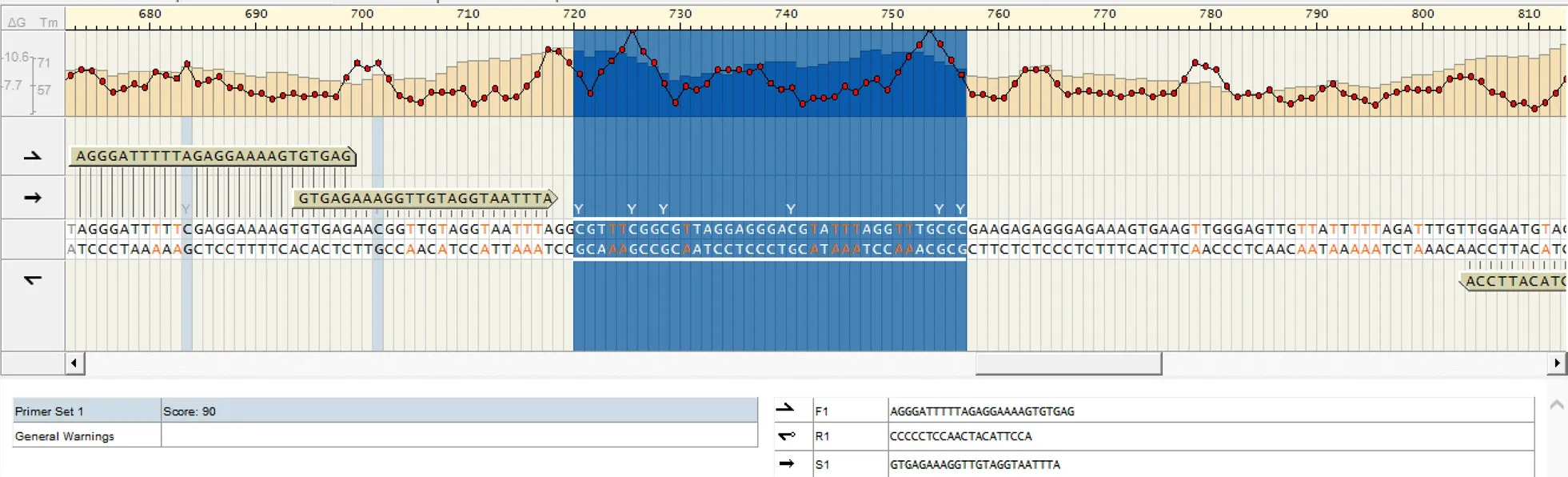
图1 HER2基因1 100 bp的启动子中720 bp~757 bp的6个甲基化位点
1.3.6 逆转录反应 采用RevertAid First Strand cDNA Synthesis Kit将RNA逆转录成互补DNA(complementary DNA,cDNA),严格按试剂盒说明书进行操作。
1.3.7 实时荧光定量PCR 按SYBR Premix Ex Taq说明书进行操作。引物序列见表2。HER2 mRNA的相对表达量用2-ΔCt值表示,其中ΔCt=Ct靶基因-Ct内参基因。反应体系:总体积25 μL,上、下游引物(10 pmol/μL)各1 μL,模版2 μL,SYBR Premix Ex Taq(2×)12.5 μL,去离子水8.5 μL。反应条件:预变性95 ℃ 10 s;变性95℃5 s,退火及延伸60 ℃ 30 s,40个循环。
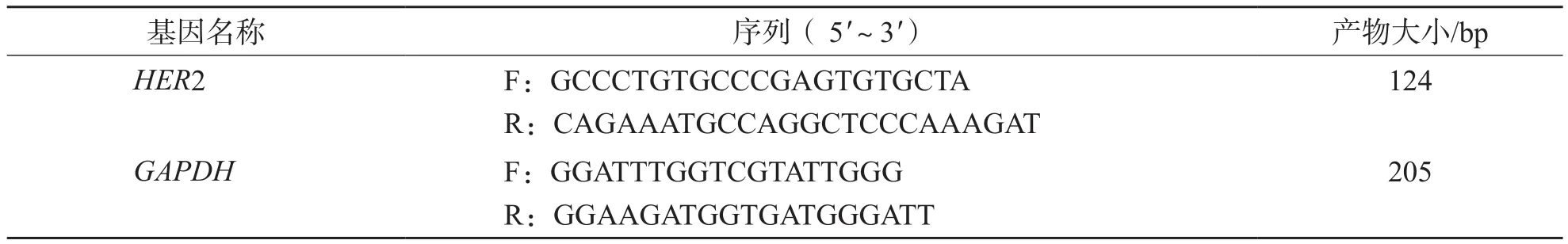
表2 实时荧光定量PCR引物序列
1.3.8 免疫组化法测定HER2蛋白表达 石蜡包埋组织切片经脱蜡、脱水后,滴加兔抗人HER2蛋白一抗,4 ℃过夜。磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤,滴加羊抗兔二抗,37 ℃温育30 min。滴加二氨基联苯胺(diaminobenzidine,DAB)显色。镜下见棕黄色颗粒后终止反应。苏木精复染。纯乙醇脱水,二甲苯透明,中性树脂封片。膜染色根据Hercep Test评分系统判断:“-”为完全没有着色或有<10%的肿瘤细胞有细胞膜着色,“+”为有>10%的肿瘤细胞呈现微弱不完整的细胞膜着色,“++”为有>10%的肿瘤细胞呈现弱至中度完整的细胞膜着色,“+++”为有>10%的肿瘤细胞呈现强且完整的细胞膜着色;“-”和“+”视为阴性,“++”和“+++”视为阳性。
1.4 统计学方法
采用SPSS 17.0软件进行统计分析。呈正态分布的数据以±s表示,2个组之间比较采用t检验。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用非参数Mann-Whitney检验。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组织中HER2基因启动子CpG岛甲基化率和HER2 mRNA的表达
50例乳腺癌患者的癌组织样本中HER2阳性17例,阳性率为34%,其中11例++、6例+++;阴性33例,其中21例-、12例+。HER2阳性癌组织HER2 mRNA相对表达量显著高于HER2阴性癌组织(P<0.05)。HER2阳性癌组织中HER2基因启动子6个甲基化位点的甲基化率稍低于HER2阴性癌组织,但差异均无统计学意义(P>0.05)。见表3。
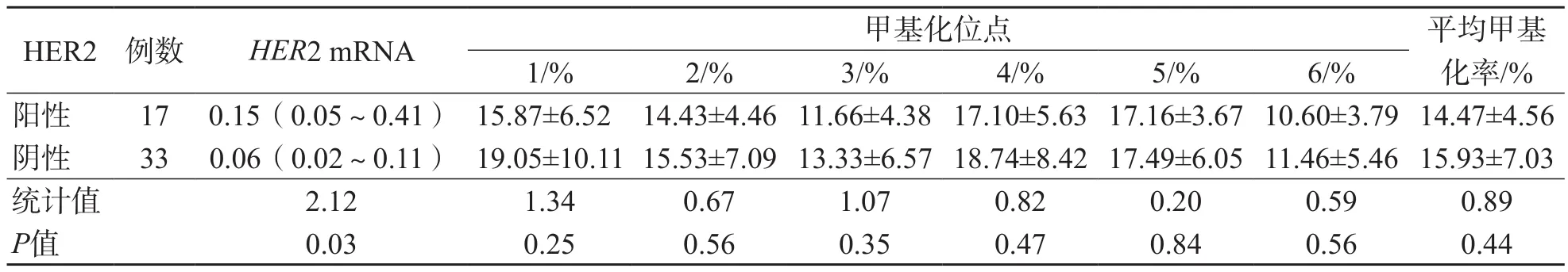
表3 HER2阳性和阴性癌组织之间HER2 mRNA和HER2基因启动子CpG岛甲基化率的比较
2.2 HER2阳性癌组织和癌旁组织HER2基因启动子CpG岛甲基化率和HER2 mRNA表达的比较
HER2阳性癌组织HER2 mRNA相对表达量与对应的癌旁组织比较,差异无统计学意义(P>0.05)。在6个甲基化位点中,除第6个位点外,其他位点的甲基化率癌组织与对应的癌旁组织之间差异均无统计学意义(P>0.05)。见表4。
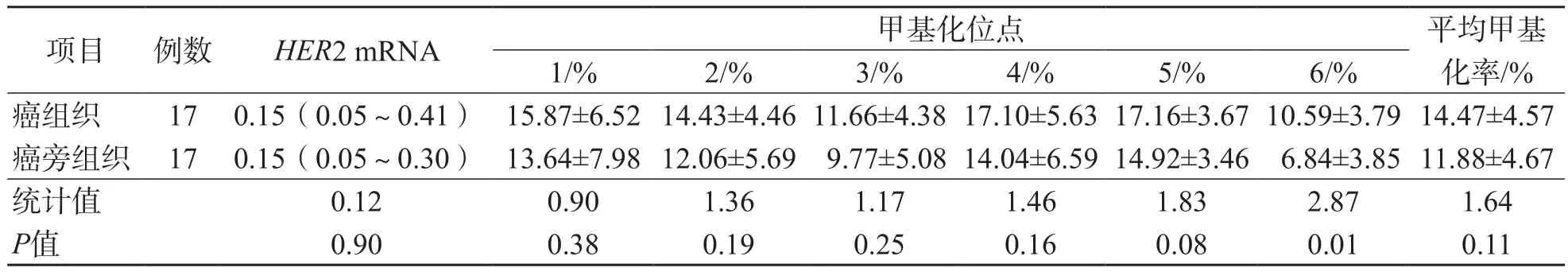
表4 HER2阳性癌组织与对应的癌旁组织之间HER2 mRNA相对表达量和HER2基因启动子CpG岛甲基化率比较
2.3 HER2阴性癌组织与对应的癌旁组织之间HER2基因启动子CpG岛甲基化率、HER2 mRNA相对表达量的比较
HER2阴性癌组织HER2 mRNA相对表达量显著低于对应的癌旁组织(P<0.05),而6个甲基化位点的甲基化率均高于对应的癌旁组织(P<0.05)。见表5。
2.4 HER2阳性与阴性癌旁组织之间HER2基因启动子CpG岛甲基化率和HER2 mRNA相对表达量的比较
HER2阳性癌旁组织HER2 mRNA相对表达量及HER2基因启动子CpG岛甲基化率与HER2阴性癌旁组织比较,差异均无统计学意义(P>0.05)。见表6。
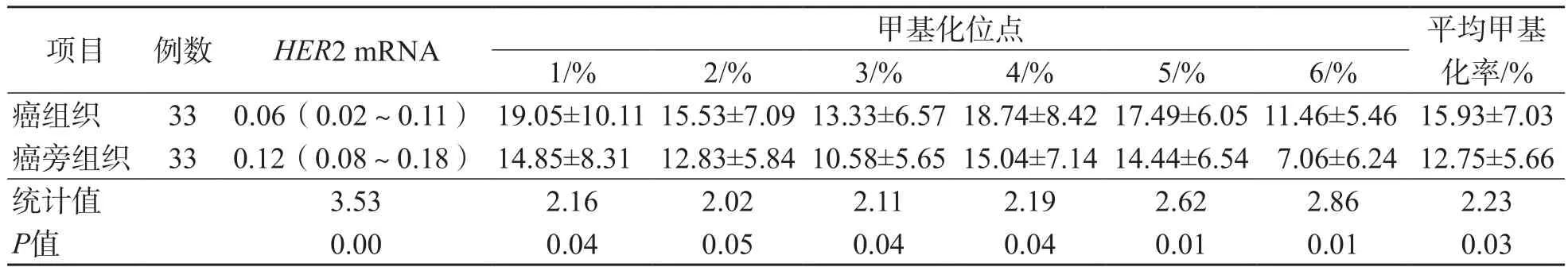
表5 HER2阴性癌组织与对应的癌旁组织之间HER2 mRNA相对表达量和HER2基因启动子CpG岛甲基化率的比较
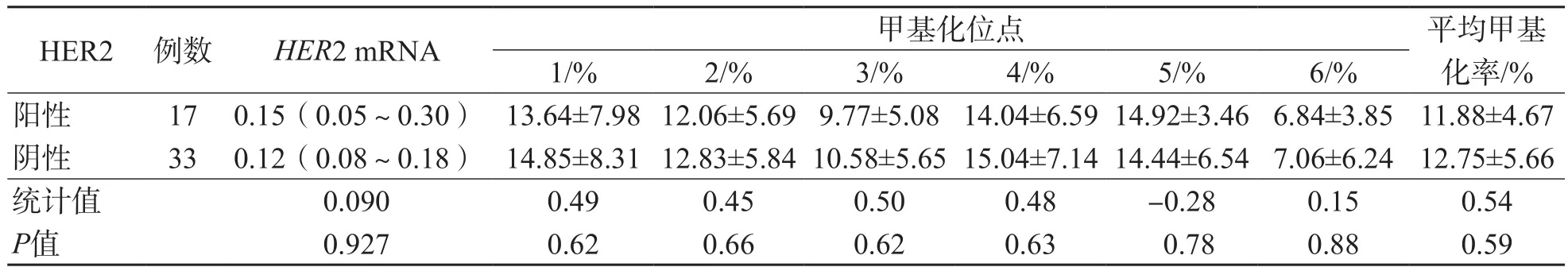
表6 HER2阳性与阴性癌旁组织之间HER2 mRNA相对表达量和HER2基因启动子CpG岛甲基化率的比较
3 讨论
乳腺癌是一种在分子、细胞、临床结局方面有高度异质性的疾病[5]。根据乳腺癌患者雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和HER2表达模式可分为4种临床型别:ER+、ER+/HER2-、HER2+和Triple-negative。基于芯片技术的基因表达分析可将乳腺癌分为4种mRNA亚型:luminal A型、luminal B型、HER2-enriched(HER2-E)型和Basal-like型。其中临床分型为HER2+的乳腺癌至少可以分为2种mRNA亚型:HER2-E亚型(约占50%,HER2 mRNA高表达,预后较差)和luminal亚型(HER2 mRNA低表达,预后较好)[6],HER2-E mRNA亚型的一个重要特点是HER2 mRNA高表达,不同mRNA亚型的患者无瘤生存期有显著差异[7]。由此可见,乳腺癌的临床分型与mRNA亚型不一致,其中一个现象即为HER2 mRNA与HER2蛋白表达不一致。只有当HER2蛋白和HER2 mRNA表达一致时,肿瘤才显示较强的受体酪氨酸激酶(receptor tyrosine kinase,RTK)信号,这提示HER2 mRNA水平比HER2蛋白水平更能代表生长因子受体家族信号通路的激活。有研究结果显示,乳腺癌中HER2 mRNA与HER2蛋白表达不一致,约有50%以上的HER2蛋白阳性癌组织中HER2 mRNA呈低表达[8-9],这种不一致的情况可能会影响临床肿瘤科医生对靶向治疗和新辅助化疗的决策[10]。本研究结果显示,HER2阳性癌组织和癌旁组织的HER2 mRNA表达较高,同时HER2阴性的癌旁组织HER2 mRNA也呈高表达,提示即使HER2蛋白低表达的癌旁组织仍有HER2下游信号通路被激活的可能。
乳腺癌的病理组织学表现为导管过度增生,继而发展为原位癌和浸润癌,最后发展为转移性疾病。目前的癌症发展理论表明,表观遗传修饰是肿瘤发生的早期事件[11]。但HER2基因的甲基化和mRNA表达在乳腺癌发生中的作用尚不清楚[12]。
GUY等[13]在小鼠乳腺肿瘤病毒(mouse mammary tumor virus,MMTV)启动子/增强子的转录控制下建立携带HER2基因的转基因小鼠,以评估HER2原癌基因在乳腺癌组织和癌旁组织中的特异性表达,结果显示,有70%(16/23)的小鼠癌组织HER2 mRNA的表达水平高于癌旁组织(P<0.05),剩余30%(7/23)的小鼠癌组织HER2 mRNA表达水平与癌旁组织相当(P>0.05),但癌组织中的HER2蛋白水平高于癌旁组织(P<0.05)。尽管HER2的过表达与人原发性乳腺癌的基因扩增有关,但该转基因小鼠的肿瘤并没有显示出HER2基因扩增的证据。这表明除基因扩增外还有其他机制可导致HER2转录的增加及蛋白表达增加,同时癌旁组织也可出现HER2 mRNA高表达。ZHOU等[14]的研究结果支持GUY等[13]得出的MMTV/HER2转基因小鼠乳腺肿瘤中HER2过表达与MMTV启动子低甲基化有关的结论。这些转基因小鼠的正常乳腺始终含有MMTV启动子的特定甲基化区域。金姝等[4]的研究结果提示,乳腺癌组织HER2基因启动子低甲基化与HER2蛋白高表达有关。由此可见,MMTV启动子从甲基化到低甲基化的转变可诱导HER2蛋白的高水平表达,这是一个乳腺上皮生长恶性转化的早期事件。FREUDENBERG等[15]的研究结果显示,HER2蛋白的过表达发生在从乳腺增生到乳腺导管原位癌的转变过程中,贯穿整个肿瘤的发展过程。一般来说,表观遗传修饰的程度随着疾病的进展而累积,而原发性肿瘤可能作为一个中心,甲基化密度从中心逐渐向外扩散到周围组织。YAN等[16]的研究结果显示,乳腺中存在从原发肿瘤向外延伸4 cm这一区域的表观遗传变化。POLYAK等[17]的研究结果也显示,不仅恶性细胞本身会出现甲基化缺陷,周围组织也会表现出甲基化缺陷。乳腺癌的“区域癌变”理论提示肿瘤周围正常的组织会出现致瘤性的修饰[18]。因此,癌组织周围的“正常”乳腺组织很有可能存在癌前细胞。
近年来,关于乳腺癌HER2基因启动子甲基化的研究报道较少。一般认为HER2蛋白的表达与诸多其他基因的甲基化状态有关,如多种基质金属蛋白酶启动子的非甲基化状态与HER2低表达有关[19],或者HER2内含子中有增强子,能增强HER2基因启动子的转录活性[20]。但很少有研究阐述HER2基因本身的甲基化状态。LINDQVIST等[21]对HER2阳性乳腺癌的全基因组甲基化进行了研究,结果显示,与正常组织比较,HER2阳性的乳腺癌组织中HER2基因启动子呈低甲基化,他们指出HER2阳性乳腺癌组织HER2基因甲基化状态的改变尚未见相关报道,但他们未对HER2阴性的乳腺癌组织和癌旁组织进行研究。
本研究研究结果显示,HER2阳性乳腺癌组织的HER2 mRNA相对表达量和HER2基因启动子CpG岛甲基化率与癌旁组织比较,差异均无统计学意义(P>0.05);HER2阴性乳腺癌组织HER2 mRNA相对表达量显著低于癌旁组织,甲基化率显著高于癌旁组织(P<0.05)。这提示,在HER2阴性的乳腺癌组织中,HER2基因启动子甲基化率升高可能是HER2 mRNA低表达的机制之一。本研究结果还显示,癌旁组织中HER2 mRNA呈高表达,提示这些组织受到了累及,但未完全转化,肿瘤组织周围外观正常的癌旁组织已出现了表观遗传学改变的早期事件。另外,HER2阳性癌组织HER2 mRNA表达水平显著高于HER2阴性癌组织(P<0.05),而甲基化率差异无统计学意义(P>0.05),但HER2阳性乳腺癌组织甲基化率呈降低趋势,与LINDQVIST等[21]的研究结果一致。值得注意的是,本研究结果显示,癌旁组织HER2启动子低甲基化与HER2 mRNA高表达同时发生,但与HER2蛋白表达无关,因此癌旁组织HER2蛋白的表达可能存在转录后调控机制,抑制HER2蛋白的表达。
综上所述,在HER2阴性的乳腺癌组织中,HER2基因启动子CpG岛高甲基化及HER2 mRNA低表达,癌旁组织的HER2基因启动子CpG岛低甲基化与HER2 mRNA高表达同时存在,揭示了HER2基因甲基化与其表达的关系,为HER2在乳腺癌中的作用机制研究提供了实验和理论基础。另外,癌旁组织异常表达HER2 mRNA,是否可预示其下游RTK途径的激活还有待进一步研究。
