紫花苜蓿根际氢氧化细菌的分离及其对小麦种子促生作用的研究
2020-06-16李璐璐李志英常小娟
王 琳, 李璐璐, 李志英, 常小娟
(1.西安医学院 医学技术系,陕西 西安 710021;2.西北大学 生命科学学院,陕西 西安 710069)
在长期的农业生产实践中,人们总结出了豆科作物轮作、间作能够增产的规律,但对其生理过程及机制知之甚少[1]。二十世纪初,科学家通过实验,发现了豆科植物根瘤在固氮过程中会释放H2,但在土壤中检测到的H2量却很少甚至没有,因此推断这种氢气消失的现象可能与土壤中某一种或某一类微生物有关[2-3]。Mclearn等[4]确定土壤中的这类微生物可以氧化氢气,并将这一类微生物命名为氢氧化细菌。加拿大圣玛丽大学的董忠民教授在豆科植物共生固氮实验的过程中,发现氢气对土壤的影响是和氢氧化细菌相关的,这种细菌会在根际土壤中形成可以促进植物生长的物质,或者通过抑制一些对植物生长有害的物质起到促生作用。豆科植物根瘤固氮释放的H2及其依赖于H2而生长的氢氧化细菌构成了豆科植物根际所特有的微生物群落结构,并对植物根际土壤微生物以及植物病原微生物生态系统产生有益影响[5-7]。开展豆科作物根际氢氧化细菌的促生实验研究,有助于丰富具有促生作用的根际微生物资源,揭示与豆科作物的轮作、间作效益相关的分子基础,为开拓农业可持续发展提供新思路。进行豆科植物共生固氮放氢的研究必将丰富生物固氮学的内容,并对土壤肥力和养分循环研究起到促进作用。
1 材料与方法
1.1 材料
1.1.1 土壤样品 土样取自陕西省铜川新区紫花苜蓿根际土壤。采用“S 形采样法”在苜蓿田中选取5个采样点,使用抖根法取样:首先将植物的根部从土壤中轻轻挖出,然后轻轻抖落和根部相结合的部分土壤,再用无菌小刷子刷取,将刷得的土壤样品混合在一起,过2 mm筛,将其分成3等份-20 ℃冰箱保存。
1.1.2 培养基 ①MSA无机盐培养基:K2HPO42.0 g,KH2PO41.0 g,NaCl 5.0 g,(NH4)2SO45.0 g,MgSO40.2 g,CaCl20.01 g,FeSO4·7H2O 0.01 g,琼脂 15~20 g,蒸馏水 1 000 mL,pH 7.2,121℃灭菌20 min。②牛肉膏蛋白胨培养基:牛肉膏 3 g,蛋白胨 10 g,NaCl 5 g,琼脂 15~20 g,蒸馏水1 000 mL,pH 7.2~7.4。
1.1.3 主要试剂 琼脂为日本分装进口,其余试剂均为国产分析纯。
1.1.4 仪器与设备 自动高压灭菌锅(HVA-85,株式会社平山制作所),电子天平(JY2002,上海精密科学仪器有限公司),生化培养箱(LRH-250F,上海奇欣科学仪器有限公司),涡旋仪(QL-861,江苏海门其林贝尔仪器制造有限公司),台式低速离心机(TDL-5A,上海菲恰尔分析仪器有限责任有限公司)。
1.2 方法
1.2.1 氢氧化细菌的分离 取10 g土样转移到装有90 mL无菌水的锥形瓶中,置于摇床中摇匀(180 r/min,30 min)。吸取悬浮液0.1 mL加入到0.9 mL无菌水中混匀,做一系列10倍梯度的稀释,最终稀释倍数为10-12。从每个梯度取0.1 mL土壤稀释液于MSA无机盐培养基[8-9]上涂布,每个梯度3个重复。平板倒置于连续通氢装置(电解水制氢,浓度为4.16×10-4~2.42×10-3mol/L)[10]中30 ℃培养14 d。
1.2.2 菌株氢化酶活性测定 筛选含有氢化酶的细菌常用的实验方法是TTC(2,3,5-三苯基氯化四氮唑)法[11]。灭菌的滤膜放置于MSA无机盐培养基,将分离的菌株点接到滤膜上再放入气体循环培养体系中。待滤膜长出明显菌落后,室温下在空气黑暗的条件中10~20 min,观察菌落可能出现的颜色变化;再放入通入氢气的密闭容器中,室温下放置10~20 min,观察菌落颜色变化。在空气中菌落颜色没有变化,而在氢气条件下变红色的菌株具有氢化酶活性为阳性,即为含氢化酶的细菌,每个菌株3次重复。
1.2.3 菌株自养能力的测定 利用氢气作为唯一能源鉴定待测菌株是否进行自养生长,是比较严格的检测氢氧化细菌的方法。①平板培养法:取氢化酶活性较高的菌株,制备菌悬液后涂布于MSA无机盐培养基,无菌水涂布的培养基作为空白对照。将平板倒置于气体循环培养体系中,连续培养2周,观察菌落的生长情况。另一组培养基直接放置于空气中,在室温条件下连续培养2周,观察菌落的生长情况,判断菌株是否能以氢气作为唯一能源进行自养生长。②摇床培养法:将待测菌株接种到MSA液体培养基中,分成两组。一组锥形瓶用无菌橡胶塞封口密闭,橡胶塞上装有进气管和出气管,用含氢气的混合气体将锥形瓶中的气体置换,塞紧管口,30 ℃,120 r/min摇床震荡培养,隔2天将锥形瓶中气体置换1次,培养1周。另一组锥形瓶中不通氢气,30 ℃,120 r/min摇床好氧培养。每天对菌悬液取样,721分光光度计560 nm波长条件下,测量菌悬液的OD值,检测氢气对菌株生长的影响。
1.2.4 菌株的鉴定 ①细菌形态特征和生理生化特征鉴定:挑选的16株细菌的形态和生理生化特征鉴定参照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》(8版)[12-13]中的标准步骤进行。②16S rDNA序列测定:使用细菌DNA抽提试剂盒提取16株菌株的基因组DNA,然后选择细菌通用的引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)[14]对16株细菌的16S rDNA进行扩增。PCR(50 μL)反应条件如下:DNA模板2.0 μL,Reaction Buffer(5×) 10 μL,dNTPs 10 mmol/L,正向引物(10 μmol/L)1 μL,反向引物(10 μmol/L)1 μL,TaqDNA聚合酶1 μL,ddH2O 34 μL。PCR扩增过程:预变性95 ℃ 5 min,变性94 ℃ 1 min,退火55 ℃ 1 min,延伸72 ℃ 2 min,最终延伸72 ℃ 10 min。将扩增出来的PCR产物用琼脂糖凝胶电泳检测后送至西安擎科泽西生物技术有限公司进行基因测序,在GenBank中与已知的序列比对并进行系统发育分析,获取菌株的分类地位和相应菌株的GenBank登录号。
1.2.5 小麦促生实验 然后选取饱满、无虫害、大小相近的小麦种子,放入5倍于种子量的水中,轻轻搅拌15 min左右,30 ℃温水浸泡6 h(浸泡时间合适,若时间太长,种子将会进行无氧呼吸,产生的乙醇会损伤种子,使发芽率降低;若时间太短,种子内抑制物无法浸出)[15],再用75%的乙醇处理1 min后,用无菌水冲洗去除乙醇,再用次氯酸钠浸泡5 min,用无菌水多次冲洗干净。将消毒的小麦种子置于无菌的培养皿中(培养皿中铺有灭菌的滤纸),每个培养皿中放15粒小麦种子,上面覆盖灭菌的湿润纱布,27 ℃暗处催芽2 d。将待测的菌株接种于LB液体培养基中,摇床震荡培养(27 ℃,180 r/min,48 h)。挑选发芽状况基本一致的小麦种子在15 mL相同浓度的菌悬液中放置3 h,在铺有无菌滤纸的平板上继续光照培养10 d,光暗时间分配为1∶1,观察小麦的生长情况,10 d后记录小麦的根长、芽长、鲜重和干重,灭活的菌悬液设置对照组。
2 结果与分析
2.1 氢氧化细菌的分离纯化
在MSA无机盐固体平板上30 ℃培养14 d后,挑取不同形态的单菌落进一步划线纯化,然后利用TTC试验法对其进行氢化酶的定性检测,得到45株氢化酶阳性菌株,其中具有自养能力的16株(表1),这些菌株具有氢化酶活性,并且在只有氢气作为能源的情况下,在固体和液体培养基中都能生长,判定这些菌株为氢氧化细菌,并于-80 ℃保藏备用。

表1 菌株氢化酶活性及自养能力检测

续表1
注:在氢化酶活性实验中,“+”表示阳性, “-”表示阴性,其中 “++”代表红棕色,“+”代表粉红色;在自养实验中,“+”表示菌株能够自养生长,“-”表示菌株不能进行自养生长
2.2 菌株鉴定
2.2.1 菌株的形态特征和生理生化特征鉴定 结果见表2、表3。
2.2.2 16S rDNA序列分析 将测序得到的菌种序列提交给GenBank,获取登录号并进行Blast序列比对,使用最大似然法对16株菌进行系统发育分析,其中1-0-19、2-3-6、3-0-15、3-1-17属于微杆菌属(Microbacterium);1-2-3、1-2-9、2-2-16、2-3-1属于节细菌属(Arthrobacter),其余菌株分类和GenBank登录号见表4。
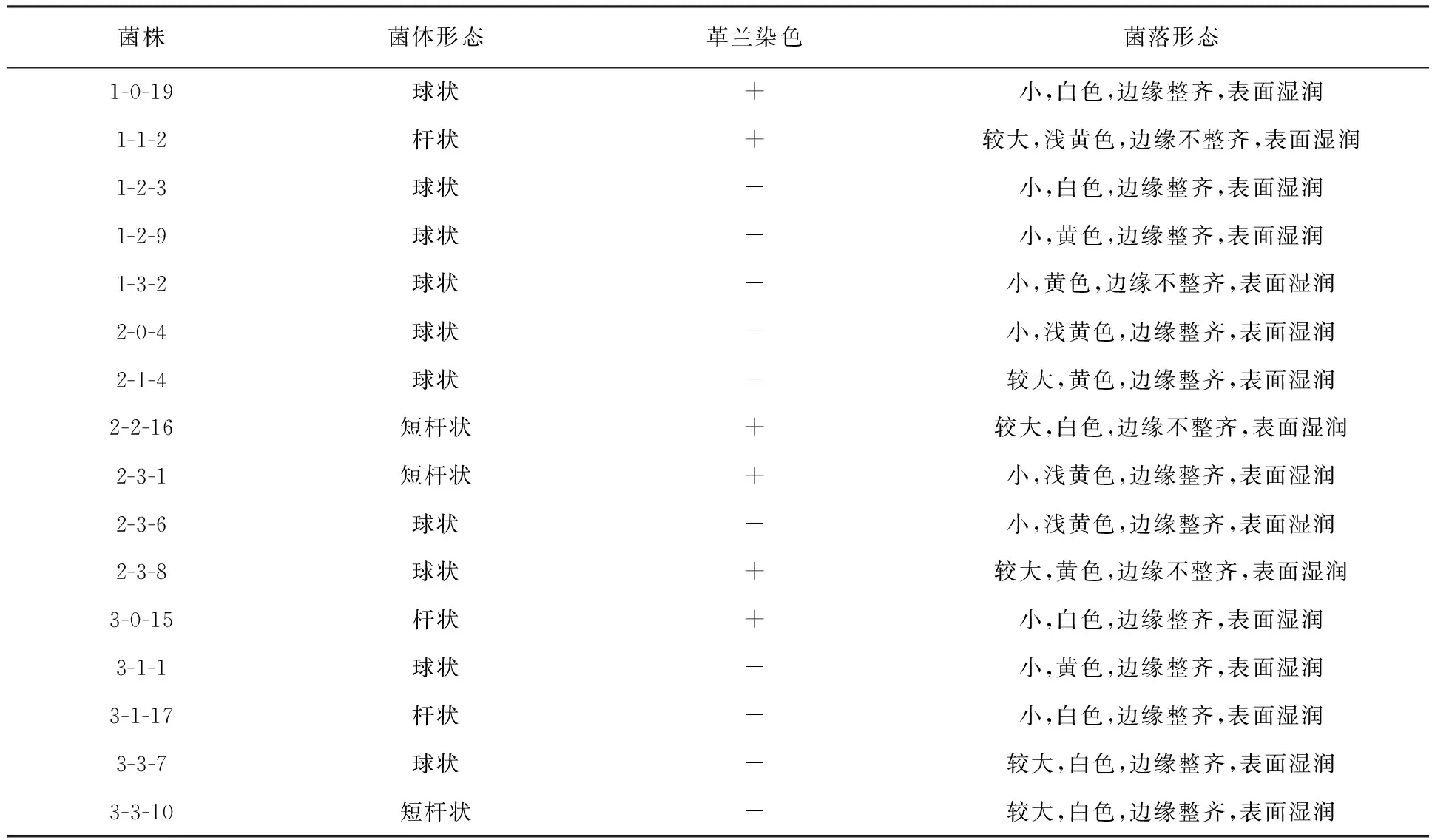
表2 菌株的形态特征
注:“+”表示阳性,“-”表示阴性,表3同

表3 菌株生理生化特征

续表3

表4 菌株的种属划分

续表4
2.3 菌株对小麦种子促生作用
各待测菌株制成的菌液浸泡小麦种子的生长情况明显优于对照,小麦根长、芽长的生长量都高于对照,小麦鲜重的增加量也都高于对照(表5、图1、图2)。
与对照相比,菌液1-0-19处理过的小麦根长、芽长、鲜重分别增加了25%、42%、48%,菌液1-1-2处理后分别增加79%、44%、59%,菌液1-2-3处理后分别增加112%、27%、70%,菌液1-2-9处理后分别增加122%、50%、82%,菌液1-3-2处理分别增加86%、69%、81%,菌液2-0-4处理分别增加49%、33%、73%,菌液2-1-4处理后分别增加了128%、55%、89%,经菌液2-2-16处理后分别增加31%、87%、103%,菌液2-3-1处理后分别增加了84%、71%、66%,菌液2-3-6处理衙分别增加102%、66%、55%,菌液3-0-15处理后增加58%、67%、59%,菌液3-1-1处理后分别增长为111%、73%、72%,菌液3-1-17处理过后分别增加81%、62%、59%,菌液3-3-10处理后分别增加了96%、73%、52%。
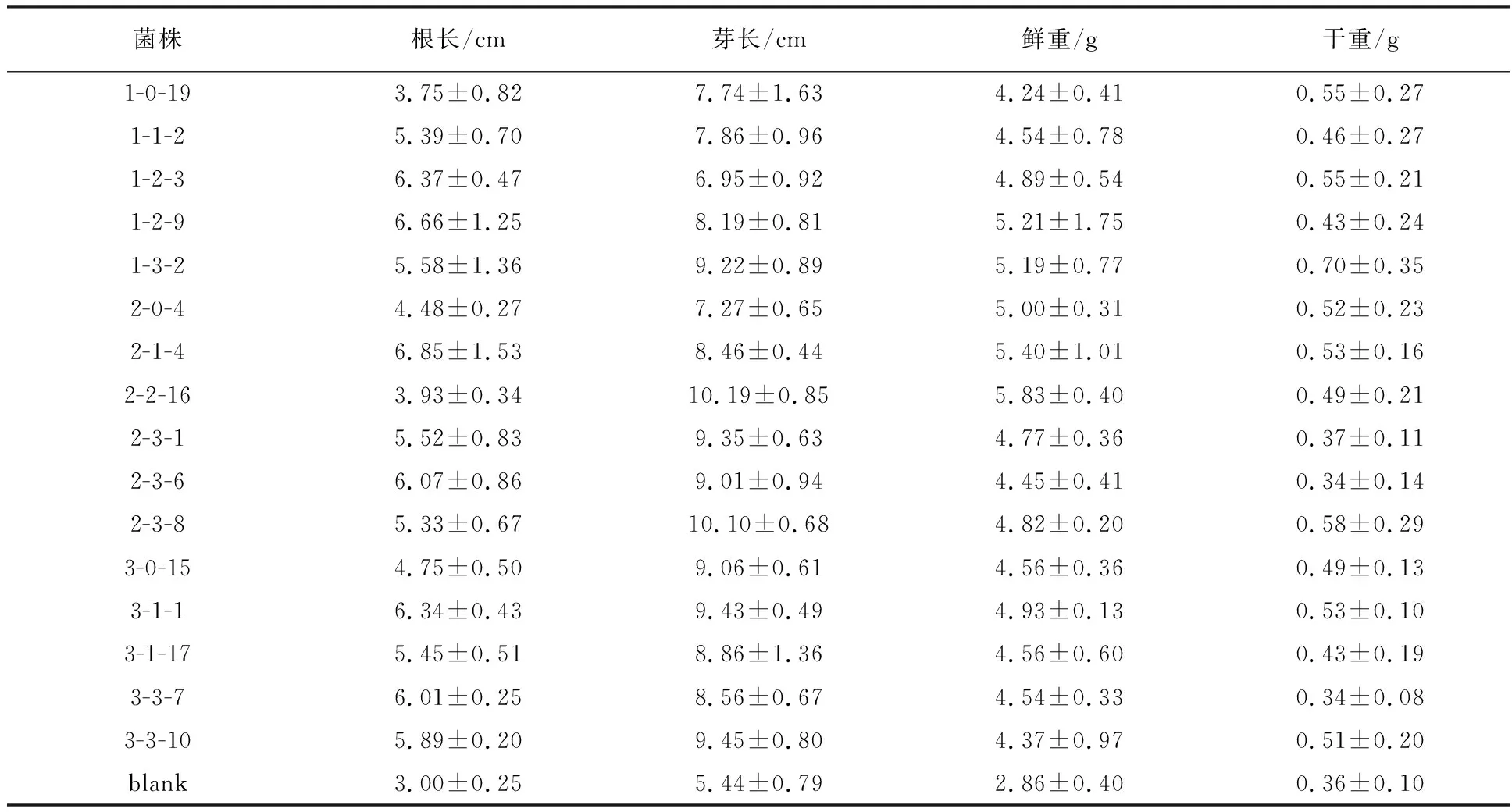
表5 菌株对小麦幼苗生长的影响
注:图中数值均为3次重复的平均值,“±”后面的数值为标准差

图1 菌株对小麦种子根长和芽长的影响Fig.1 The effect of strain on wheat seed root and bud length
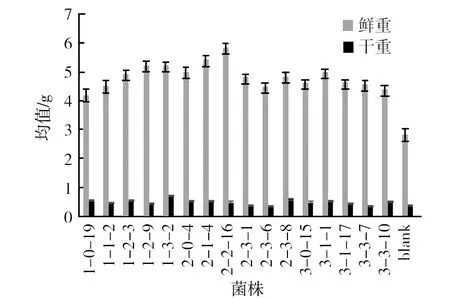
图2 菌株对萌发小麦鲜重和干重的影响Fig.2 The effect of strains on fresh and dry weight of wheat germination
3 讨 论
氢氧化细菌是一类兼性化能自养细菌,在无机培养条件下,能以氢气做为能源物质固定二氧化碳获得能量,因此在分离氢氧化细菌时,通常在无机培养基中通入氢气使氢氧化细菌得以富集。一般常用的方法有配气法、液体培养系统和气体循环培养体系三种[16-17]。其中配气法和液体培养体系存在很多不足,比如氢气浓度不稳定,操作比较复杂并有一定的安全隐患。陈兴都等[18]在Dong等[19]的基础上,设计了能够产生氢气、利用氢气的一套气体循环培养体系,并且摸索出一系列在实验室条件下分离氢氧化细菌的方法。本研究利用气体循环培养体系对氢氧化细菌进行分离。利用氢气进行化能自养生长是氢氧化细菌的一个分类指标,因此可以利用这一特点对氢氧化细菌进行分离。实验过程中将矿质盐无机培养基作为微生物生长的场所,在培养基中加入灭菌的土壤悬液,以提供氢氧化细菌生长所需的一些微量元素,使培养基成分更加全面。
筛选氢氧化细菌常用TTC法和自养能力检测方法。TTC法定性氢化酶的活性检测简单易行,但是试验中可能会出现假阳性的实验结果。菌株既有较强的氢化酶活性,又能进行自养生长,就可以初步判定该菌株属于氢氧化细菌。通过上述方法,从45株氢化酶活性阳性菌株中筛选出16株具有自养能力的菌株。
通过生理生化特性对菌株的分类地位进行初步判断,16S rDNA测序分析结果支持了菌株的生理生化鉴定结果,表明从苜蓿中分离得到的氢氧化细菌分别属于微杆菌属、类诺卡氏菌属、节细菌属、气微菌属、白蚁菌属、分枝杆菌属、纤维菌属、假黄单胞菌属、粘着剑菌属、叶杆菌属。
豆科植物固氮过程释放的氢气会富集土壤中的氢氧化细菌,而氢氧化细菌会分泌一些物质促进作物生长或者是抑制有害作物生长的物质来进一步实现促生作用[20]。陈兴都[21]在对大豆根际氢氧化细菌的促生研究中发现,菌株A11处理小麦使得根长相对增加397.6%,玉米根长相对生长219.7%;菌株A06的处理使小麦根长相对伸长361%,处理过的玉米根长相对生长226.3%。本研究对促生作用进行了验证,结果表明16株菌对小麦种子的萌发都有较明显的促进作用,在种子萌发的生长指标中,与其他指标相比,菌株对根长的伸长有较明显的促进作用,其促生机制有待进一步研究。
