分子探针11C-奥西替尼的自动化合成
2020-06-15劳业兴甘满权张洁霞
劳业兴,甘满权,张洁霞
(1.广州医科大学附属第一医院PET/CT中心;2.广州医科大学附属第一医院呼吸内科,广东 广州 510230)
非小细胞肺癌(non-small cell lung cancer,NSCLC)引起的肺癌占比高达80%~85%[1]。治疗方法包括肺手术切除、化疗以及放疗等,其中靶向治疗以其高特异性和相对较少不良反应为肺癌治疗提供了更好的选择方案。表皮生长因子-酪氨酸激酶抑制剂(EGFR-TKIs)是其中极富吸引力的一类靶向治疗药物,主要通过靶向癌细胞过量表达的蛋白质——表皮生长因子起到治疗作用。第一、二代EGFR-TKIs(吉非替尼、厄洛替尼、埃克替尼、阿法替尼)治疗EGFR突变非小细胞肺癌已经成为临床治疗重要方法[2]。然而,大多数患者经过一段时间治疗后都会因为生物或药理上的原因发生耐药性,比如T790M突变、较低的药物穿透性导致中枢神经系统肿瘤复发等[3,4]。第三代EGFR-TKIs因此被发展起来,其主要特点是靶向T790M突变的非小细胞肺癌,且具有更好的血脑屏障渗透性[5,6]。奥西替尼是阿斯利康公司研制的第三代EGFR-TKIs代表药物。它是一种口服、强效、不可逆的EGFR-TKIs,用于经过其它EGFR-TKIs治疗后进展的EGFR T790M突变阳性的非小细胞肺癌,为非小细胞肺癌尤其中枢系统转移癌的临床治疗提供了一种新的方案[3]。
许多特异性靶向EGFR激酶的化合物经正电子核素标记后,可以通过PET/CT影像技术对其药物作用机制进行基础或临床研究,如[11C]PD153035[7-9]、[18F]ML01[10]、[11C]ML03[11]、[11C]ML04[12]、[18F]ML04[13]、[18F]PEG6-IPQA[14]、 [18F]FEA-Erlotinib[15]、[11C]AZD8931[16]、[124I]morpholino-IPQA[17]等。以11C或18F原子取代EGFR-TKIs药物结构中的12C或19F原子,可以得到与临床用药结构相同的正电子药物,如[11C]Gefitinib[18], [18F]Gefitinib[19-21]、[11C]Erlotinib[22-27]、[18F]Afatinib[25,28]、以及[O-methyl-11C]Osimertinib[29-31],能完全表征其相应临床药物的生物学和药物动力学特点,通过PET/CT显像技术可以为药物研发和疾病机制研究提供精准信息。本文报道了一种通过自动化装置使用11C正电子放射性核素标记奥西替尼的方法。其与已报道的[O-methyl-11C]Osimertinib[29-31]制备方法相比区别在于使用标记前体不同,在氨基而非羟基上进行标记,不需要加碱,在温和条件下即可完成标记。该标记方法简单高效,标记所得药物具有很高的化学纯度和放射化学纯度,可以满足临床科研的需要。
1 材料与方法
1.1 仪器与试剂
美国通用公司MINItrace小型医用回旋加速器,TracerLab FX C正电子药物合成仪,赛默飞世尔公司Thermo UltiMate-3000高效液相色谱仪,Bioscan公司放射性检测器。前体去甲基奥西替尼由广誉生物科技有限公司提供,无水乙腈、三氟甲磺酸银、单质碘、Carboxen-1000等试剂购于美国Sigma公司,Porapak-Q购于美国Waters公司。
1.2 合成方法
1.2.111C-CH3OTf制备 启动MINItrace回旋加速器,通过9.6MeV质子在30 μA束流下轰击回旋加速器靶体中氮氧混合气(N2:O2=99.5/0.5),发生14N(p, α)11C 反应产生11C-CO2。11C-CO2通过预先活化的分子筛吸附,380 ℃解析后通过氮气载带进入TracerLab FX C合成仪。采用气相法将11C-CO2转化为11C-CH4,如图1所示。首先11C-CO2在高纯氮气载带下与氢气(100 mL/min)同时通过Ni催化剂,400 ℃下11C-CO2被还原为11C-CH4。11C-CH4被经过液氮冷却至-140 ℃CH4Trap中的 Carbosphere碳颗粒吸附。11C-CH4充分富集后,加热Carbosphere释放11C-CH4进入气体循环系统,与I2在730 ℃反应,通过碘的自由基反应转化为11C-CH3I。11C-CH3I被气体循环系统中MeI柱(Porapak-Q)在室温下吸附。11C-CH3I充分富集后,加热Porapak-Q至190 ℃释放11C-CH3I,经过由三氟甲磺酸银及Carboxen-1000®混合物填充的Me-TF柱,转化为11C-CH3OTf。
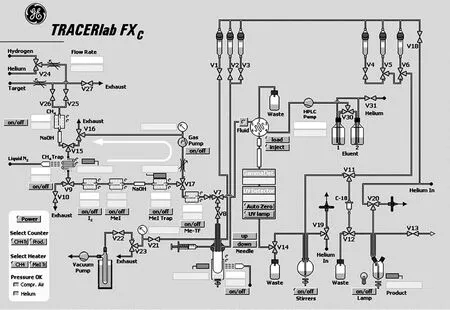
图1 TracerLab FX C 合成模块
1.2.211C-奥西替尼合成 反应条件如图2所示。11C-CH3OTf在20 mL/min氦气载带下,通入1 mL浓度为1-2 mg/mL的去甲基奥西替尼乙腈溶液中。将连接反应瓶的阀门关闭。前体在80 ℃下与11C-CH3OTf反应5分钟。反应液冷却至40 ℃后,进入半制备液相色谱分离纯化(色谱条件:色谱柱MACHEREY-NAGEL VP 250/10 Nucleosil 100-5C18 Nautilus,流动相为0.2%NH3·H2O EtOH:H2O=90∶10,流速为4 mL/min)。收集大约5.5分钟时的放射峰。生理盐水稀释后,通过Millex-GV 0.22 μm微孔滤膜滤过得到[11C]Osimertinib注射液。

a.H2, Ni, 400 ℃; b. I2, 730 ℃; c.AgOTf, 200 ℃; d.CH3CN, 80 ℃, 5 min
图2 反应试剂及条件
1.2.311C-奥西替尼纯度检查 采用高效液相色谱法对11C-奥西替尼的化学纯度、放射化学纯度进行检查。色谱条件:色谱柱Thermo Synoronis C18, 5 μm, 4.6×250 mm;流动相为2% NH3·H2O MeOH∶H2O=90∶10;流速为1 mL/min。检测器:254 nm紫外检测器,Bioscan flow-count FC-3600放射性检测器。
2 结果
2.1 11C-奥西替尼的合成
使用TracerLab FX C自动化合成装置,通过自定义合成程序合成11C-奥西替尼,用时在60 min以内,产物校正放化产率约为50%。使用半制备高效液相色谱进行分离纯化,产物出峰时间约为5.5 min(图3)。11C核素半衰期很短,仅20 min,该制备方法所用时间短、产率高,能较好解决放射性核素衰变过快常导致药量不足的问题,可以满足临床及科研的需要。
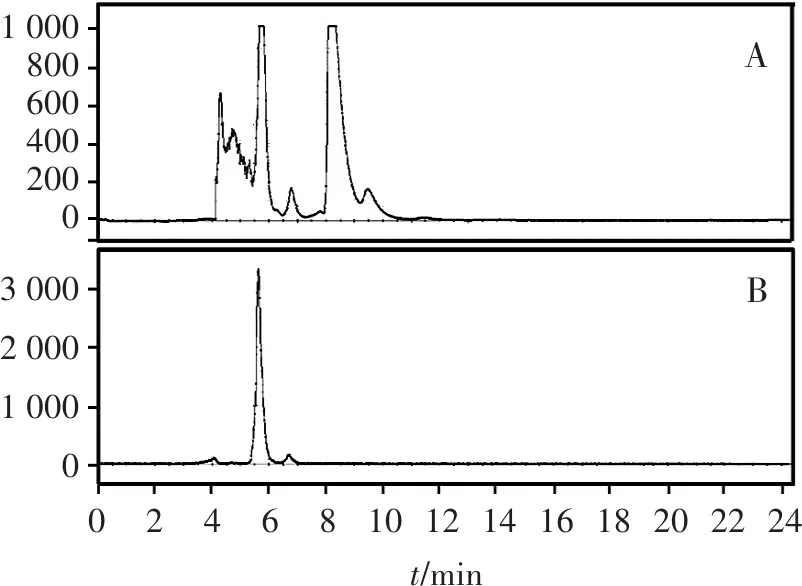
A. 254 nm紫外吸收图谱;B.γ-放射性色谱图
图311C-奥西替尼合成半制备液相色谱图
2.2 11C-奥西替尼的质量控制
采用高效液相色谱法进行纯度分析。使用该合成方法得到的11C-奥西替尼化学纯度>95%,放射化学纯度>99%(图4)。
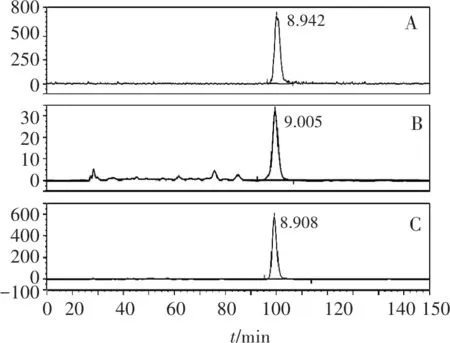
A.11C-奥西替尼γ-放射性色谱图;B.11C-奥西替尼254 nm紫外吸收图谱;C.12C-奥西替尼254 nm紫外吸收图谱
图411C-奥西替尼分析液相色谱图
3 讨论
在合成11C-奥西替尼过程中,我们对比了11C-CH3I和11C-CH3OTf作为亲核试剂对产率的影响。使用11C-CH3I作为亲核试剂时,产率较低。使用11C-CH3OTf作为亲核试剂时,产率明显得到提高,达到50%以上。在进行药物分离纯化中,使用乙醇水溶液(0.2%NH3·H2O EtOH:H2O=90∶10)作为流动相,前体与产物具有较好的分离度,产物出峰时间短,且避免使用乙腈、甲醇等有毒试剂,简化了后处理。制备时间缩短可以较好地减少因核素衰变导致的药物损失。
本方法通过自动化装置合成11C-奥西替尼,方法简便无需手动操作,减少了人员辐射剂量且提高了合成效率。通过该方法所得药物产率、化学纯度、放射化学纯度均较高,药物结构与临床使用的奥西替尼相同,可以在影像学或药代动力学实验中用来表征奥西替尼在动物体内的生物学行为,为对该药物进一步研究提供了条件。
