血必净注射液对重症急性胰腺炎大鼠腹内压的影响
2020-06-15罗键雄何梓健唐翔陈伟明陈泳华黄耀星苏伟
罗键雄,何梓健,唐翔,陈伟明,陈泳华,黄耀星,苏伟*
(1.广州医科大学附属市一人民医院重症医学科,广东 广州 510180;2.广州市第一人民医院南沙医院消化内科,广东 广州 511457)
重症急性胰腺炎(severe acute pancreatitis, SAP)是临床常见危重病,并发症多,病死率高。其发病机制复杂,胰酶原位激活并自身消化导致系统性炎症反应综合征(systemic inflammatory response syndrome, SIRS),从而继发一系列器官功能损害,引起多器官功能障碍综合征(Multiple organ dysfunction syndrome, MODS)[1]。腹腔内高压(intra-abdominal hypertension,IAH)是SAP的常见并发症之一,腹腔内压力(intra-abdominal pressure, IAP)持续升高可造成多器官功能损害,可导致腹腔间隔室综合征(abdominal compartment syndrome, ACS)的发生,引起一系列临床综合征[2]。本研究以SAP大鼠动物模型为研究对象,观察SAP大鼠发病过程中IAP、腹水量、胰腺和小肠的病理改变,及血浆淀粉酶(AMS)、内毒素(ET)、炎性细胞因子和二胺氧化酶(DAO)水平的变化,探讨血必净注射液早期干预对SAP大鼠对器官功能的保护作用。
1 材料与方法
1.1 实验动物与分组
SPF级成年SD大鼠15只,购自南方医科大学动物实验中心,体质量226~270 g,随机分为对照组、SAP组和治疗组,每组各5只。所有大鼠在造模前禁食12 h,可自由饮水。称重后麻醉,使用2%戊巴比妥钠(西安天茂化工有限公司)进行腹腔注射麻醉(5 ml/kg)。成功麻醉后学以仰卧并固定四肢于操作台,腹部去毛消毒,以上腹部正中切口2~3 cm进腹,寻找十二指肠并提起胆胰管,无损伤血浆夹闭胆胰管末端,4号钝性针头穿透胆胰管乳头对侧的十二指肠壁,进入胆胰管约5 mm,以无损伤血浆夹固定针头。SAP组和治疗组大鼠以0.2 ml/min的注射速度向胆胰管内逆行注射4.5%牛磺胆酸钠溶液(大连美仑公司,1 ml/kg),保留3 min后松开无损伤血浆夹并抽出针头,逐层缝合关腹。对照组大鼠以上述两组相同的速度由胆胰管逆行注射相同剂量的0.9%氯化钠溶液(广东大冢制药有限公司)。治疗组大鼠造模后立即予腹腔注射血必净注射液(天津红日药业股份有限公司,5 ml/kg)。最后,为各组大鼠皮下注射0.9%氯化钠溶液(20 ml/kg)。造模成功24 h后检测腹内压及腹水量,经腹腔却脉采血留取血液标本,处死大鼠并留取小肠及胰腺组织备检。血液标本3 000 rpm(离心半径10 cm)离心10 min,留取上清,置于-80 ℃冰箱中保存备检。
1.2 检测指标及方法
1.2.1IAP的检测 采用BL-420F生物机能实验系统(成都泰盟科技有限公司)。大鼠麻醉后采用仰卧位,左下腹穿刺,穿刺针头连接压力换能器,以腋中线水平为零点,大鼠呼气末、腹部肌肉无收缩时换能器所感受的压力为腹内压。
1.2.2腹水量的检测 沿着腹正中线剪开大鼠腹壁,观察腹水颜色,称取适量干棉球置入腹腔,用棉球吸净腹水,取出后称量棉球重量。腹水量=湿棉球重量-干棉球重量。
1.2.3血浆AMS、ET、炎性细胞因子及DAO水平的检测 采用全自动生物化学分析仪(奥林巴斯 AU5400,日本) 检测AMS;采用酶联免疫吸附法(ELISA)检测ET、TNF-α、IL-1β、IL-6和DAO的水平,试剂盒购自Elabscience公司。
1.2.4胰腺组织及小肠组织病理学检查 取大鼠胰腺及小肠组织行4%多聚甲醛固定,常规脱水石蜡包埋,切片后行苏木精-伊红(HE)染色,然后以盲选法选择玻片并请两位病理学专业医师在光镜下阅片,胰腺组织病理改变根据 Schmidt等[3]标准评分,小肠黏膜病理改变根据Chiu’s标准[4]评分。
1.3 统计学分析
2 结果
2.1 3组大鼠一般情况、胰腺组织病理评分及血浆AMS水平比较结果
对照组、SAP组、治疗组体质量分别为(253.60±14.67) g、(245.60±13.44) g、(246.40±8.35)g,3组比较,差异无统计学意义(P>0.05)。造模24 h后各组大鼠均无死亡。对照组大鼠一般情况良好,活动敏捷,胰腺组织可见轻微间质水肿及局部轻度的炎症浸润(图1-A);SAP组大鼠精神不振,腹胀和呼吸急促较明显,胰腺组织可见明显间质水肿,伴严重出血及血浆炎症浸润,大量腺泡细胞坏死(图1-B);治疗组大鼠一般情况尚可,腹胀不明显,胰腺组织可见间质水肿,伴有局灶性炎症浸润(图1-C)。
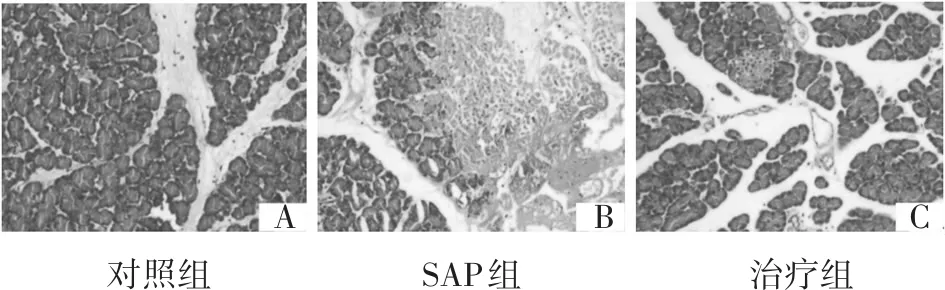
图1 3组大鼠胰腺组织病理改变(HE染色×100)
与对照组比较,SAP组和治疗组胰腺病理评分、血浆AMS水平明显升高(P<0.05),提示SAP模型造模成功。与SAP组比较,治疗组胰腺病理评分、血浆AMS水平明显下降(P<0.05),提示血必净注射液早期干预SAP大鼠可有效减轻胰腺组织损伤。见表1。
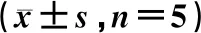
表1 3组大鼠胰腺组织病理评分及血浆AMS水平的比较
注:t1值:对照组vsSAP组;t2值:对照组vs治疗组;t3值:SAP组vs治疗组
2.2 3组大鼠IAP及腹水量比较结果
与对照组比较,SAP组IAP、腹水量明显升高(P<0.05),而治疗组则无明显差异(P>0.05),提示SAP大鼠早期可出现腹腔积液及IAH。与SAP组比较,治疗组IAP及腹水量明显下降(P<0.05),提示血必净注射液早期干预SAP大鼠可有效降低IAP及减少腹水形成。见表2。
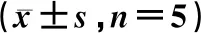
表2 3组大鼠IAP及腹水量的比较
注:t1或U1值:对照组vsSAP组;t2值:对照组vs治疗组;t3或U3值:SAP组vs治疗组
2.3 3组大鼠小肠黏膜病理评分、血浆ET及DAO水平比较结果
对照组小肠黏膜可见绒毛完整,仅有轻度水肿(图2-A);SAP组小肠黏膜可见绒毛不完整,绒毛上皮水肿明显,伴有脱落及溃疡形成,固有层炎症性细胞浸润,毛细血浆内红细胞积聚(图2-B);治疗组小肠黏膜可见绒毛基本完整,局部中度水肿(图2-C)。
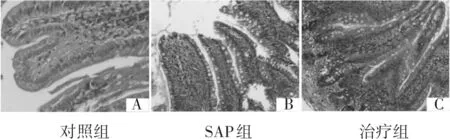
图2 3组大鼠小肠黏膜病理改变(HE染色 × 100)
与对照组比较,SAP组小肠病理评分、血浆ET及DAO水平明显升高(P<0.05),而治疗组小肠病理评分及血浆DAO水平也明显升高(P<0.05),提示SAP大鼠在发病早期已出现肠黏膜损伤和肠黏膜屏障功能障碍。与SAP组比较,治疗组小肠病理评分、血浆ET及DAO水平明显下降(P<0.05),提示血必净注射液早期干预SAP大鼠可减轻肠黏膜损伤,改善肠黏膜屏障功能障碍。见表3。
2.4 3组大鼠血浆炎性细胞因子水平比较结果
与对照组比较,SAP组血浆IL-1β及IL-6水平明显升高(P<0.05),而治疗组血浆TNF-α及IL-6水平也明显升高(P<0.05),提示SAP大鼠在发病早期已出现血浆炎性细胞因子水平明显升高。与SAP组比较,治疗组血浆TNF-α、IL-1β及IL-6水平明显下降(P<0.05),提示血必净注射液早期干预SAP大鼠可有效降低血浆炎性细胞因子水平。见表4。
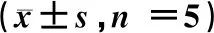
表3 3组大鼠小肠黏膜病理评分、血浆ET及DAO水平的比较
注:t1值:对照组vsSAP组;t2值:对照组vs治疗组;t3值:SAP组vs治疗组
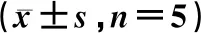
表4 3组大鼠血浆炎性细胞因子水平的比较
注:t1值:对照组vs SAP组;t2或U2值:对照组vs治疗组;;t3或U3值值:SAP组vs治疗组
3 讨论
SAP起病急,进展快,死亡率可达14%~30%[5],其发病过程与机体炎症反应高度相关。在SAP早期,受损的胰腺腺泡细胞可分泌IL-6、TNF-α等炎性细胞因子,并募集与活化外周血单核细胞,促进其合成及分泌更多的炎性细胞因子,形成瀑布式反应,导致SIRS的发生,造成多脏器功能受损,而肠道则是常见的受累器官之一。包括SIRS在内的各种因素诱发肠黏膜屏障功能障碍,引起肠道细菌异位及内毒素入血,造成内源性脓毒症,进一步加重器官功能损害,最终发展为MODS[1,6]。本研究结果显示,与对照组相比,SAP组大鼠精神萎靡,气促及腹胀明显,胰腺组织病理检查出现明显的充血水肿、出血与坏死,胰腺组织病理评分、血浆AMS、IL-1β及IL-6水平明显升高,提示造模24 h后,大鼠胰腺组织已经出现严重的炎症反应,受损的胰腺细胞刺激与活化免疫细胞及组织细胞,最终导致血浆IL-1β及IL-6等炎性细胞因子水平明显升高。
IAH与ACS是SAP常见并发症之一,SAP患者IAH发病率可高达78%[7],其发病机制与SAP发病过程中伴随的SIRS密切相关[8]。在SAP发病过程中,胰腺组织肿胀或坏死,炎症细胞浸润,以及胰周和后腹膜大量的炎性渗出造成胰包膜内和后腹膜高压。受损的腺泡细胞释放大量损伤相关分子物质和释放消化酶,刺激免疫细胞及组织细胞产生大量的炎性细胞因子并作用于血浆内皮细胞,导致血浆通透性增加,引起腹腔脏器及胃肠道充血水肿,使得胃肠蠕动功能明显下降,造成肠道内积气积液及腹腔内大量渗出,诱发IAH[8-9]。而临床研究也证实,SAP患者血IL-6和降钙素原等炎症指标与IAP在病情发展时呈同趋势升高,在治疗后呈同趋势下降,提示IAP与血浆炎性细胞因子水平存在相关性[10]。此外,有研究表明[11],IAP持续升高可导致SAP患者腹腔灌注压持续下降,加重肠道缺血缺氧和微循环障碍,进一步加重肠黏膜屏障功能障碍。本研究结果还显示,SAP组IAP、腹水量、小肠病理评分及血浆IL-1β、IL-6、ET及DAO水平均显著高于对照组,提示SAP大鼠可能已经同时存在SIRS、IAH和肠黏膜屏障功能障碍,后二者可能互为因果、相互促进,血浆炎性细胞因子水平升高与IAH和肠黏膜屏障功能障碍密切相关。
血必净注射液是主要以丹参、川芎、当归、红花、赤芍等中药提取物炼制而成的静脉制剂,具有清热解毒、扶正祛邪和活血化瘀等功效[12]。既往研究报道,早期应用血必净注射液治疗可抑制炎性细胞因子的合成和释放,降低血浆炎性细胞因子水平,维持机体免疫稳态,同时可拮抗内毒素并减少内毒素在体内积聚,降低循环氧自由基的总量[13],还能保护血浆内皮细胞,稳定微循环[14],维持正常的血浆渗透性,减少炎性渗出[15]。肖芳等[16]研究显示,血必净可下调血浆IL-6、TNF-α等炎性细胞因子及DAO水平,作者认为血必净可通过抑制炎性细胞因子释放,保护肠黏膜屏障功能并促进腹水吸收。在本研究中,治疗组大鼠IAP、腹水量、胰腺和小肠病理评分以及血浆AMS、TNF-α、IL-1β、IL-6、ET和DAO水平均较SAP组显著下降,提示血必净注射液早期干预SAP大鼠可有效延缓IAH和IMBD的发生,究其原因,可能是血必净注射液通过弱化机体炎症反应,减少了炎性细胞因子的生成及释放,减轻了血浆内皮损伤及其造成的毛细血浆渗漏综合征,降低了炎症反应造成的肠黏膜组织损伤,从而达到保护肠黏膜屏障功能的效果。由此推测,血必净注射液不仅能降低IAP和减少腹腔积液,还能改善肠黏膜屏障功能障碍,可能在SAP发病早期具有保护重要脏器功能及防治并发症的治疗效果。
综上所述,SIRS在SAP大鼠IAH的发病过程中起着重要作用,并与肠黏膜屏障功能障碍密切相关。SAP发病早期应用血必净注射液不但能有效降低SAP大鼠的IAP和血浆炎性细胞因子水平,还能减少腹腔积液及延缓肠黏膜屏障功能障碍。但值得注意的是,虽然炎症反应在SAP并IAH的发病过程中起着重要作用,但血必净注射液有效干预SAP并IAH的治疗靶点尚未完全明确,尚有待进一步研究。
