CoCl2对NaBH4/Al体系储氢性能的影响
2020-06-15赖歆玥郑雪萍朱永胜元想胜贾润楠
赖歆玥,郑雪萍,朱永胜,元想胜,贾润楠
(长安大学 材料科学与工程学院,陕西 西安 710054)
随着科学技术的发展,化石能源逐渐被人类开采耗尽[1]。氢能源因其重量轻、资源丰富、可回收和环保而受到人们的格外关注[2-4]。为了开发和利用氢能源,首先需解决氢的生产这一问题[5]。与传统的制氢方法相比,硼氢化钠水解制氢可以获得更高的理论产氢量[6-9]。
同时,铝水解制氢技术也颇受青睐,其理论制氢量较为理想[10-13]。但目前铝水解制氢技术存在的问题是如何去除铝表面的氧化层从而提高产氢速率[14-17]。
本文为了提高NaBH4水解制氢的产氢速率,使用NaBH4和Al形成新的制氢系统,并使用CoCl2作为催化剂。通过排水法测量放氢量,计算得出放氢速率来找到最佳配比。
1 实验部分
1.1 材料与仪器
NaBH4、Al粉、CoCl2、NaOH均为分析纯。
JA5003分析天平;CSX series手套箱。
1.2 实验方法
将0.5 g NaOH加入到含有20 mL H2O的烧杯中,并搅拌以制备NaOH碱溶液以供使用。然后,在真空手套箱中称量0.25 g的NaBH4加入到配制好的碱溶液中。将不同比例的Al粉和氯化钴(CoCl2·6H2O)加入到三颈烧瓶中,并使用注射器添加配制好的NaBH4碱溶液。观察并记录反应状态。
通过排水法测量NaBH4和Al的氢释放量和氢释放时间,并绘制时间-放氢量曲线。
2 结果与讨论
2.1 CoCl2为6%时,不同配比的NaBH4/Al制氢性能分析
图1显示了当CoCl2的掺杂比例为6%时,不同比例的NaBH4/Al的放氢量与时间之间的关系。
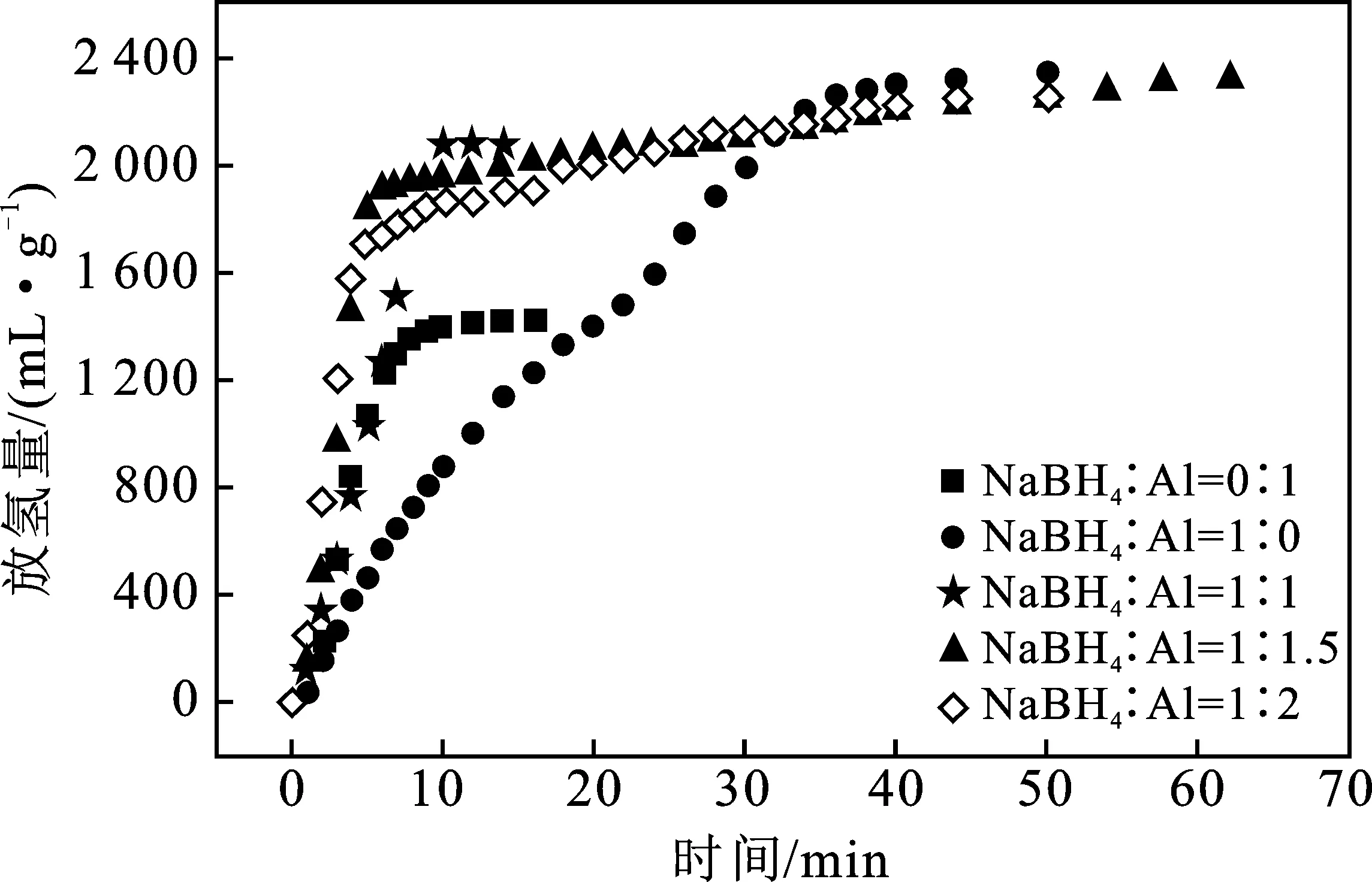
图1 CoCl2为6%时,不同配比的NaBH4/Al放氢量-时间曲线Fig.1 The hydrogen release amount-time curve ofdifferent ratios of NaBH4/Al when CoCl2 is 6%
由图1可知,NaBH4/Al在不同比例下的放氢量和氢释放时间是呈线性的。当NaBH4∶Al为 0∶1 时,氢释放量小,氢释放性能差。当NaBH4∶Al为 1∶0 时,尽管释放的氢气量增加但放氢时间较长,而且其放氢速率较慢,该值为46.8 mL/(min·g)。当NaBH4∶Al为1∶1.5和1∶2时,氢释放曲线的变化趋势基本相同,放氢速率也相对较慢,其值分别为 40 mL/(min·g) 和51.21 mL/(min·g)。只有当NaBH4∶Al为1∶1时,在所有样品中的析氢性能最好,反应在前7 min内基本完成,析氢速率最高,为173.33 mL/(min·g)。
2.2 CoCl2为8%时,不同配比的NaBH4/Al制氢性能分析
图2为当CoCl2为8%时,不同比例的NaBH4/Al的放氢量与时间之间的关系。
由图2可知,当NaBH4∶Al为0∶1时,释放的氢气量最少。当NaBH4∶Al为1∶0时,放氢量高于其他4个样品,但放氢时间长,因此放氢速率相对较慢,其值为47.2 mL/(min·g)。当NaBH4∶Al为1∶1,1∶1.5,1∶2时,随着Al掺杂量的增加,放氢量先增加后减少。且当NaBH4∶Al为1∶1.5和1∶2时,放氢时间较长,为55 min,因此导致放氢性能较差。比较五条曲线可以看出,在所有样品中NaBH4∶Al为1∶1时,放氢性能最佳。当NaBH4∶Al为 1∶1时,反应在6 min 内完成,放氢速率最高,其值为133.75 mL/(min·g)。

图2 CoCl2为8%时,不同配比的NaBH4/Al放氢量-时间曲线Fig.2 The hydrogen release amount-time curve of differentratios of NaBH4/Al when CoCl2 is 8%
2.3 CoCl2为10%时,不同配比的NaBH4/Al水解制氢性能分析
当CoCl2为10%时,考察不同比例的NaBH4/Al释放的氢气量和放氢时间的关系,结果见图3。

图3 CoCl2为10%时,不同配比的NaBH4/Al放氢量-时间曲线Fig.3 The hydrogen release amount-time curve ofdifferent ratios of NaBH4/Al when CoCl2 is 10%
由图3可知,当NaBH4∶Al为 0∶1时,释放的氢气量仍然是所有样品中最小的。当NaBH4∶Al为1∶0 时,即只有NaBH4放氢时,氢释放量最高,但放氢时间也较长,因此其氢释放速率为47.36 mL/(min·g)。当NaBH4∶Al为1∶1,1∶1.5,1∶2 时,比较3条曲线可以看出,NaBH4/Al体系的放氢量随着Al掺杂量的增加而增加。在所有样品中,当NaBH4∶Al为1∶1时,NaBH4/Al系统具有最佳的析氢性能,反应在前5 min内完成,氢气释放速率达到210 mL/(min·g)。
2.4 CoCl2为12%时,不同配比的NaBH4/Al水解制氢性能分析
图4显示了当CoCl2的含量为12%时,不同比例的NaBH4/Al的放氢量和放氢时间的关系。
由图4可知,含有不同比例NaBH4/Al体系的析氢曲线变化趋势基本相似,但氢释放量和氢释放速率差别很大。其中,当NaBH4∶Al为1∶0时,氢释放量最大,但放氢速率相对较低,其值为68.82 mL/(min·g)。当NaBH4∶Al为1∶1.5和1∶2时,放氢时间基本相同,达到68 min,但氢释放量随着Al掺杂量的增加而降低,因此氢释放性能差。当NaBH4∶Al为0∶1时,放氢量最少,尽管放氢时间短,但导致其放氢速率较低,为134 mL/(min·g)。在所有样品中,只有NaBH4∶Al为 1∶1,氢释放性能最好,反应在前4 min基本完成。析氢速率最高,为341.67 mL/(min·g)。

图4 CoCl2为12%时,不同配比的NaBH4/Al放氢量-时间曲线Fig.4 The hydrogen release amount-time curve ofdifferent ratios of NaBH4/Al when CoCl2 is 12%
2.5 CoCl2为14%时,不同配比的NaBH4/Al水解制氢性能分析
图5显示当CoCl2为14%时,不同比例的NaBH4/Al体系中释放的氢气量和放氢时间之间的关系。
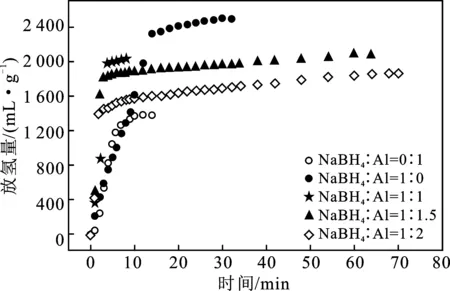
图5 CoCl2为14%时,不同配比的NaBH4/Al放氢量-时间曲线Fig.5 The hydrogen release amount-time curve ofdifferent ratios of NaBH4/Al when CoCl2 is 14%
由图5可知,当NaBH4∶Al为 0∶1和1∶0时,两条曲线在前7 min内基本重叠。反应完成时,当NaBH4∶Al为1∶0时,其氢释放量相对较大,氢释放量为2 500 mL/g,氢释放速率为83.33 mL/(min·g);相反,NaBH4∶Al为 0∶1具有最少的氢释放量,其值为1 380 mL/g,氢释放速率为115 mL/(min·g)。当NaBH4∶Al为1∶1,1∶1.5和1∶2时,三条曲线也在前3 min内重合。但是,当NaBH4∶Al为1∶1.5和1∶2 时,反应在65 min时完成且放氢量很小,因此氢气释放性能差。在所有样品中,当NaBH4∶Al为1∶1时,在3 min内完成析氢,并且氢释放速率最快,其值为335 mL/(min·g)。
2.6 CoCl2催化NaBH4/Al的放氢性能总析
表1列出了不同比例的CoCl2催化不同配比的NaBH4/Al得到的放氢量和放氢速率。

表1 CoCl2催化NaBH4/Al的放氢量以及放氢速率Table 1 Hydrogen release and hydrogen release rate of NaBH4/Al catalyzed by CoCl2
由表1可知,当CoCl2的比例恒定时,NaBH4和Al粉比例的变化对整个体系的放氢量和放氢速率都有影响;而NaBH4/Al配比恒定时,CoCl2的比例变化只对放氢速率有较大影响。其中放氢性能最好的是NaBH4∶Al为1∶1,CoCl2为12%时,其放氢量为2 050 mL/g,放氢速率为341.67 mL/(min·g);放氢性能最差的是NaBH4∶Al为1∶2,CoCl2为14%时,其放氢量为1 866.7 mL/g,放氢速率为27.45 mL/(min·g)。
2.7 CoCl2为12%时,NaBH4/Al水解产物形貌分析
图6展示了由12%CoCl2催化的不同比例NaBH4/Al的水解产物的SEM结果。
由图6可知,不同比例的NaBH4/Al体系形成的水解产物的结构是不同的。图6a是当NaBH4与Al的比例为0∶1时水解产物的微观形貌图,可以看出是颗粒状结构。图6b是NaBH4和Al在1∶0时的水解产物的微观形貌图,其是片层状结构。图6c~6e分别是NaBH4和Al比例为1∶1,1∶1.5和1∶2的SEM图。可以看出,随着Al的增加,片层状结构消失,产生颗粒结构,并且颗粒逐渐变大。在图6c中,颗粒的尺寸大多<0.4 μm,而随着铝的比例增加,小颗粒的数量显著减少和分散,颗粒的尺寸明显增加,发生团聚。并且铝的比例越大,团聚现象越严重。结合前面的水解数据分析,证实当NaBH4∶Al为 1∶1,CoCl2为12%时,放氢性能最好。





图6 CoCl2为12%时,不同配比的NaBH4/Al水解产物的微观形貌图Fig.6 SEM of NaBH4/Al hydrolysate withdifferent ratios when CoCl2 is 12%a.NaBH4∶Al=0∶1;b.NaBH4∶Al=1∶0;c.NaBH4∶Al=1∶1;d.NaBH4∶Al=1∶1.5;e.NaBH4∶Al=1∶2
2.8 CoCl2为12%时,NaBH4/Al水解产物成分分析
图7为当CoCl2为12%时,不同比例的NaBH4/Al的水解产物的XRD图。

图7 CoCl2为12%时,不同配比的NaBH4/Al水解产物的XRD图Fig.7 XRD of different proportions of NaBH4/Alhydrolysate when CoCl2 is 12%a.NaBH4∶Al=0∶1;b.NaBH4∶Al=1∶1;c.NaBH4∶Al=1∶1.5;d.NaBH4∶Al=1∶2
由图7可知,曲线a和b的XRD图基本相同,即当NaBH4与Al的比例为0∶1和1∶1时,水解产物为Al(OH)3和Co2B。 另一方面,曲线c具有Al(OH)3的峰和Al的峰,因此当NaBH4与Al的比例为1∶1.5时的水解产物是Al(OH)3、Al和Co2B。 在曲线d中,Al(OH)3的峰消失并且仅具有Al的峰,从而证明当NaBH4与Al的比例为1∶2时水解产物是Al和Co2B。这同时说明了随着Al粉的量增加,一些Al粉不能完全参与反应。 因此,表明当NaBH4与Al的比例为1∶1时,Al粉和NaBH4可以充分参与反应。
3 结论
(1)当CoCl2的比例恒定时,NaBH4和Al粉比例的变化对整个体系的放氢量和放氢速率都有影响。 而NaBH4/Al配比恒定时,CoCl2的比例变化只对放氢速率有较大影响。
(2)在所有样品中,当NaBH4∶Al为1∶1,CoCl2为12%时,氢气释放性能最佳,氢气释放量为 2 050 mL/g,氢气释放速率为341.67 mL/(min·g)。
(3)从SEM分析可以看出,不同比例的NaBH4和Al粉的水解产物具有不同的微观形貌。随着Al含量的增长,片层状结构消失,并且粒状结构渐渐变大。同时,随着Al含量的增长,发生团聚现象。此外,结合水解产物的XRD分析,证实当NaBH4与Al的比例为1∶1时,水解产物是Al(OH)3和Co2B,反应更充分。
