活性炭负载MnO2及其对甲醛的吸附
2020-06-15王亮才刘沙沙马欢欢吴益霜陈宇周建斌
王亮才,刘沙沙,马欢欢,吴益霜,陈宇,周建斌
(南京林业大学 材料科学与工程学院,江苏 南京 210037)
目前,水体中甲醛的污染主要来自行业生产活动的废水排放[1-2]。人饮入含甲醛的水,会产生恶心、神经絮乱、甚至死亡[3]。因此对甲醛进行吸附处理已成为环境及健康领域的热门话题。王玉萍等在活性炭上负载TiO2,结果表明负载TiO2的活性炭吸附甲醛效果较佳[4-5]。但负载TiO2的活性炭只能在波长小于387.5 nm的紫外光照射下,才能较好地发挥作用。而MnO2有成本低、原料易得及在室温无光条件下也能与甲醛具有很高反应位等特点[6]。因此,本文以椰壳活性炭为原料,采用高锰酸钾浸渍煅烧法制备负载MnO2活性炭,通过单因素实验考察其制备及其吸附过程中的影响因素,探讨了其对甲醛的吸附性能与机理。
1 实验部分
1.1 材料与仪器
椰壳活性炭(比表面积927.736 m2/g、pH为8),由江苏某环保科技公司提供;高锰酸钾(KMnO4)、甲醛(CH2O)均为分析纯。
FZ102型高速万能粉碎机;ZOOMWO-M型超纯水机;DHG-C型电热鼓风干燥箱;722N型可见分光光度计;JSM-5600LV型扫描电子显微镜;OTL1200-Ⅲ型管式炭化炉;VERTEX 80V型傅里叶红外光谱仪;AXIS Ultra DLD型X射线电子能谱;Autosorb型比表面积分析仪;D8ADVANCE型X射线衍射仪;HY-2A型调速多用振荡器;SHA-B型恒温振荡器。
1.2 实验方法
1.2.1 负载MnO2活性炭的制备
1.2.1.1 预处理 先将活性炭粉碎过筛选取粒径20~40目,置于100 mL烧杯中,加入超纯水,搅拌煮沸30 min后冷却至室温,反复洗涤至中性并除去椰壳活性炭表面的灰分,置于105 ℃恒温干燥8 h,密封封存备用,记为AC。
1.2.1.2 负载 高锰酸钾在N2保护下,受热分解的化学方程式如下:
2KMnO4=K2MnO4+MnO2+O2↑
在实验中固液比8∶20(8 g的AC中加入20 mL KMnO4),振荡频率170~190次/min,氮气流速200 mL/min,管式炉升温速率10 ℃/min保持不变的条件下设置负载条件,即高锰酸钾浓度(0.04,0.06,0.08,0.10,0.12 mol/L)、浸渍振荡时间(2,3,4,5,6 h)、煅烧温度(300,400,500,600,700 ℃)及煅烧时间(2,2.5,3,3.5,4 h)采用控制变量法进行单因素实验,当升温至设定的温度后保温,到达设定的保温时间结束。管式炉冷却后取出样品,水洗,过滤,120 ℃烘干6 h,密封备用。
1.2.2 活性炭吸附甲醛实验 甲醛浓度参照GB/T 1556—1995测定(空气质量甲醛的测定乙酰丙酮分光光度法),在250 mL具塞锥形瓶中按实验要求分别加入一定质量浓度的甲醛溶液和活性炭,在25 ℃下振荡(频率120~150次/min保持不变)一定时间后取出,用滤纸过滤,移取滤液10 mL于比色管中,加入0.25%乙酰丙酮溶液2.0 mL,混匀,置于沸水浴中加热3 min,取出冷却至室温,用1 cm吸收池,以水作为参比,在波长413 nm处测得吸光度,计算活性炭的吸附率以及吸附量。吸附率及吸附量计算式分别如下:
E=(A0-At)/A0
Q=(P0-Pe)V/m
式中E——吸附率,%;
A0——甲醛溶液的初始吸光度;
At——t时刻甲醛溶液的吸光度;
Pe——平衡时甲醛溶液的质量浓度,mg/L;
V——甲醛溶液体积,L;
m——加入活性炭的质量,g;
Q——吸附量,mg/g。
1.2.3 活性炭的表征 负载MnO2前后的活性炭采用扫描电镜(SEM)、BET、傅里叶红外光谱(FTIR)、X射线电子能谱(XPS)、X射线衍射法(XRD)等进行表征,分析其负载MnO2前后比表面积、表面形貌、表面官能团、表面元素以及MnO2的晶体类型。
2 结果与讨论
2.1 甲醛标准曲线绘制
甲醛标准曲线见图1。其拟合公式为y=0.219 2x+0.001 5,拟合度为R2=0.999 97。
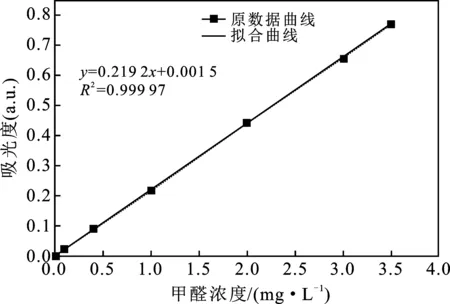
图1 甲醛标准曲线Fig.1 Stand curve of formaldehyde
2.2 最优负载条件的确定
2.2.1 高锰酸钾浓度对负载MnO2活性炭吸附甲醛能力的影响 当浸渍振荡4 h,600 ℃煅烧3 h不变的条件下,高锰酸钾浓度对负载MnO2活性炭吸附甲醛(25 mL质量浓度为3.5 mg/L甲醛溶液中加活性炭0.5 g,吸附时间24 h)能力的影响见图2。
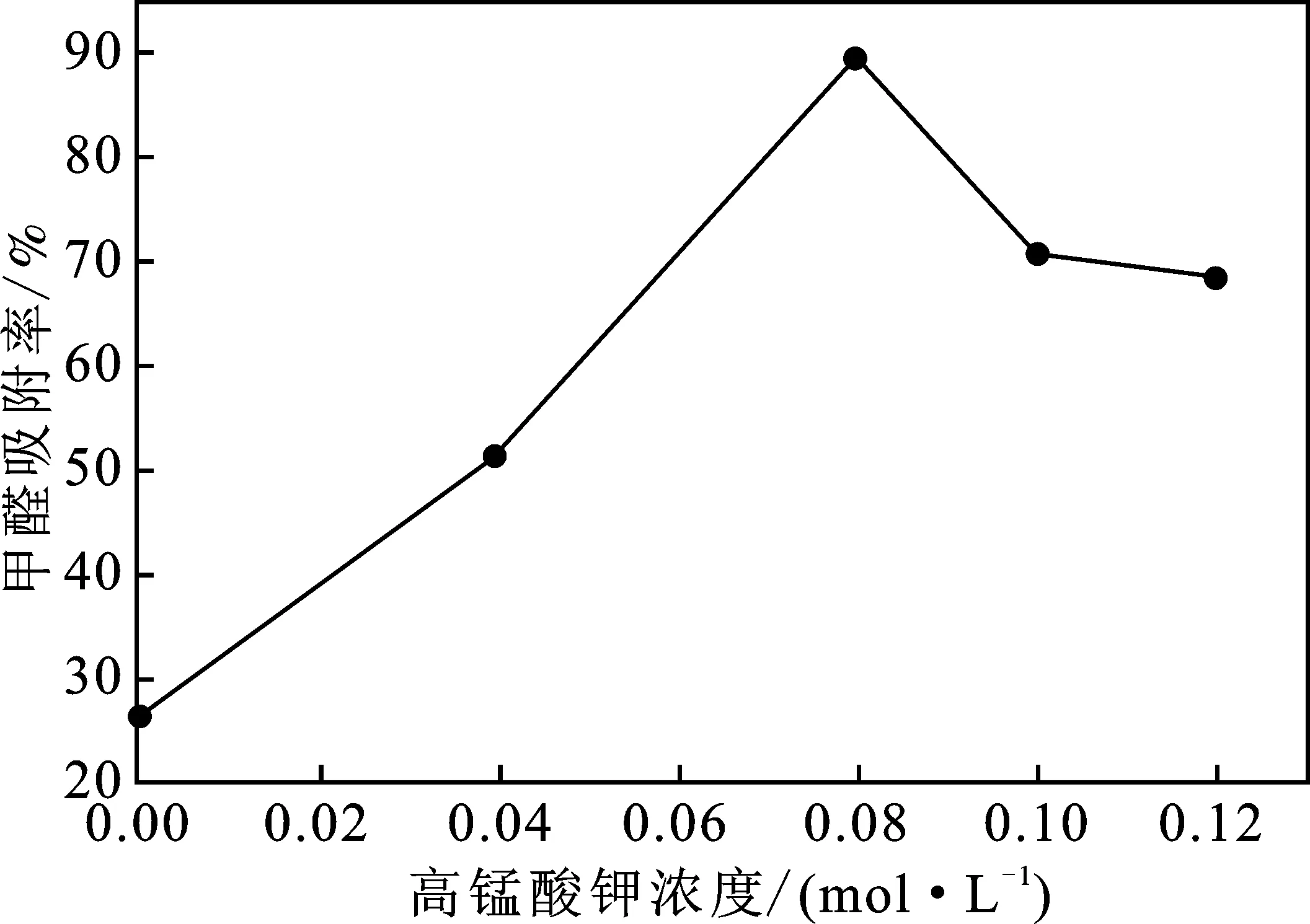
图2 高锰酸钾浓度对活性炭吸附率的影响Fig.2 Effect of potassium permanganate concentration onadsorption rate of activated carbon
图2中KMnO4溶液浓度为零时的甲醛吸附率表示AC在相同的条件下吸附甲醛24 h的吸附率(下同)。由图2可知,AC吸附甲醛的吸附率为26.51%,KMnO4煅烧制备MnO2-AC的甲醛吸附率远高于AC,随着KMnO4溶液浓度的逐渐增大,甲醛吸附率先增后减,在浓度为0.08 mol/L活性炭吸附率最大(89.31%),当浓度>0.08 mol/L时,吸附率开始减少,可能是因为浓度过高,生成的MnO2堵住了活性炭的孔隙,活性炭的富集功能不能充分发挥作用,从而导致吸附率相对降低,但其具体机理将有待进一步验证,因此下面的实验高锰酸钾浓度选择0.08 mol/L。
2.2.2 浸渍振荡时间对负载MnO2活性炭吸附甲醛能力的影响 当高锰酸钾浓度0.08 mol/L,600 ℃ 煅烧3 h不变的条件下,浸渍振荡时间对负载MnO2活性炭吸附甲醛(25 mL质量浓度为3.5 mg/L 甲醛溶液中加活性炭0.5 g,吸附时间24 h)能力的影响见图3。

图3 浸渍振荡时间对活性炭吸附率的影响Fig.3 Effect of immersion oscillation time onadsorption rate of activated carbon
由图3可知,浸渍振荡时间对活性炭吸附的影响较小,但依然可以看出随着浸渍时间的增大,活性炭的吸附率先增大再减小,在4 h时达到最大值(89.31%),可能是因为浸渍时间过长,MnO2负载的过多从而堵住了孔隙,造成了微孔吸附甲醛的能力降低,因此浸渍振荡时间选择4 h。
2.2.3 煅烧温度对负载MnO2活性炭吸附甲醛能力的影响 当高锰酸钾浓度0.08 mol/L,浸渍振荡4 h及煅烧3 h不变的条件下,煅烧温度对负载MnO2活性炭吸附甲醛(25 mL质量浓度为3.5 mg/L甲醛溶液中加活性炭0.5 g,吸附时间24 h)能力的影响见图4。

图4 煅烧温度对活性炭吸附率的影响Fig.4 Effect of calcination temperature onadsorption rate of activated carbon
由图4可知,煅烧温度对活性炭的甲醛吸附率影响较大(大于高锰酸钾浓度以及浸渍振荡时间对活性炭吸附甲醛能力的影响)。煅烧温度在 300 ℃,活性炭的吸附率相比AC稍微降低,可能是因为温度低,不能使高锰酸钾分解,高锰酸钾覆盖在活性炭的内外表面,活性炭的富集功能不能充分发挥出来。随着温度升高,高锰酸钾分解生成MnO2逐渐增多,MnO2在活性炭上充分分散,在温度为600 ℃时活性炭吸附率最大(89.31%),当煅烧温度>600 ℃时,活性炭吸附率又开始下降,可能是因为温度过高,高锰酸钾会被炭还原成更低价态的锰。因此实验煅烧温度选择600 ℃。
2.2.4 煅烧时间对负载MnO2活性炭吸附甲醛能力的影响 当高锰酸钾浓度0.08 mol/L,浸渍振荡4 h及煅烧温度600 ℃不变的条件下,煅烧时间对负载MnO2活性炭吸附甲醛(25 mL质量浓度为3.5 mg/L甲醛溶液中加活性炭0.5 g,吸附时间24 h)能力的影响见图5。
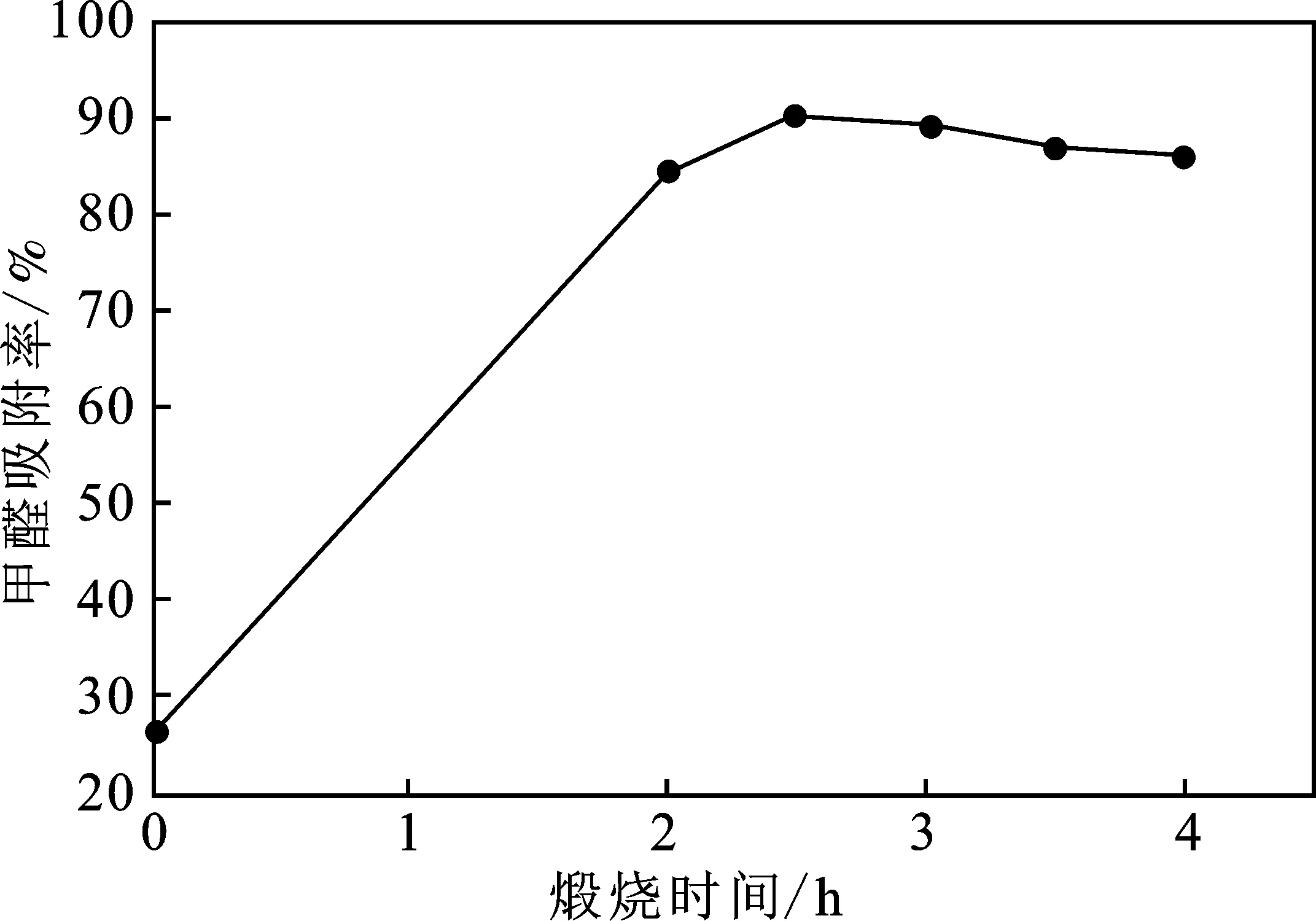
图5 煅烧时间对活性炭吸附率的影响Fig.5 Effect of calcination time on adsorptionrate of activated carbon
由图5可知,煅烧时间对活性炭吸附甲醛能力的影响较小,煅烧时间在2.5 h时,活性炭的吸附率最大(90.17%),2.5 h以后随着煅烧时间延长,吸附率逐渐降低,因此煅烧时间选择2.5 h。实验中高锰酸钾浓度为0.08 mol/L、浸渍振荡时间为4 h时,煅烧温度为600 ℃,煅烧时间为2.5 h的条件下负载MnO2的活性炭简称为MnO2-AC。
2.3 活性炭的表征
2.3.1 扫描电镜分析 对AC、MnO2-AC进行扫描电镜分析,观察微观形貌,结果见图6。


图6 活性炭的扫描电镜图Fig.6 The scanning electron microscopeimages of activated carbona.AC(×10 000);b.MnO2-AC(×10 000)
由图6对比可知,MnO2-AC表面有大量颗粒状固体(MnO2),但是并没有堵住活性炭的孔道,只是在孔的周围,因此MnO2-AC的比表面积以及富集能力相对AC不会降低且MnO2的负载量相对较好,与2.2节MnO2-AC吸附甲醛能力强的结果相对应。
2.3.2 比表面积分析 活性炭的比表面积和孔径分布是影响活性炭物理吸附的主要因素,对AC、MnO2-AC进行比表面积分析和孔径分析,结果见表1。

表1 活性炭的比表面积与孔径Table 1 Specific surface area and pore size ofactivated carbon
由表1可知,MnO2-AC比表面积较AC高(与2.3.1节扫描电镜结果相符合,MnO2没有堵塞孔道),这也是导致MnO2-AC吸附甲醛能力不降低的一个原因。
2.3.3 傅里叶红外光谱分析(FTIR) 由于活性炭的物理化学结构极其复杂,因此官能团的吸收峰也存在一定的差异。由FTIR吸收机理可知,特征峰的吸收波谱越高表明该样品中的官能团的含量越大,图7为两种活性炭的傅里叶红外光谱图。
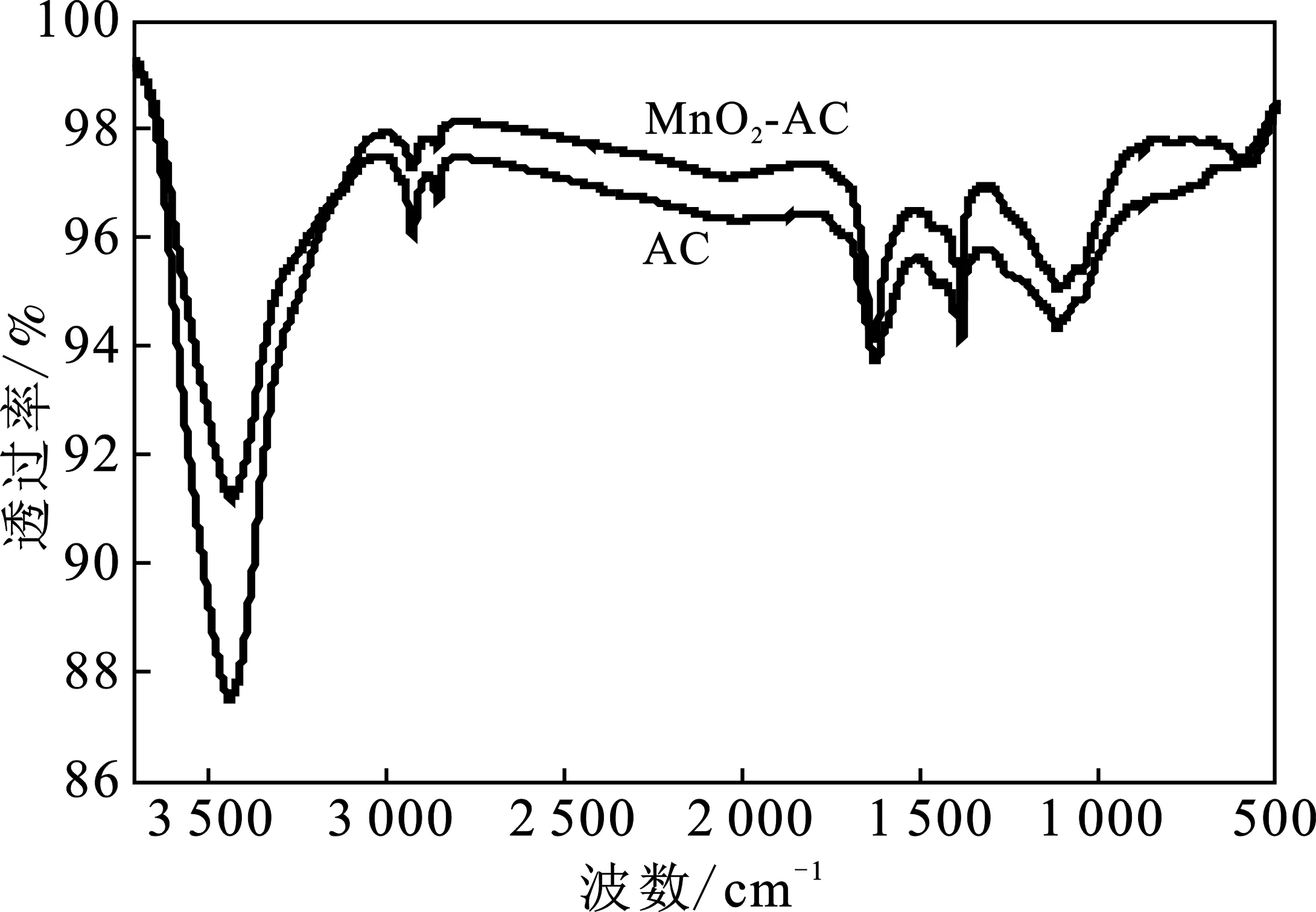
图7 傅里叶红外光谱图Fig.7 Fourier infrared spectrogram
由图7可知,AC、MnO2-AC均出现形状和大小相似的吸收峰,说明两种活性炭均含有该键,峰值有较大差异,意味着相应键的数量有一定的差异,若出现新的吸收峰,表明形成新的基团。

2.3.4 X射线电子能谱(XPS) 活性炭表面元素以及官能团的种类和相对含量的多少决定了活性炭表面的化学性质,进而影响活性炭对甲醛的吸附性能。AC、MnO2-AC全扫描图见图8、图9。
由图8、图9可知,活性炭上的元素均以碳和氧为主,但MnO2-AC上存在着Mn元素。通过XPS宽扫描谱图可知活性炭表面元素含量情况,其含量情况见表2。

图8 AC的XPS宽扫描图Fig.8 The typical survey spectra for AC by XPS

图9 MnO2-AC的XPS宽扫描图Fig.9 The typical survey spectra for MnO2-AC by XPS

表2 活性炭的表面元素组成及C 1s谱拟合结果Table 2 Surface element content and the result of the C 1s peak by curve fitting method

对活性炭C 1s进行分峰处理,其结果见图10、图11。
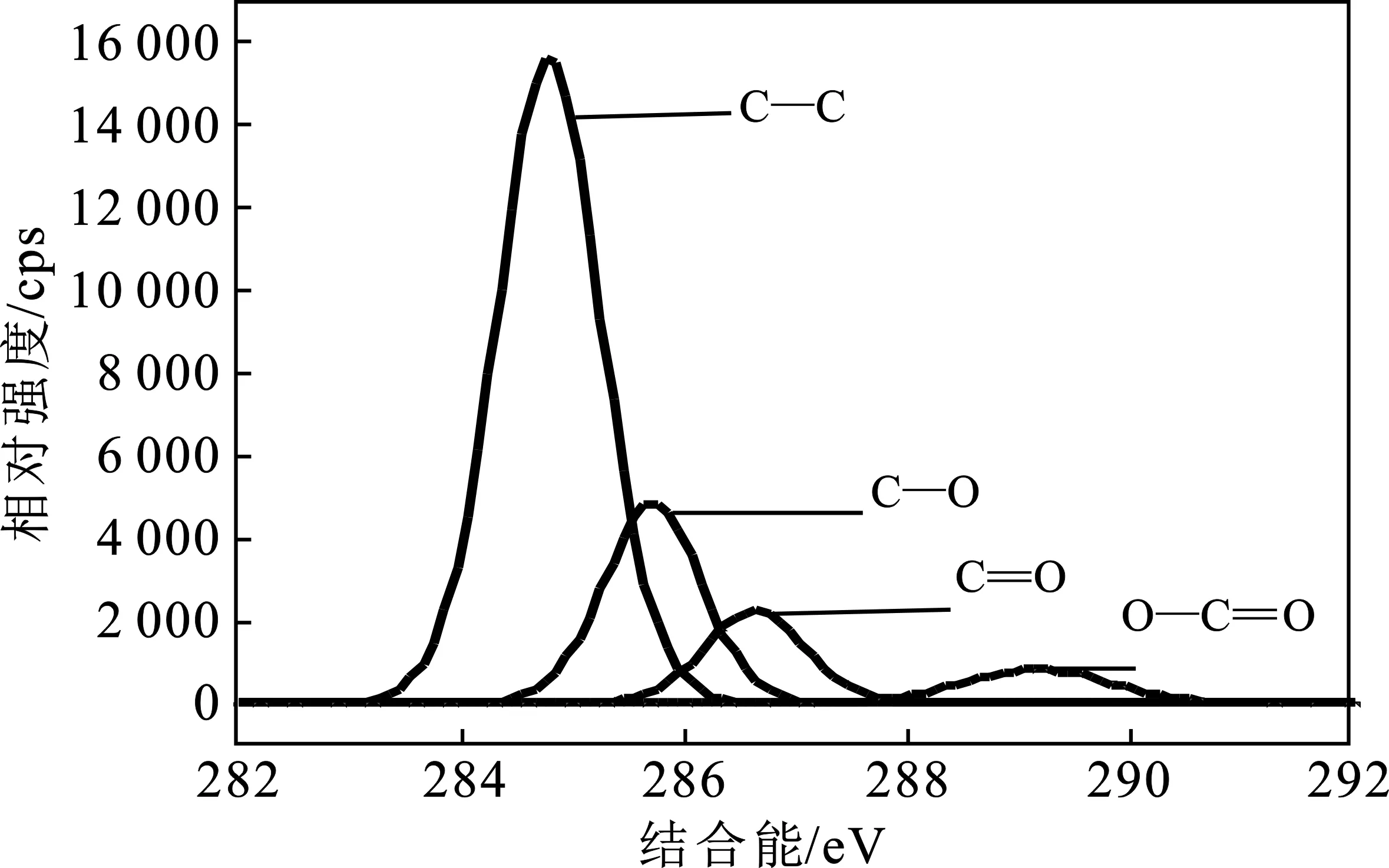
图10 AC的C 1s分峰图Fig.10 The peaking spectra of AC for C 1s by XPS
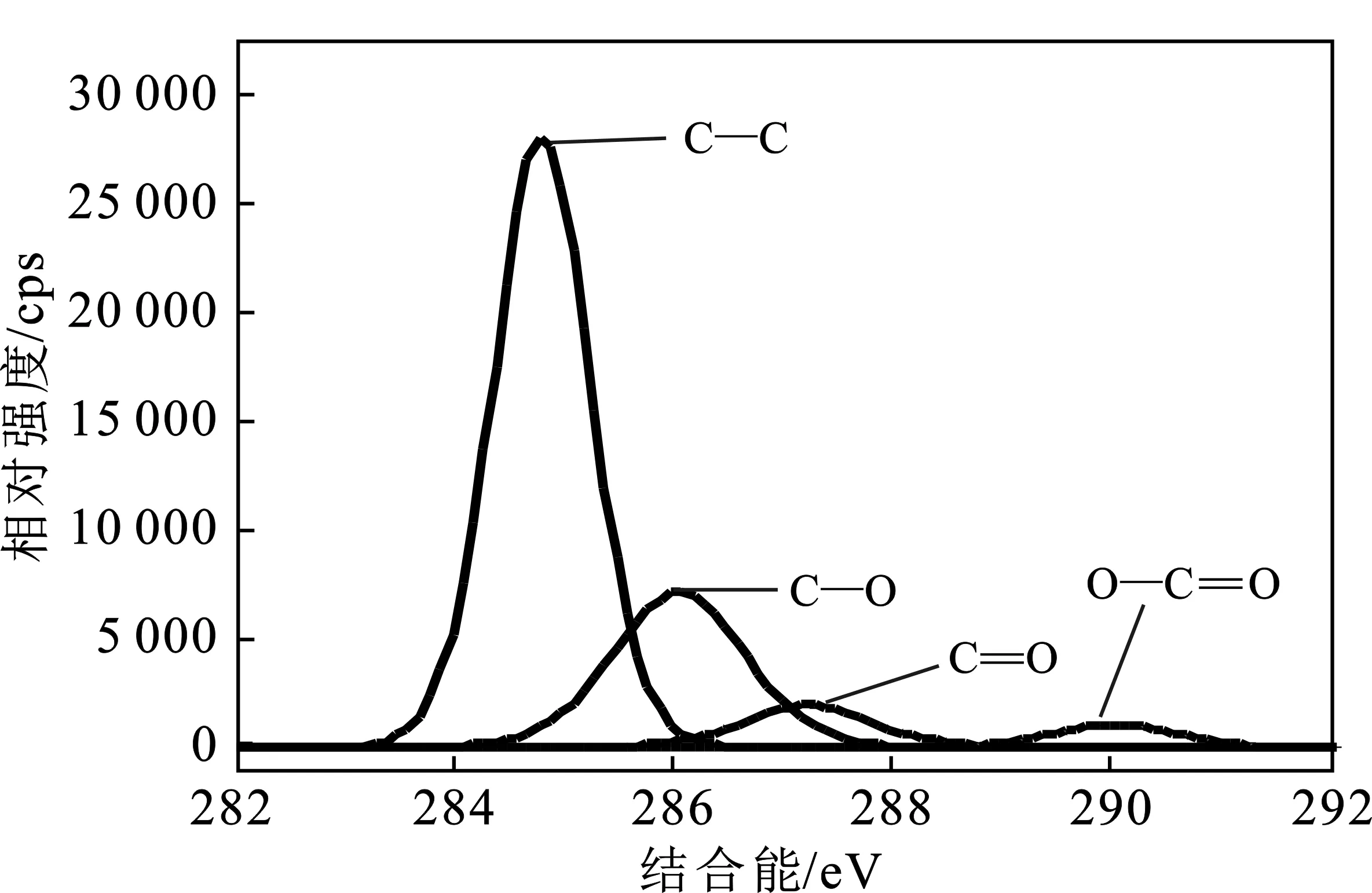
图11 MnO2-AC的C 1s分峰图Fig.11 The peaking spectra of MnO2-AC forC 1s by XPS

2.3.5 XRD分析结果 为了进一步确定MnO2-AC上存在MnO2,对负载MnO2前后的活性炭进行XRD表征,结果见图12、图13。
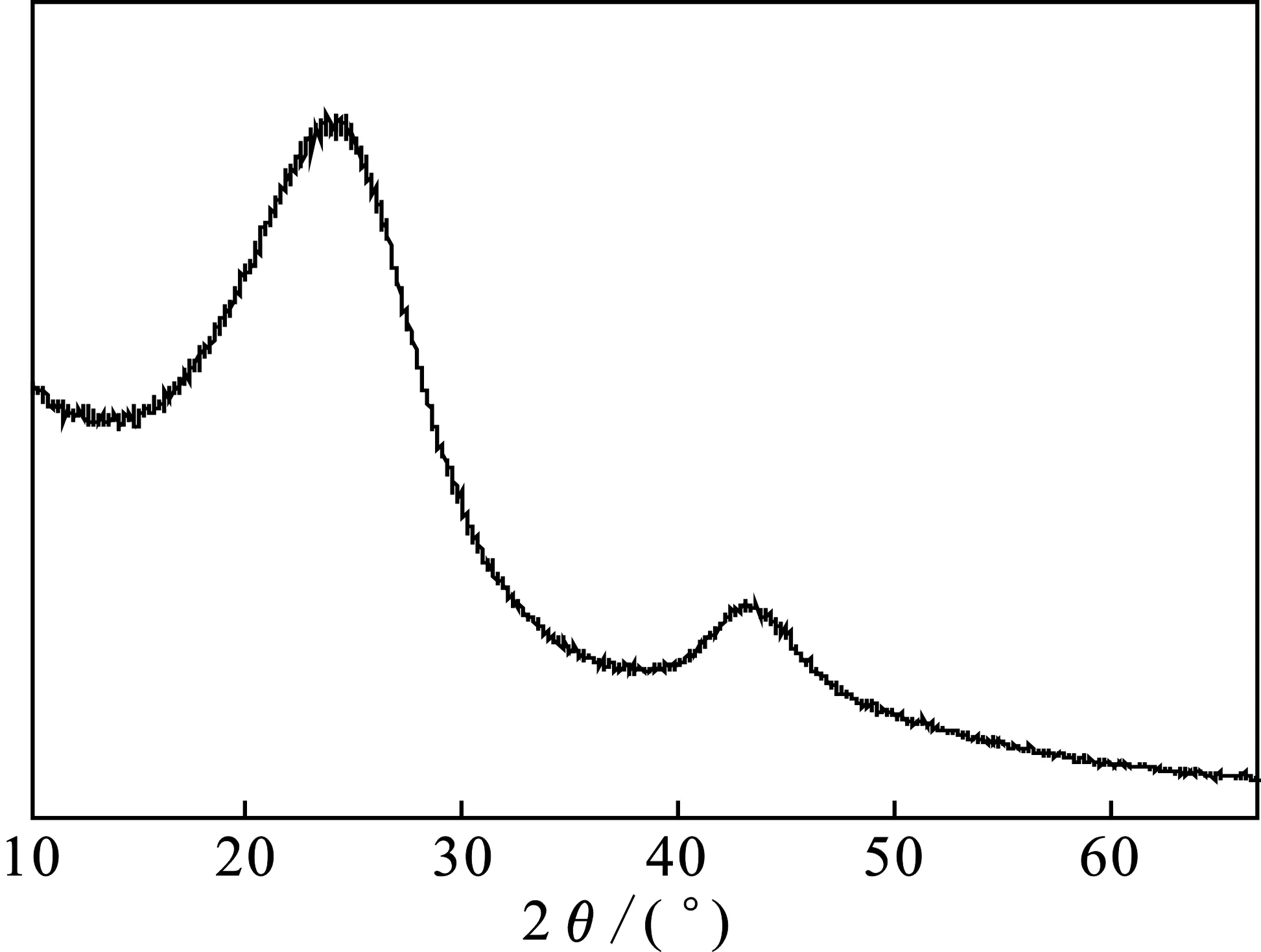
图12 AC的XRD图Fig.12 XRD spectra of AC

图13 MnO2-AC的XRD图Fig.13 XRD spectra of MnO2-AC
由图12、图13可知,负载MnO2前后的活性炭在2θ=23.5°以及43°的位置附近都出现了相对较宽的碳特征衍射峰,但MnO2-AC在2θ=12.4,37.3,42.2,50.8,65.5°附近出现了特征衍射峰,与标准图谱(JCPDS 80—1098)中的δ-MnO2衍射峰相吻合,且结晶度较好。
2.4 MnO2-AC吸附甲醛实验
2.4.1 吸附时间对吸附能力影响的比较 取8个250 mL具塞锥形瓶,贴好相应的标签,然后对照标签放入AC各0.5 g,再移取25 mL质量浓度为3.5 mg/L(吸光度为0.770)的甲醛溶液于贴好标签的8个具塞锥形瓶中,盖好塞子,置于25 ℃恒温振荡器振荡(频率120~150次/min保持不变),每隔 2 h 测试1次,用滤纸过滤,移取滤液10 mL于具塞比色管中,加入2.0 mL 0.25%乙酰丙酮溶液,混匀后置于沸水浴中,加热3 min,然后取出冷却至室温,选取1 cm的吸收池,使用超纯水作校准,在413 nm的波长处测量吸光度,以甲醛吸附率来表征其吸附能力,同理对MnO2-AC做同样测试,结果见图14。
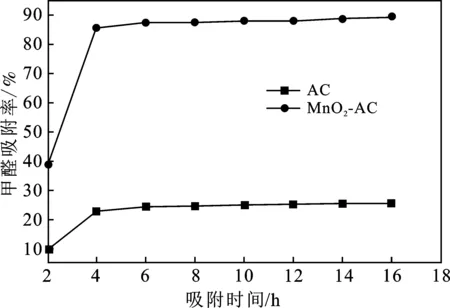
图14 吸附时间对甲醛吸附效果的影响Fig.14 Effect of adsorption time on formaldehydeadsorption of activated carbon
由图14可知,两种活性炭在吸附初始阶段,甲醛吸附率增加非常明显,随着时间的延长,吸附速率逐渐变慢,可能是因为在开始阶段,甲醛从溶液主体扩散到吸附剂表面有较大的浓度梯度,吸附推动力大,导致吸附速率较快,随着吸附时间的延长,浓度梯度差变小,导致吸附速率逐渐变缓,直至达到吸附平衡,AC、MnO2-AC可以认为吸附时间在4 h附近吸附已经达到平衡,但依然可以看出AC较MnO2-AC达到吸附平衡的时间长,据汤进华等[9]报道,中孔比表面积大,活性炭达到吸附平衡时间就短,而2.3.2节实验中MnO2-AC的中孔比表面积较AC大,正好与汤进华的结论一致。
2.4.2 投加量对吸附性能影响的比较 在2.4.1节条件下,取恒温振荡时间为24 h,投加量分别为0.05,0.1,0.2,0.3,0.4,0.5 g时,对吸附效果的影响见图15。

图15 活性炭投加量对吸附效果的影响Fig.15 Effect of dosage of activated carbon onformaldehyde adsorption
由图15可知,随着活性炭投加量增大,甲醛吸附率也逐渐增大,可能是因为活性炭的量增多时,能提供足够的有效接触面,使甲醛溶液中的甲醛分子能与活性炭充分接触,导致效果较佳,甲醛去除率较高,但是当活性炭的投加量过多时,甲醛吸附率增加的幅度不是很明显。在实际生活运用中为了更好的吸附甲醛,使水质达到国家安全排放标准,应该投更多的活性炭,但是过量投加又会造成资源浪费,因此实际应用过程中,需要同时考虑活性炭的利用率与甲醛吸附率的要求,使吸附甲醛过程更经济可行。
2.4.3 甲醛初始质量浓度对吸附性能的影响 在2.4.1节条件下,取恒温振荡时间为24 h,甲醛初始浓度为0.6,1,1.4,1.8,2 mg/L时,计算活性炭的吸附率以及吸附量,并进一步研究单位吸附量与剩余浓度的关系,结果见表3。
由表3可知,MnO2-AC的单位吸附量与甲醛的初始浓度有关,在初始浓度相对较低的条件下,随着初始浓度的增加,单位吸附量也随之增加,以甲醛剩余浓度对单位吸附量作图,可以获得吸附等温曲线,分别以Langmuir和Freundlich方程对等温吸附数据进行拟合,通过计算可以获得相关参数,从而获得界面上吸附分子状态以及吸附层结构。Langmuir和Freundlich方程如下:
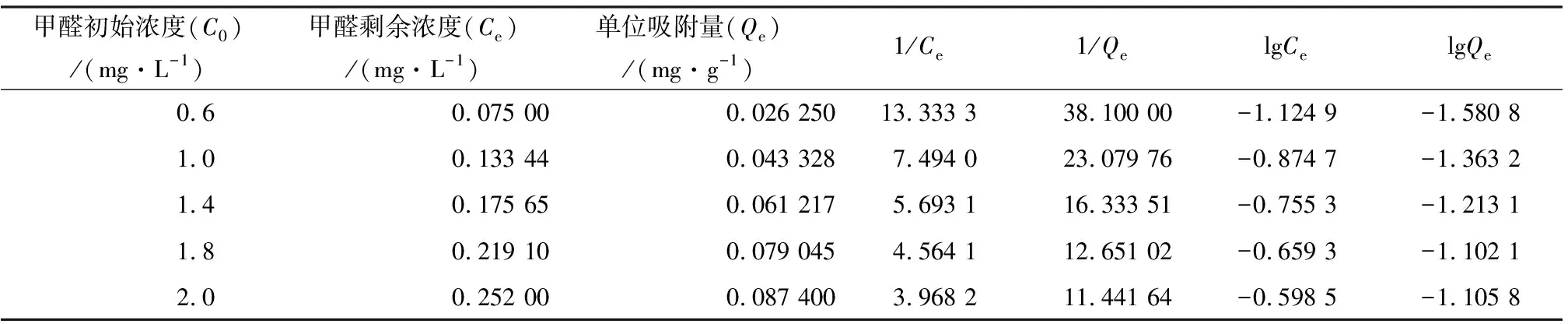
表3 甲醛浓度对MnO2-AC甲醛吸附效果的影响Table 3 Effect of formaldehyde concentration on adsorption of MnO2-AC
MnO2-AC的Langmuir和Freundlich吸附等温模型见图16、图17。
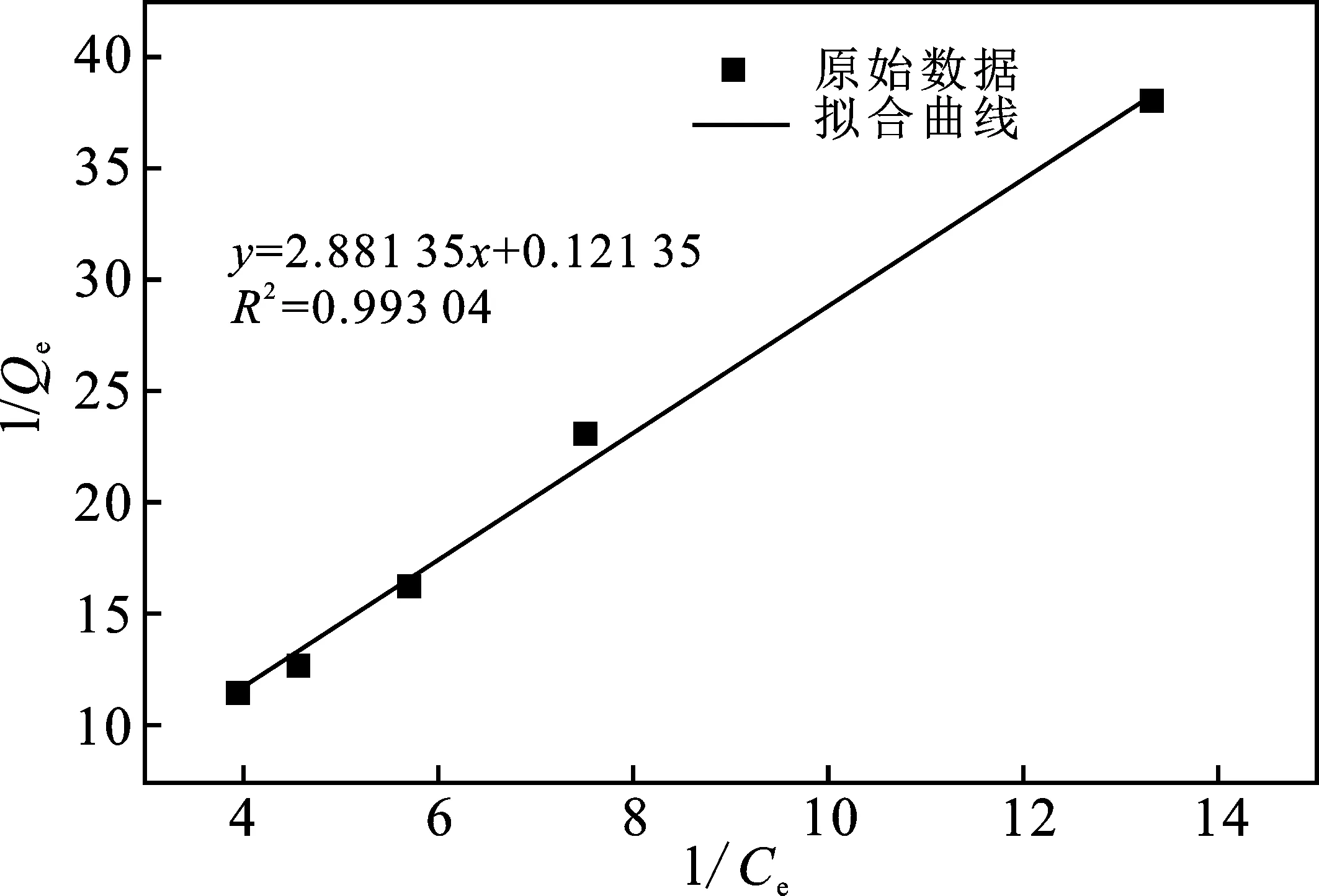
图16 Langmuir吸附等温线Fig.16 Langmuir isotherm model
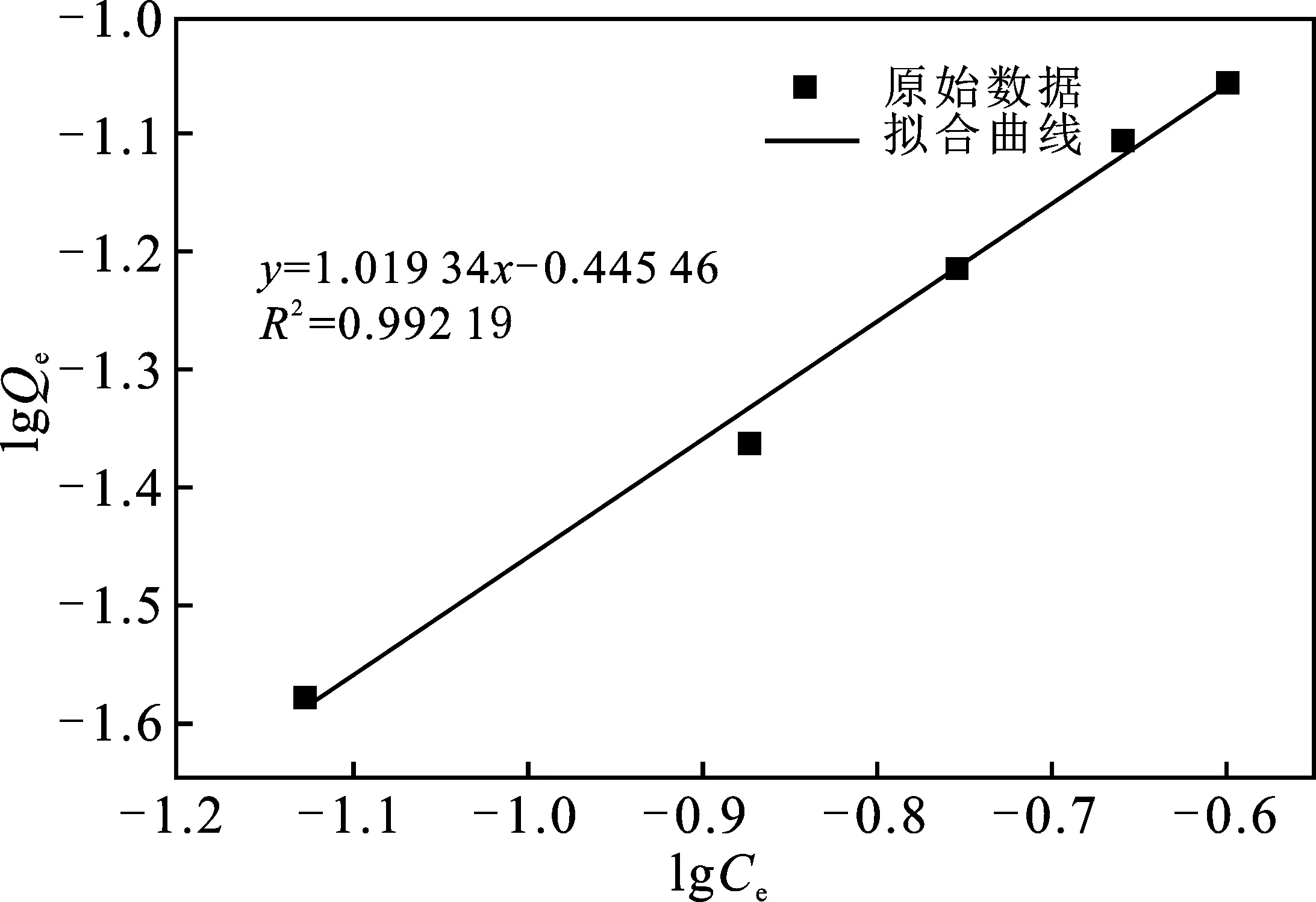
图17 Freundlich吸附等温线Fig.17 Freundlich isotherm model
3 结论
(1)通过负载MnO2实验可知,高锰酸钾浓度、浸渍振荡时间、煅烧温度、煅烧时间对负载MnO2活性炭吸附甲醛能力都有影响,但影响最大的是煅烧温度,随着煅烧温度的升高,负载MnO2活性炭吸附甲醛能力先升高后下降。
(2)在高锰酸钾浓度0.08 mol/L、浸渍振荡时间4 h、煅烧温度为600 ℃、煅烧时间2.5 h的条件下所制备的负载MnO2活性炭(MnO2-AC)效果最佳,用其吸附3.5 mg/L的甲醛液体,甲醛吸附率为90.17%,较AC提高了240.26%。
(3)从活性炭表征可知,MnO2-AC的比表面积较AC有所增加;MnO2-AC表面在波长为580 cm-1左右存在Mn—O键;MnO2(晶型为δ-MnO2且结晶度较好)较均匀负载在活性炭表面上且没将孔堵住。
(4)MnO2-AC吸附甲醛能力的提高,是其比表面积、表面官能团、MnO2等共同作用的结果,通过Langmuir吸附等温模型可知,MnO2-AC的Q∞=8.24 mg/g,要达到较大的吸附量,需要更高的平衡浓度。
