超声造影评估斑块稳定程度与基础血脂水平的相关性分析
2020-06-15左文超孙支唐葛思慧郭艳琴
左文超 孙支唐 葛思慧 郭艳琴 王 倩
1)天津市环湖医院,天津 300350 2)山西医科大学第二医院,山西 太原 030001
脑卒中降低患者生活质量,甚至威胁生命。动脉粥样硬化斑块可以导致缺血性卒中的发生。体积较大的斑块可致动脉狭窄,导致血流不足,引发血管疾病。近年来,有关动脉粥样硬化斑块稳定性的问题也逐渐被重视,稳定性差的斑块可致斑块内出血,若斑块纤维帽较薄,可导致斑块破裂,破裂的斑块也可引发卒中的发生。颈动脉超声造影可以对斑块内的血管进行评估,超声造影的造影剂微泡经血流流遍全身,而且微泡只存在于血管内,并不能通过血管内皮。借此我们可以动态观察出斑块内部的新生血管状况,进而评估动脉粥样硬化斑块性质[1]。而且颈动脉超声造影有一套特定的参考标准,其评估的结果要较常规超声更有临床价值[2]。动脉粥样硬化斑块的形成与血脂水平有关,本研究利用超声造影来探究颈动脉斑块的稳定性和基础血脂水平的相关性。
1 资料与方法
1.1一般资料收集2017-05—2018-01在山西医科大学第二医院住院的患者22例,男15例,女7例;年龄45~79(63.6±9.4)岁,均由常规超声发现颈动脉粥样硬化斑块后,进一步行颈动脉超声造影评价斑块性质,入选标准:检测血脂前未曾经过降脂干预的患有颈动脉粥样硬化斑块形成的患者。排除标准:(1)检测血脂前已经进行降脂干预的患者;(2)有超声造影剂六氟化硫禁忌证的患者。
1.2仪器与方法采用TOSHIBA Aplio500,常规线阵探头,频率5~14 Hz,造影模式下机械指数(MI)0.08 MHz,超声造影剂采用声诺维(SonoVue)。颈动脉超声明确斑块位置后,选择最佳切面,进入实时造影成像条件。经患者的外周静脉以快速团注法注入声诺维混悬液后生理盐水冲管,启动计时器,实时观察斑块的增强方式及强度变化,每两次造影之间相隔10 min。
基础血脂水平的检测:所有患者采集晨起空腹静脉血5 mL,分别检测总胆固醇(total cholesterol,TC)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)以及甘油三酯(triglyceride,TG)水平。
1.3图像分析颈动脉超声造影根据斑块的增强程度,分为0~4级:0级:不增强;1级:外膜增强,斑块内未见增强;2级:斑块内少量散在点状增强;3级:线状增强伸入至斑块内部;4级:斑块内弥漫增强。

2 结果
54个斑块超声造影分级:0级为4个;1级为8个;2级为12个;3级为18个;4级为12个,22例患者平均基础LDL、HDL、TG、TC水平分别为(2.78±0.47)mmol/L、(1.12±0.23) mmol/L、(1.75±0.93 )mmol/L、(4.82±0.61) mmol/L;不同斑块的超声造影分级分别与基础LDL水平、HDL水平、TG水平、TC水平行Spearman秩相关,与基础LDL显著相关(P<0.001,r=0.520)(见图1),与基础HDL显著相关(P=0.009<0.05,r=-0.353)(见图2),与基础TG水平无相关性(P=0.799>0.05)(见图3),与基础TC水平显著相关(P=0.034<0.05,r=0.289)(见图4)。
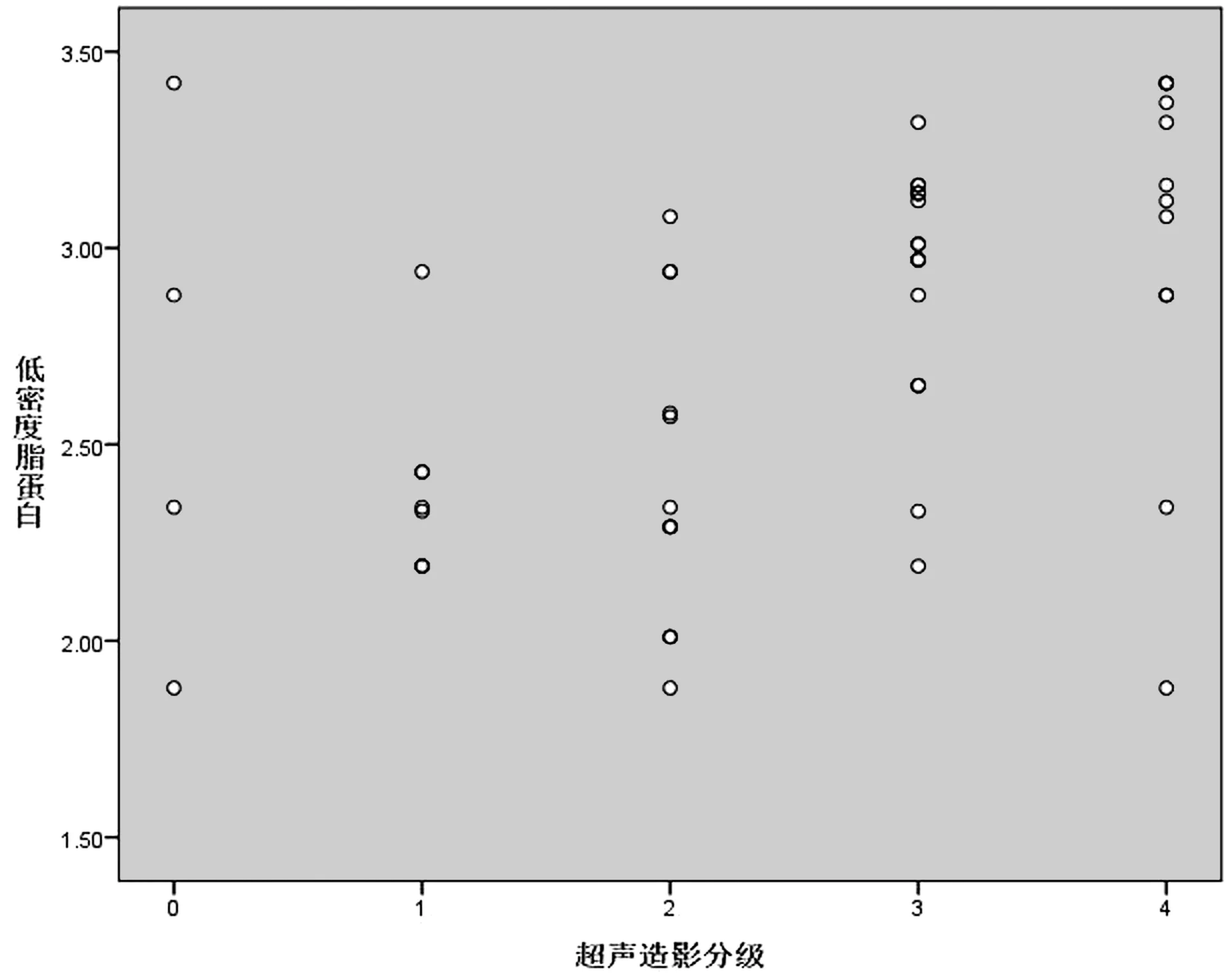
图1 各等级斑块的LDL分布情况Figure 1 LDL distribution of plaques at different levels

图2 各等级斑块的HDL分布情况Figure 2 HDL distribution of plaques at different levels
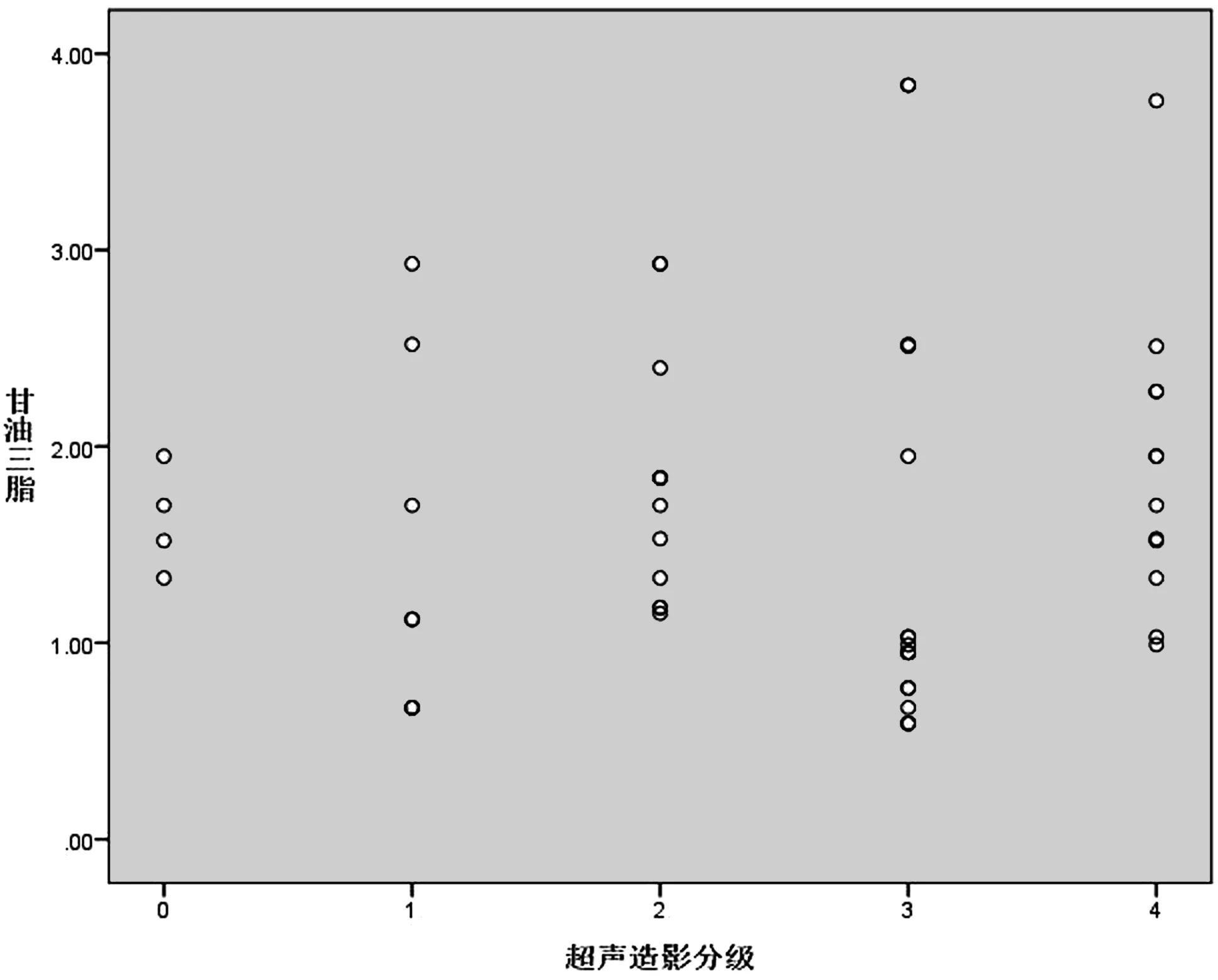
图3 各等级斑块的TG分布情况Figure 3 TG distribution of plaques at different levels

图4 各等级斑块的TC分布情况Figure 4 TC distribution of plaques at different levels
3 讨论
近年来我国经济发展迅速,随着饮食水平的提升,同样对人们的健康造成一定隐患。许多人不注意饮食的均衡,导致血脂代谢异常。有研究表明[3-4],血脂异常可增加动脉粥样硬化的发病率。根据本研究的结果,基础TC水平与斑块稳定性有关。高胆固醇水平可增加动脉粥样硬化的风险,其中对粥样硬化斑块影响最大的是低密度脂蛋白胆固醇[5-6]。本研究显示基础LDL水平与斑块的超声造影增强程度呈显著相关关系。LDL容易被氧化修饰成为氧化型低密度脂蛋白(oxidized low density lipoprotein,Ox-LDL),使得其促动脉粥样硬化作用更强。氧化型低密度脂蛋白参与动脉粥样硬化的形成过程,其具有明显的细胞毒性、化学趋向性以及免疫原性,可导致动脉壁持续损伤[7-8]。巨噬细胞可以清除被修饰的LDL,以防止细胞毒性、组织损伤、炎症及代谢紊乱。巨噬细胞可表达多种与脂蛋白相互作用的受体,主要包括A类Ⅰ型清道夫受体(scavenger receptor-AⅠ,SR-AⅠ)、凝集素样氧化型低密度脂蛋白受体(lectin-like oxLDL receptor-1,LOX-1)以及B类清道夫受体CD36。除此之外,巨噬细胞还具有参与胆固醇反向转运的胆固醇转运蛋白,包括ATP结合盒转运蛋白A1(ABCA1)、ATP结合盒转运蛋白G1(ABCG1)、B类Ⅰ型清道夫受体(scavenger receptor-BⅠ,SR-BⅠ)。在动脉粥样硬化过程中,由于促炎因子的刺激,使得SR-AⅠ、CD-36、LOX-1的表达上调,尤其是LOX-1的表达,同时下调胆固醇转运蛋白的表达[9-11]。这导致胆固醇在巨噬细胞中沉积,进而转变为泡沫细胞[12]。此外,其他类型细胞,如血管内皮细胞和血管平滑肌细胞,也可以成为泡沫细胞。泡沫细胞的产生是动脉粥样硬化的标志[13]。浸润的巨噬细胞等炎症细胞可产生大量血管新生的相关生长因子,包括血管内皮生长因子(VEGF)和成纤维细胞生长因子(FGF)。这些生长因子可以促进斑块内部血管新生,但是这些新生血管是畸形的、不成熟的,易出血,造成斑块破裂,诱发缺血性卒中的发生。因此如何抗斑块内血管新生是一项十分重要的课题。本研究还显示:基础HDL水平与粥样硬化斑块的超声造影分级呈负相关关系,另有研究显示动脉粥样硬化的重要危险因素是HDL低[14],原因:(1)人体多余的胆固醇通过血浆HDL转运回肝脏,这个过程被称为胆固醇逆转运,它可以减少富含胆固醇的巨噬细胞沉积,延缓粥样硬化的发展;(2)HDL具有抗氧化和抗炎作用,减少Ox-LDL的产生;(3)HDL可以促进一氧化氮的合成,进而保护血管内皮;(4)HDL还有促纤溶、抗血栓的作用[15]。对于甘油三酯是否影响斑块形成一直留有争议[16],本实验未证明甘油三酯与粥样硬化斑块的超声造影分级有相关性,但有研究显示[17-18]:甘油三酯与动脉粥样硬化有关。TG主要存在于乳糜微粒(CM)和极低密度脂蛋白(VLDL)中。带有TG的CM与VLDL本身对动脉粥样硬化无影响,但CM与VLDL被脂蛋白脂酶水解后颗粒减小,如果未被及时清除,则可能沉积于动脉壁致斑块形成。VLDL-TG及CM-TG在胆固醇酯转移蛋白、脂蛋白脂酶、肝脂酶的作用下可产生颗粒小、密度大的小而密低密度脂蛋白(small and dense LDL,sLDL)和小高密度脂蛋白[19-20]。sLDL在血液中清除较慢,易被氧化修饰,而小HDL表面的ApoA1易脱落,容易经肾脏清除,促进动脉粥样硬化。此外,甘油三酯还有促进凝血、促进血小板聚集以及抑制纤溶的作用,这都为缺血性卒中的发生提供了条件。本实验未证明甘油三酯与粥样硬化斑块稳定性有关,可能与病例数不足有关。颈动脉粥样硬化斑块超声造影分级较高的患者,应该早期干预,定期监测及积极控制血脂,可应用颈动脉超声造影指导治疗,预防动脉粥样硬化进一步进展。
本研究收集时间较短,可能导致收集数量不足,且缺血性卒中危险因素多,混杂因素控制较差,这可能对研究结果有一些影响。
4 结论
基础血脂水平与粥样硬化斑块的超声造影增强程度具有相关性,基础低密度脂蛋白、总胆固醇越高、基础高密度脂蛋白水平越低,斑块的稳定性越差。在治疗超声造影等级较高的斑块时,需应用更强效的治疗来干预血脂水平。颈动脉超声造影是近年来新兴的超声技术,其临床应用范围广泛。颈动脉超声造影可以对斑块稳定性进行半定量评估,是一个评价治疗效果的较优选择。
