乳铁蛋白对APP/PS1转基因小鼠神经病理的抑制作用
2020-06-15许昱琛桑子玚阎思伯
许昱琛 桑子玚 阎思伯 郭 闯
东北大学生命科学与健康学院,辽宁 沈阳 110169
β-淀粉样蛋白(β-amyloid,Aβ)为主要组成的神经斑形成和积聚,是阿尔茨海默病(Alzheimer's disease,AD)的主要病理特征[1-2]。实际上,适宜浓度的Aβ对维持大脑的抗炎、血脑屏障、损伤修复以及突触功能等生理功能是有帮助的,但Aβ累积过多则对神经元产生毒害作用[3]。沉积在线粒体膜上的Aβ可打破线粒体膜电位平衡,导致电子传递链氧化磷酸化障碍、ROS大量产生,引起氧化应激反应,破坏其正常结构和功能,最终引起神经细胞凋亡[4]。而氧化应激所产生的羟基壬烯酸又能刺激Aβ产生,进一步加速AD的发展[5]。另外,铁等过渡金属离子的存在,也促进了AD脑内的氧化过程[6]。由于血脑屏障的存在,致使具备抗氧化作用的物质难以进入脑部,限制了脑内抗氧化作用物质的补充[7]。
乳铁蛋白(lactoferrin,Lf)是最早从牛乳中分离获得、具有多种生理学功能的一种非血红素铁结合糖蛋白。Lf不仅参与金属离子代谢,也与一系列的炎症反应及氧化等生理活动有关,并易于透过血脑屏障[8]。基于AD患者脑内Lf的表达量高于正常人,推测Lf可能具有阻抑AD病理进程的作用,并在AD动物模型中得以证实[9]。本研究将进一步探讨Lf阻抑APP/PS1小鼠神经病理、发挥神经保护作用的机制,以期为将外源补充Lf应用于AD的临床防治提供理论依据。
1 材料与方法
1.1实验动物APP/PS1(APPswe/PSEN1dE9)转基因小鼠始购于美国Jackson实验室,该小鼠在6个月龄左右脑内出现老年斑,是AD研究的常用模式生物。IVC笼具常规饲养,繁殖。子代进行PCR基因型鉴定,阳性的雄性小鼠用于实验。
1.2主要试剂及仪器试剂:人源乳铁蛋白Lf(Sigma,L4040),RIPA强裂解液、BCA蛋白浓度测定试剂盒(康为世纪生物有限公司),标准蛋白(上海碧云天生物技术有限公司),PVDF膜和蛋白marker(Thermo公司),Protease Inhibitor Cocktail(康为世纪生物有限公司),ECL发光液(Tanon公司),尼氏染液(上海碧云天生物技术有限公司);第一抗体:鼠源Aβ抗体购于Sigma公司,兔源GFAP(星形胶质细胞标记物)和谷胱甘肽过氧化物酶(GPX4)抗体购于Santa Cruz公司,兔源Iba-1(小胶质细胞标记物)抗体购于Wako公司,兔源线粒体转录因子A(TFAM)抗体购于北京博奥森生物技术有限公司,兔源NeuN(神经元标记物)和鼠源β-actin抗体以及荧光二抗(羊抗鼠/兔Alexa488和FITC)购于Cell Signaling Technology公司。
仪器:德国Leica公司的激光共聚焦显微镜、正置显微镜图像分析系统、冰冻切片机和石蜡切片机,美国 Bio-Rad公司的化学发光成像系统,美国Beckman公司的高速低温冷冻离心机,上海天能科技有限公司的电泳凝胶分析仪、电泳仪及电泳槽等。
1.3动物分组及用药取6个月龄雄性转基因小鼠16只,体质量25 g左右,随机分为对照组和Lf组。其中Lf组隔日鼻腔给予Lf溶液,使给药浓度达2 mg·kg-1,对照组给等体积的生理盐水。3个月后按伦理学要求处死动物,取材。右半脑后固定,用于形态学观察;左半脑-80 ℃冻存,用于分子生物学研究。
1.4实验方法
1.4.1 免疫荧光激光共聚焦显微镜观察:用4%多聚甲醛后固定的脑组织,放入30%的蔗糖溶液中,沉糖48 h。冰冻切片机切10 μm厚切片,自然风干后,取不同组位置一致的切片若干张放入ddH2O洗3次,5 min/次,山羊血清封闭液封闭1 h,滴加一抗稀释液(含TritonX-100)配制的两种不同来源的抗体,4 ℃孵育过夜,隔日,复温后,0.01 mol/L PBS漂洗,滴加PBS稀释的荧光二抗(1∶500)室温避光孵育2 h,PBS洗,DAPI染色5 min,防淬灭封片剂封片,激光共聚焦显微镜观察、照相。
1.4.2 尼氏染色:将5 μm石蜡切片常规脱蜡至水。用移液器在组织上滴加适量Nissl染液,染色8 min,然后用ddH2O洗涤2次,30 s/次。再将切片进行脱水、透明,分别于95%乙醇I、95%乙醇Ⅱ、二甲苯Ⅰ、二甲苯Ⅱ各2、2、5、5 min,最后滴加中性树胶、用盖玻片封片。待自然风干后在光学显微镜观察拍照。
1.4.3 Westernblot检测:称取小鼠的皮层或海马组织,加入含PMSF的RIPA裂解液,用超声破碎仪破碎组织,用4 ℃离心机以12 000 r/min转速离心30 min,收集上清,提取其总蛋白,并用BCA法测定蛋白浓度。蛋白变性后,放入-20 ℃冰箱保存,待用。取含等量总蛋白的样品,用10%浓度的SDS-PAGE胶进行电泳,分离蛋白,然后将其转印到甲醇活化的PVDF膜上。5%脱脂牛奶封闭1 h,借助蛋白marker的标记将PVDF膜裁剪为条带,分别加入5%脱脂牛奶稀释的一抗,在4 ℃冰箱摇床上孵育过夜。次日,从一抗中取出条带,用TBST漂洗3次,将条带放入用TBST稀释的辣根过氧化物酶-山羊抗鼠或兔第二抗体(1∶5 000,Santa Cruz),孵育2 h。TBST洗去残存二抗,将ECL发光液均匀滴加在裁好的PVDF膜上,用化学发光成像系统发光拍照。

2 结果
2.1Lf抑制APP/PS1转基因小鼠脑内Aβ诱发的星形胶质细胞活化GFAP是星形胶质细胞的标志性蛋白。免疫荧光显示(图1),GFAP染色(绿色)阳性的星形胶质细胞,在Aβ染色(红色)阳性的神经斑周边密集分布。与对照组相比,Lf处理组的星形胶质细胞的数量减少,且胞体变小、粗大的突起回缩,表明Aβ诱发的星形胶质细胞活化受到了抑制。
2.2Lf对APP/PS1转基因小鼠脑内小胶质细胞的影响通过Aβ(红色)与小胶质细胞标记蛋白Iba1(绿色)进行免疫荧光双标,检测小胶质细胞在APP/PS1小鼠脑内的分布情况。如图2所示,小胶质细胞主要集聚在Aβ阳性斑周围。与对照组相比,鼻腔给予hLf并未明显减少小胶质细胞的数目,但小胶质细胞的突起变少,胞体变圆。
2.3Lf上调GPX4和TFAM的表达为了探讨鼻腔给予Lf是否在APP/PS1小鼠脑内发挥抗氧化功能,我们用Western blot检测了GPX4和TFAM蛋白的表达情况。如图3所示,相较于对照组,Lf组小鼠脑内的GPX4和TFAM蛋白的表达均显著增高。
2.4Lf改善APP/PS1转基因小鼠神经元的功能尼氏染色(图3A)显示,与对照组相比,Lf组APP/PS1小鼠神经元的尼氏染色强度明显增强,尤其在海马CA3区的神经元更明显。进一步用Western blot检测神经元的标记蛋白NeuN的表达情况,结果证实Lf组APP/PS1小鼠脑内的NeuN蛋白含量亦明显上调,表明神经元的功能受到保护。
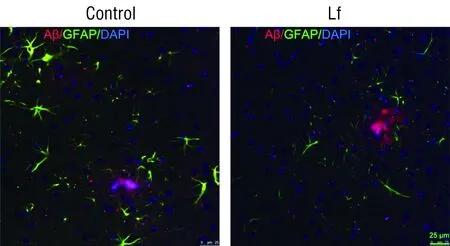
图1 Aβ和星形胶质细胞在APP/PS1双转基因小鼠脑内的分布观察Figure 1 Distribution of Aβ and astrocytes in the brain of APP/PS1 double transgenic mice

图2 Aβ和小胶质细胞在APP/PS1双转基因小鼠脑内的分布观察Figure 2 Distribution of Aβ and microglia in the brain of APP/PS1 double transgenic mice

图3 GPX4和TFAM蛋白在APP/PS1双转基因小鼠脑内的表达变化Figure 3 Expression changes of GPX4 and TFAM proteins in the brain of APP/PS1 double transgenic mice

图4 APP/PS1双转基因小鼠的尼氏染色及脑内NeuN蛋白的表达变化Figure 4 Nissl staining of APP/PS1 double transgenic mice and expression of NeuN protein in the brain
3 讨论
目前,对AD的防治尚缺乏有效的措施,这可能与AD的发病机制复杂有关,因此,具有多作用靶点的药物或联合用药引发了更多关注[10]。Lf具有的抗炎、抗氧化及螯合铁等多种生物学功能[11],为临床用于AD的防治提供了可能。
既往研究发现,在APP/PS1小鼠脑内Lf的表达高于野生对照小鼠,但在老龄时含量降低[11],提示Lf在AD病变区的表达可能与抑制其神经病理有关。这在我们前期的研究中得到证实,鼻腔给予Lf能够调节APP向非淀粉样途径代谢,从而减少Aβ的产生,并改善APP/PS1小鼠的认知下降[9]。本实验中,首先验证Lf的抗炎效果[12],通过免疫荧光双标激光共聚焦技术发现,9月龄AD模型小鼠明显激活的星形胶质细胞,在给予Lf后数量减少且突起回缩,呈低活性状态,鼻腔给予APP/PS1小鼠Lf能够显著抑制星形胶质细胞活性。但并未发现小胶质细胞数量显著减少,而其形态变化呈现吞噬作用状态。实际上,作为中枢神经系统中发挥免疫细胞作用的主要细胞,目前认为小胶质细胞可能通过两种机制在AD的发病机制中起作用。一方面,随着AD的特征性病理改变,小胶质细胞也随之活化进而引起局部的炎症反应;另一方面,其可以起到清除Aβ的作用[13-14]。本实验中,我们推测因为Lf减少了Aβ的产生,使其病理进展延缓,因而小胶质细胞发挥吞噬作用为主。
Lf已被证实具有螯合铁离子的作用[15],而细胞内铁沉积被认为是诱导氧化应激产生及对神经元毒害的重要原因[16-17]。GPX4是一种多功能的硒蛋白,广泛存在于哺乳动物体内,是人体参与抗氧化作用的一类重要蛋白,能保护生物膜系统免受氧化,同时也在细胞凋亡等方面有着重要作用[18]。TFAM是一种DNA结合蛋白,可以调控线粒体转录复制,同时也参与氧化磷酸化产生能力的过程,而且在发生氧化应激时,可对线粒体发挥保护作用,抑制细胞凋亡[19-20]。研究发现鼻饲Lf能提高小鼠脑中GPX4和TFAM等蛋白的表达,这些结果提示外源Lf可通过螯合铁并上调抗氧化酶系统的表达发挥抗氧化作用[21-22]。重要的是,具有促进神经元再生增强神经元抗损伤与凋亡能力的神经元特异核蛋白NeuN[23]也在Lf处理后上调,并且通过尼氏染色发现给Lf组APP/PS1小鼠脑内以CA3区为代表的神经元胞体内尼氏体呈现增多的趋势,而尼氏体的主要作用是合成用于更新细胞器的结构蛋白,合成神经递质所需的酶类以及肽类的神经调质[24]。尼氏体大而多反映神经细胞合成蛋白质的功能较强,在神经元受损时,尼氏体数量减少甚至消失[25]。
本研究证实,鼻腔给予APP/PS1小鼠2 mg/Kg的Lf,除通过调节APP向非淀粉样途径代谢,减少Aβ的产生之外[9],也可通过抑制神经炎症、抗氧化、改善线粒体功能等多靶点、多途径保护神经元免受Aβ和游离铁离子的毒性损伤,也为选用Lf用于AD的临床防治提供了一定的理论依据。
