牡蛎酶解物对Lewis肺癌的抑制作用及机制
2020-06-15武美彤张海欣张梦毕园徐昊然凌空金其贯刘文颖
武美彤,张海欣,张梦, 3,毕园,徐昊然,凌空,金其贯*,刘文颖*
1(扬州大学 体育学院,江苏 扬州,225127) 2(中国食品发酵工业研究院有限公司,北京市蛋白功能肽工程技术研究中心,北京,100015) 3(江苏食品药品职业技术学院,江苏 淮安,223003)
调查发现,肺癌在发达国家和发展中国家均为恶性肿瘤发病率的第一位,并预测2020年在发展中国家其发病率仍居首位[1]。在我国,肺癌的发病率比20世纪70年代上升了465%,居于癌症死亡的首位[2]。尽管肺癌的治疗技术日新月异,但现有的抗肿瘤药物只能缓解病情,5年生存率从仅有的4%上升到12%左右,平均无进展生存期仅延长3~5个月[3]。因此,肺癌的治疗效果仍不能令人满意。牡蛎(oyster)俗称海蛎子,肉质鲜美,含有丰富蛋白质、氨基酸、牛磺酸、维生素和矿物质等,具有增强雄激素、增强免疫力、降血糖等功效,具有很好的食疗价值[4-6]。近几年来国内已有研究报道,牡蛎粗提取物具有抑瘤、增效、减毒的作用[7-8]。而牡蛎酶解物(oyster enzymatic hydrolysate,OEH)是对牡蛎肉进行酶解、浓缩冷冻干燥后获得,不仅含有分子质量<1 000 Da的寡肽——牡蛎低聚肽(oyster oligopeptides,OOP),而且含有丰富的氨基酸和牡蛎多糖、矿物质等成分。由于寡肽可以不经消化迅速被吸收,比游离氨基酸吸收率更高,且寡肽是介于氨基酸和蛋白质之间的结构功能片段,因此牡蛎低聚肽与自然牡蛎蛋白相比,不仅具有较高的生物活性,而且吸收率更高[9-10]。研究证明,牡蛎低分子活性物质不仅能够抑制肺腺癌A549 细胞生长率达62.2%,而且能有效抑制人胃腺癌BGC-823 细胞增殖活动[11-12]。为了研究OEH补充对肺癌增长的抑制作用并了解其机制,在建立小鼠Lewis肺癌模型的同时,按照低、中、高3种剂量给小鼠补充OEH,观察并测量荷瘤小鼠的肿瘤体积,5周后进行取材,称量肿瘤质量,观察肿瘤组织的结构,并测定肺癌组织中肺癌细胞的凋亡率、坏死率,血液中CD3+、CD4+、CD8+T淋巴细胞、自然杀伤细胞(natural killer cells,NK)细胞和调节性T细胞(regulatory T cell,Treg)的百分比,为OEH在临床辅助治疗肿瘤提供依据。
1 材料与方法
1.1 材料与试剂
牡蛎肉,北京中食海氏生物技术有限公司提供;细胞色素C(分子质量12 500 Da)、杆菌酶(1 450 Da)、乙氨酸-乙氨酸-酪氨酸-精氨酸(451 Da)、乙氨酸-乙氨酸-乙氨酸(189 Da)4种分子质量肽标准品、甲醇(色谱纯)、三氯乙酸等,Sigma公司;小鼠Lewis肺癌细胞株LL/2,美国菌种保藏中心,由上海纪宁实业有限公司提供;胎牛血清(fetal bovine serum,FBS),美国Hyclone公司;DMEM,Sigma-Aldrich公司;2.5 g/L胰酶、台盼蓝染色细胞存活检测试剂盒,碧云天生物技术有限公司;CD3、CD4、CD8、NK、CD25、CD127等荧光抗体以及Annexin V-PE/7-AAD凋亡检测试剂盒,BD公司提供;雄性C57BL/6J小鼠,扬州大学比较医学中心,许可证号:SYXK(苏)201600019。
1.2 仪器和设备
UV22100紫外分光光度计,优尼柯(上海)仪器有限公司;QSY-Ⅱ型凯氏定氮仪,北京强盛分析仪器仪器制造中心;LC-20A高效液相色谱仪,SHIMADZU公司;835-50型氨基酸分析仪,HITACHI公司;Heraeus CO2培养箱,德国Heraeus(贺力氏);Cyto FLEX流式细胞分析仪,Beckman;BX53荧光倒置显微镜,OLYMPUS。
1.3 实验方法
1.3.1 OEH的制备
将1 kg鲜牡蛎肉用搅拌机搅碎,用蒸馏水定容至3 L,沸水浴1 h后,降至室温,以3 000×g离心处理5 min。将沉淀加入500 mL蒸馏水,搅拌均匀后,用NaOH调整pH至7.0,放入水浴中,升温至50 ℃。按每100 g原料加入20 000 U的酶量加入中性蛋白酶,酶解1 h后,再按每100 g原料加入32 000 U的酶量加入木瓜蛋白酶,继续酶解2 h。然后100 ℃灭酶15 min。冷却后,3 000×g离心10 min,取上清液。将上清液过100目筛后,利用喷雾干燥器进行干燥,最终得到牡蛎酶解物干粉。
1.3.2 OEH 组成成分的测定
采用凯氏定氮法(GB 5009.5—2016)测定总蛋白含量[13];三氯乙酸法测定酸溶蛋白含量[14];氨基酸自动分析法(GB 5009.124—2016)测定游离氨基酸的组成和含量[15];高效液相凝胶色谱法测定分子质量的分布范围[16];菲林试剂法测定总糖含量[17];灼烧法(GB 5009.4—2016)测定灰分[18];常压干燥法(GB 5009.3—2016)测定水分[19]。
1.3.3 Lewis肺癌小鼠模型的建立
6周龄清洁级雄性C57BL/6J小鼠 48 只,体质量(20±2)g,分笼饲养,每笼12只,环境温度(23±2)℃,采用自然光照,自由饮食和饮水。
取小鼠Lewis肺癌细胞株LL/2,放入含体积分数10% FBS的DMEM完全培养液中,置37 ℃、体积分数5%的CO2培养箱中培养。当细胞生长完全融合,按1∶3的比例[将一瓶细胞(10 mL)分成3瓶(10 mL/瓶)进行培养]传代,取对数生长期细胞,经2.5 g/L胰酶消化后以1 000 r/min转速离心5 min,加入生理盐水制成细胞悬液。台盼蓝染色法测定活细胞数>95%,调整细胞浓度至6×106/mL,接种于C57BL/6J小鼠右前肢腋窝皮下,每只0.2 mL,全程严格无菌操作,40 min内完成。Lewis肺癌小鼠模型建立后,观察其成瘤情况,每周固定时间用游标尺测量瘤的长径(L)和短径(W),并用公式V=1/2×L×W2计算肿瘤体积。
1.3.4 动物分组及其干预方案
小鼠接种Lewis肺癌细胞株LL/2 24 h后称重、编号,随机分为荷瘤对照组(C)、荷瘤+低剂量OEH干预组(LOEH)、荷瘤+中剂量OEH干预组(MOEH)和荷瘤+高剂量OEH干预组(HOEH),每组12只。除了C组在肺癌细胞接种后,每天灌服9 g/L生理盐水外,LOEH、MOEH和HOEH组在肺癌细胞接种后,分别每天按照0.8、1.8和2.5 g/kg的剂量灌服OEH,共5周。
1.3.5 实验取材和样本处理
取材前禁水禁食8 h,按照体质量(0.02 mL/g)用36 g/L的水合氯醛进行麻醉,用镊子轻轻摘除眼球进行眼窝取血,血液装于含有肝素的EP管中,轻轻摇匀。然后速取肿瘤组织,准确称量质量后分为3份,一份迅速放入体积分数10%的甲醛溶液中固定,一份放入冻存管内迅速投入液氮,而后置于-80 ℃冰箱保存待测,另一份迅速制成肿瘤细胞悬液进行相应指标的检测。
1.3.6 指标的测定
1.3.6.1 存活率的计算
每天记录小鼠的存活情况,5周后按式(1)计算各组小鼠存活率:

(1)
1.3.6.2 抑瘤率的计算
计算C、LOEH、MOEH和HOEH4组的平均瘤质量,按公式(2)计算各组的抑瘤率:

(2)
1.3.6.3 肺癌细胞的凋亡和坏死数量的检测
在相同位置取适量的肺癌组织,在平皿中用PBS缓冲液洗涤3次后,用无菌眼科剪将肿瘤组织剪碎,2.5 g/L胰酶消化,经300目滤网过滤成单细胞悬液。将细胞调整到5×105/mL左右,取100 μL放入流式管中,用PBS缓冲液洗涤细胞2次(2 000 r/min 离心 5 min),加入50 μL的Binding Buffer和5 μL 7-AAD染液,混匀,室温、避光、反应 15 min后再加入450 μL的Binding Buffer和1 μL Annexin V-PE混匀,室温、避光、反应15 min后上机检测。
1.3.6.4 肺癌组织形态结构的观察
常规制作肺癌组织的石蜡切片,在显微镜下观察肿瘤组织形态结构,并拍照。
1.3.6.5 血液中T细胞亚群和NK细胞数量百分比的检测
取小鼠外周抗凝血200 μL置于流式管中,加入2 mL,1×红细胞裂解液混匀,避光孵育15 min后,300×g离心5 min,弃上清液,加入1 mL PBS缓冲液重悬,300×g离心5 min后弃上清液,加100 μL PBS缓冲液重悬,得到外周血单核细胞悬液。加入CD3/CD4/CD8/NK抗体,避光孵育20 min。加1 mL PBS缓冲液重悬,300×g离心5 min,弃上清液后,加入200 μL PBS缓冲液,采用Cyto FLEX流式细胞分析仪检测。
1.3.6.6 血液中Treg细胞数量的检测
取小鼠外周抗凝血200 μL置于流式管中,加入2 mL,1×红细胞裂解液混匀,避光孵育15 min后,300×g离心5 min,弃上清液,加入1 mL PBS缓冲液重悬,300×g离心5 min后弃上清液,加100 μL PBS缓冲液重悬,得到外周血单核细胞悬液。加入CD4/CD25/CD127抗体,避光孵育20 min。加1 mL PBS缓冲液重悬,300×g离心5 min,弃上清液后,加入200 μL PBS缓冲液,采用Cyto FLEX流式细胞分析仪检测Treg(CD4+CD25+CD127-)细胞数量。
1.3.7 统计学分析
使用SPSS 20.0 统计软件处理数据,结果用均数±标准差表示,对C、LOEH、MOEH和HOEH组采用单因素方差分析和多重比较,P<0.05,表示差异具有显著性,P<0.01,表示差异具有极显著性。
2 结果与分析
2.1 OEH的组成成分
由表1可知,OEH的总蛋白含量为57.23%,酸溶蛋白含量为52.12%,酸溶蛋白占总蛋白含量的91.07%。总糖含量25.89%、游离氨基酸的含量为6.16%。由于小分子的肽类物质和游离氨基酸可以溶于酸性溶液[16],因此在OEH中,小分子低聚肽的含量约为45.96%。通过HPLC分析了OEH的相对分子质量,结果发现,OEH相对分子质量<1 000 Da的有91.92%,表明OEH的主要成分不仅含有小分子低聚肽,而且含有丰富的牡蛎多糖等物质。有研究证明,分子质量<1000 Da的低聚肽多为二肽和三肽[16],相比于蛋白质和游离氨基酸具有较快的吸收速度[20],且牡蛎多糖可不经消化就能吸收[21],因此,可以推论OEH具有良好的吸收效率。
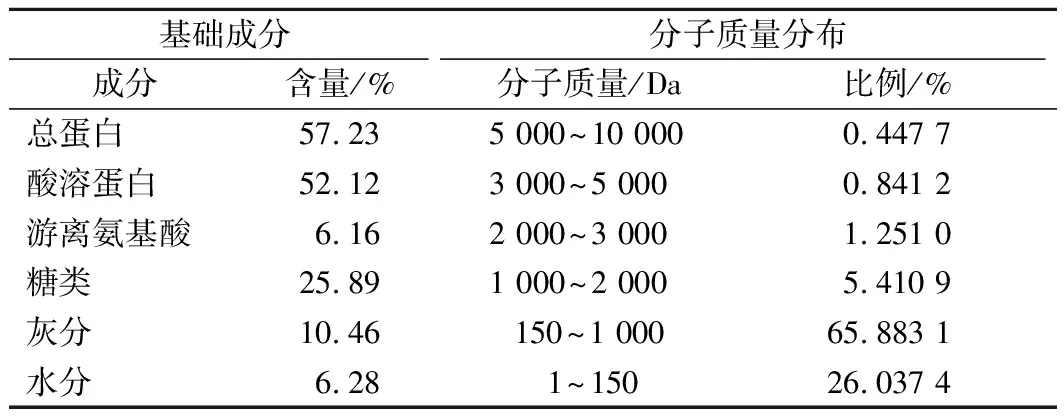
表1 OEH的基础成分和分子质量分布Table 1 Basic composition and molecular weightdistribution of OEH
2.2 OEH对小鼠皮下Lewis肺癌生长的抑制作用
虽然牡蛎低聚肽具有多种生理功能,但对肿瘤抑制效应的研究并不多见。有研究发现,从牡蛎分离提取出来的牡蛎天然低分子多肽BPO-L不仅能够有效抑制人肺腺癌A549 细胞增殖活动[22],而且改变人肺腺癌A549细胞的恶性形态与超微结构特征[23],对肺癌细胞具有显著的诱导分化作用。本研究发现,虽然OEH对肺癌的体积没有显著的效应(F=1.168,P=0.348),但是随着OEH剂量的增加,肺癌体积降低的趋势越明显。OEH对荷瘤小鼠肺癌质量的降低具有显著的效应(F=3.636,P=0.032),剂量越高,降低肺癌质量效果越明显(表2和图1)。采用多重比较分析发现,与C组相比,HOEH和MOEH组肺癌质量显著性降低(P=0.007,P=0.013),LOEH组肺癌质量有所降低,但没有显著性差异(P=0.082)。小、中等和高剂量OEH对荷瘤小鼠皮下肿瘤抑制率分别达到22%、29%和36%。虽然MOEH组小鼠5周存活率达到67%,但是OEH的补充对荷瘤小鼠的 5 周存活率没有显著的效应(χ2=2.254,P=0.521)。从而进一步说明,中、高剂量的OEH对荷瘤小鼠肺癌的增长具有显著的抑制效应,但不能显著提高荷瘤小鼠的5周存活率,其原因还有待进一步研究。

表2 各组小鼠肺癌重量、抑瘤率及5周存活率的变化Table 2 Changes of lung cancer weight, tumor inhibitionrate and 5-week survival rate in each group of mice
注:C、LOEH、MOEH和HOEH组进行多重比较,与C组相比,*,P<0.05,**,P<0.01(下同)
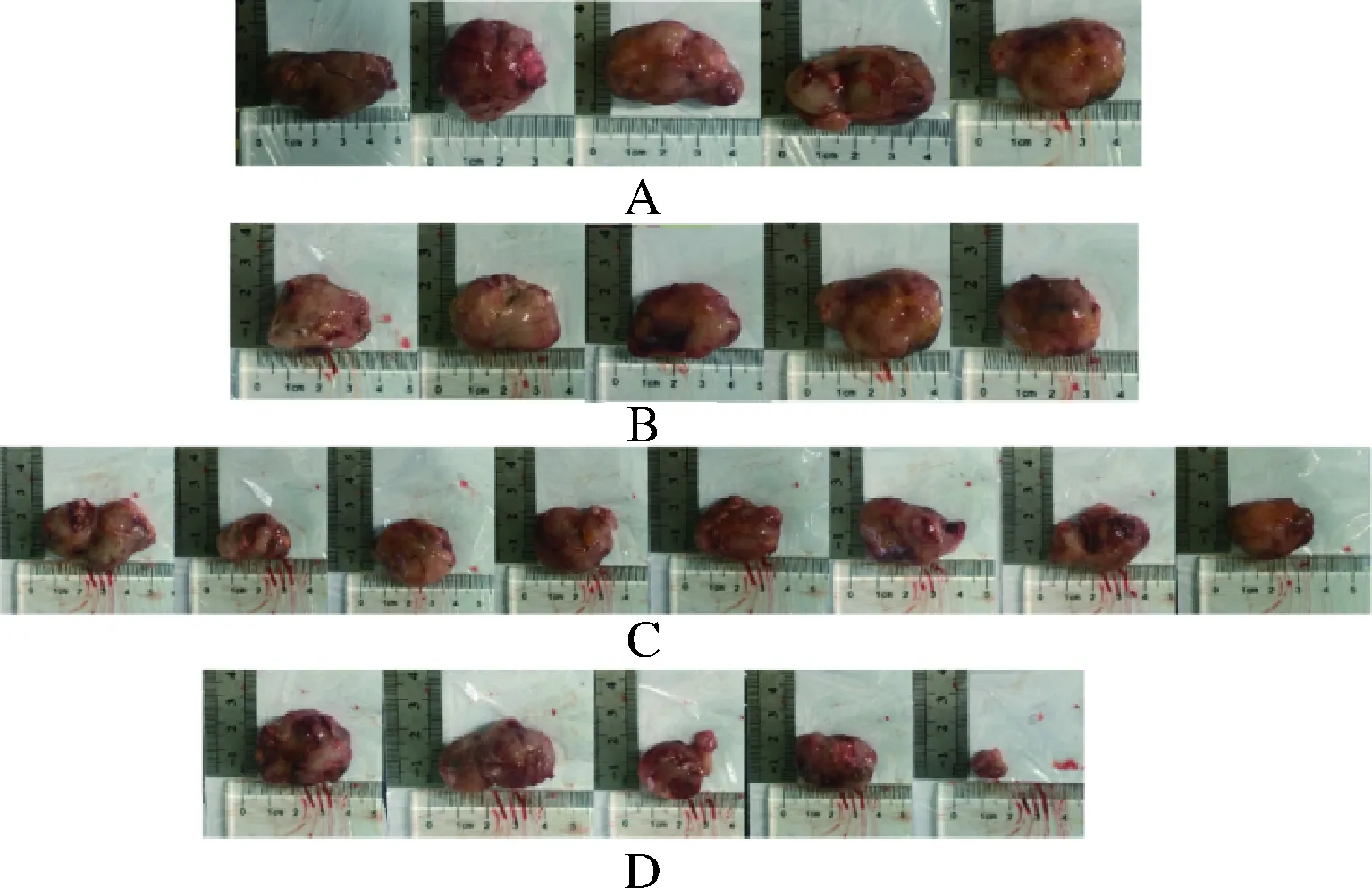
A-C组;B-LOEH组;C-MOEH组;D-HOEH组(下同)图1 各组小鼠的肿瘤Fig.1 Lung cancer from each group of mice
2.3 OEH对荷瘤小鼠肺癌组织细胞凋亡和坏死的促进作用
细胞凋亡是一种程序性的细胞死亡,能将机体衰老和异常细胞及时清除。肿瘤的发生和发展不仅与细胞过度增殖有关,而且与细胞凋亡的减少密切相关[24]。因此,抑制肿瘤细胞的增殖并诱导其凋亡已成为肿瘤治疗的重要方法之一。李祺福等[22]从牡蛎体内分离提取到牡蛎低分子活性多肽BPO-L通过减弱A549 细胞MTp53、c-myc等癌基因蛋白表达,增强p21WAF1/CIP1 和Rb等抑癌基因蛋白的表达,有效抑制A549 细胞增殖活动。本研究发现,OEH对荷瘤小鼠肺癌细胞的坏死率和凋亡率升高具有显著的效应(F=3.546,P=0.034;F=3.546,P=0.004),OEH剂量越高,肺癌细胞坏死率和凋亡率升高效果越明显(表3和图2)。采用多重比较分析发现,与C组相比,LOEH组肺癌细胞的坏死率没有显著性增加(P=0.191),凋亡率有极显著性增加(P=0.001);MOEH组肺癌细胞的坏死率和凋亡率均显著性的增加(P=0.009、P=0.010),HOEH组肺癌细胞的坏死率和凋亡率有显著性增加(P=0.014、P=0.001)。同时从肺癌组织结构上看(图3),C组肺癌组织内细胞密集且排列整齐,肺癌组织内毛细血管丰富,表明肺癌细胞生长旺盛且状态良好,细胞核异染且清晰可见;LOEH组肺癌细胞呈现小片状坏死;MOEH组和HOEH组可见其肺癌组织疏松,细胞排列不规则,可见不同程度的片状坏死区,肺癌组织内及其周围微血管均较少。从而说明随着OEH剂量的增加,肺癌细胞坏死区增大,且肺癌组织内及其周围毛细血管减少。因此,OEH不仅能有效促进荷瘤小鼠肺癌细胞的凋亡,而且能有效促进肺癌细胞的坏死,从而有效抑制肺癌的生长。

表3 各组小鼠肺癌细胞坏死率和凋亡率Table 3 Necrosis rate and apoptosis rate of lung cancercells in each group of mice

图2 不同组别肺癌细胞坏死率和凋亡率Fig.2 Necrosis rate and apoptosis rate of lung cancercells in different groups注:UL区域的细胞为坏死细胞;UR区域的细胞为晚期凋亡细胞;LR区域的细胞为早期凋亡细胞;LL区域的细胞为活细胞

图3 各组小鼠肺癌组织HE染色(×400)Fig.3 HE staining in lung cancer tissues in eachgroup of mice
2.4 OEH对荷瘤小鼠免疫功能的提高作用
机体的免疫功能与肺癌的发生发展有密切关系,当患者的免疫功能低下或受抑制时,肺癌的发病率增高;而在体内肿瘤进行性生长时,患者的免疫功能受抑制,两者互为因果。外周血T 淋巴细胞亚群和NK细胞能较好地反映机体的细胞免疫状态,在免疫调节和免疫耐受中发挥着重要作用[25]。其中NK 细胞可通过释放穿孔素、颗粒酶等生物活性分子直接杀伤肿瘤细胞,是抵抗肿瘤生长的第一道防线;CD4+和CD8+ T 细胞介导的细胞免疫应答在机体抗肿瘤免疫中也发挥非常重要的作用,CD4+ 细胞具有激活和增强免疫细胞毒T细胞和NK细胞的作用,CD8+是一种抑制性T 淋巴细胞,可刺激肿瘤的扩散和转移[26-27]。Treg(CD4+CD25+)是一类具有独特免疫调节作用的T 细胞,在某些恶性肿瘤中,Treg水平升高可导致免疫功能混乱,促进肿瘤生长,抑制抗肿瘤免疫效应,同时肿瘤细胞可分泌TNF-β、IL-10 等抑制因子,诱导Treg分化,两者相互作用,共同介导肿瘤免疫逃逸[28-29],而抑制Treg可以提高机体抗肿瘤能力[30]。研究表明,肺癌患者有不同程度的免疫功能受损,表现为CD3+、CD4+、NK 及CD4+ /CD8+显著降低,而CD8+显著增多(P<0.05)[31-32]。且T 淋巴细胞亚群水平与肺癌病情的严重程度密切相关,肺癌病情越重,免疫状况越差[33]。而牡蛎提取物[34]和牡蛎肽[35-37]对小鼠免疫功能有积极的调节作用,它不仅增加NK细胞和淋巴细胞的功能,而且减轻和恢复环磷酰胺(cytoxan, CTX)诱导的低免疫应答。虽然牡蛎提取物可提高荷瘤小鼠的免疫功能,特别是NK细胞活性,从而抑制小鼠肝癌和裸鼠体内人结肠癌的生长[7, 38],然而OEH对荷瘤机体免疫功能影响的研究报道并不多见。由表4、表5和图4、图5可知,OEH对荷瘤小鼠血液中CD4+T淋巴细胞百分比的升高和Treg细胞百分比下降具有显著的效应(F=9.808,P=0.000;F=9.792,P=0.000),但对CD3+、CD8+T淋巴细胞和NK细胞百分比以及CD3+/CD8+的增加无显著的效应(F=2.187,P=0.123;F=1.248,P=0.320;F=1.932,P=0.160;F=2.442,P=0.096)。经过多重比较,与C组相比,LOEH组血液中CD3+百分比显著性增加(P=0.024);MOEH组CD4+T淋巴细胞百分比和CD4+/CD8+比值均显著性增加(P=0.000、P=0.016);HOEH组CD4+T淋巴细胞百分比显著性增加(P=0.024),且LOEH、MOEH和HOEH组血液中Treg 细胞百分比均显著下降(P=0.000、P=0.000、P=0.008)。因此,OEH的补充能够显著降低荷瘤小鼠外周血中Treg 数量,一方面使同种同型或同种异型 CD4+CD25- 和CD8+T 细胞活化、增殖,引起荷瘤小鼠外周血中CD4+和CD8+T淋巴细胞数量的增多;另一方面可以促进 NK 细胞的增殖、细胞因子分泌和细胞毒作用,提高荷瘤小鼠的免疫功能,从而对肺癌的生长产生非常重要的抑制作用。但OEH提高荷瘤机体的免疫功的机制目前还不清楚,可能是由于OEH中含有丰富的寡肽一方面为淋巴细胞的增殖提供充足的氮源和能量,另一方可能寡肽中某些活性成分具有促进淋巴细胞的活化和分化,同时,OEH中丰富的牡蛎多糖也具有促进淋巴细胞增殖,提高免疫功能的作用[39-40],具有抗肿瘤活性[40],但其确切机制还有待于进一步研究。
然而,随着OEH剂量的增加CD4+细胞数量有降低的趋势,且HOEH组CD4+细胞数量显著低于LOEH组(P=0.024),Treg细胞数量有增加趋势,但3组之间无显著性差异。其结果与胡相卡等的研究相似,他们以从牡蛎肉中提取出来的多肽类物质牡蛎素为研究对象,发现不同剂量的牡蛎素对小鼠的非特异性免疫、特异性免疫(细胞免疫和体液免疫)均有相应的增强作用,随着牡蛎素剂量的增加,小鼠机体免疫不断增强,但增加到一定剂量时,小鼠机体免疫不再增强[41]。因此,在抗肿瘤时,OEH的适宜剂量还有待于进一步研究。
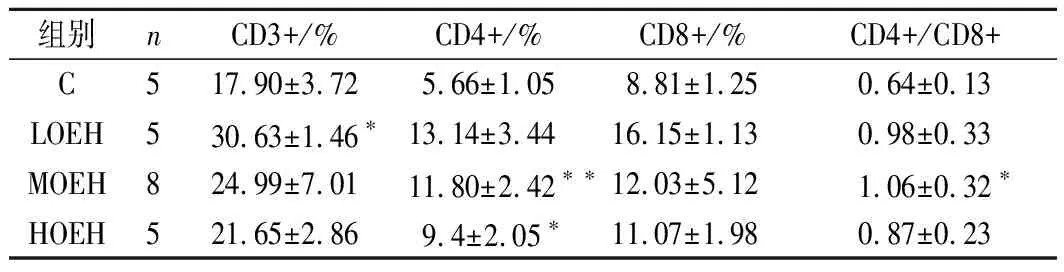
表4 各组小鼠血液中T淋巴细胞百分比Table 4 Percentage of T lymphocyte in blood ineach group of mice

表5 各组小鼠血液中NK和Treg细胞的百分比Table 5 Percentage of NK and Treg in blood in eachgroup of mice

图4 各组小鼠血液中CD3+、CD4+、CD8+T淋巴细胞百分比Fig.4 Percentage of CD3+, CD4+, CD8+ T lymphocytesin blood in each group of mice

A,E-C组;B,F-LOEH组;C,G-MOEH组;D,H-HOEH组图5 各组小鼠血液中NK和Treg细胞的分布图Fig.5 Percentage of NK and Treg cells in blood in each group of mice注:a图中小方格中的细胞为NK细胞;b图中LR区域的细胞为CD4+CD25+CD127-Treg细胞
3 结论与展望
本研究通过在体实验证实了牡蛎酶解物能够增加荷瘤小鼠T淋巴细胞和NK细胞功能,提高肺癌细胞的凋亡率和死亡率,从而显著降低荷瘤小鼠肺癌的体积和质量,且具有一定的剂量效应,但以中、高剂量效果较好。然而牡蛎酶解物中的成分比较复杂,具有显著抗肿瘤活性的具体成分以及牡蛎酶解物确切的免疫调节机制目前还不完全清楚。因此,在后续的研究中如何分离纯化牡蛎酶解物中具有显著抗肿瘤活性的营养成分,并进一步研究牡蛎酶解物的免疫调节机制,对于促进牡蛎酶解物在抗肿瘤中的具体应用具有非常重要的意义。
