浓香型窖泥原核微生物群落多样性及其在窖池中的空间异质性
2020-06-15胡晓龙王康丽余苗田瑞杰范海报孙继祥张军杨旭马歌丽魏涛
胡晓龙,王康丽,余苗,田瑞杰,范海报,孙继祥,张军,杨旭,马歌丽,魏涛*
1(郑州轻工业大学 食品与生物工程学院,河南 郑州, 450000) 2(河南仰韶酒业有限公司,博士后创新实践基地,河南 渑池, 472400) 3(河南皇沟酒业有限责任公司,河南 永城, 476600)
窖泥是我国特有的环境样品,是一种富含多种有机物(脂肪酸、醇、酯等),具有高腐殖质含量、高含水量及低含氧量等特性的特殊土壤[1-3],栖息着大量厌氧菌群,如乳酸菌、产己酸菌及产甲烷菌等。窖泥微生物菌群是影响窖泥和白酒质量优劣的主要因素[4],同时也是白酒酿造过程中重要的微生物来源,尤其是厌氧菌群[5]。
窖泥微生物的研究主要包括:(1)功能微生物分离及应用等。如自1964年“茅台试点”以来,有诸多关于己酸菌的研究,其中吴衍庸等[6]率先从窖泥中分离出多株己酸菌(如ClostridiumLushun)并成功应用人工窖泥制备、窖泥养护等,大大缩短窖泥自然老熟时间及提升白酒品质;近年来任聪等[7]通过差异性解析新老窖泥微生物菌群组成确定了窖泥中主体己酸菌为产己酸菌属(Caproiciproducens)等;(2)群落多样性解析。这主要是由于系统阐明浓香型窖泥中微生物群落α-及β-多样性及其影响因素,对评估窖泥质量和安全、揭示窖泥菌群代谢特征、控制和优化群落结构及深入探究其在白酒酿造过程中的发酵机制具有重要的理论及现实意义。由于高通量测序技术的广泛应用[8],不同窖龄、质量、地理位置及窖池空间位置窖泥菌群组成、优势菌及痕量微生物已逐渐清晰,而且明确了pH、有效磷、含水量等是影响窖泥微生物菌群组成的重要理化因子[2,4,9-10]。但有关我国北方浓香型白酒主产区河南的窖泥微生物群落多样性研究鲜有报道。郑佳等[11]发现,窖泥香气物质含量与其所处窖池空间位置有关,如距窖口30 cm(上层)、120 cm(中层)、210 cm(下层)和240 cm(窖底)的窖泥香气成分组成存在明显的差异。TAO等[9]发现老窖池(≥25年)的窖底泥原核微生物群落趋于稳定,但其中窖泥微生物群落的空间分布特征尚不清晰。
本文以河南某知名浓香型白酒企业的老窖池(35年)窖泥为研究对象,采用高通量测序技术全面解析窖壁上层、中层、下层和窖底窖泥原核微生物群落α-和β-多样性;并基于冗余分析探究影响微生物菌群分布的理化因素,以期揭示窖泥原核微生物群落多样性在老窖池中的空间异质性及形成原因,为进一步探究不同位置窖泥对浓香型白酒酿造及风味物质形成的具体影响和贡献提供理论支撑。
1 材料与方法
1.1 材料与试剂
窖泥样品由河南某知名浓香型白酒企业提供;NaOH、酚酞、邻苯二甲酸氢钾、浓H2SO4、HCl、重铬酸钾、酒石酸钾钠、亚硝基铁氰化钾、高氯酸钠、NH4Cl、酒石酸锑钾、钼酸铵、氟化铵、硼酸,均购自国药集团化学试剂有限公司。
1.2 仪器与设备
UV BlueStar A紫外分光光度计,北京莱伯泰科仪器股份有限公司;TGL-20M高速冷冻离心机,上海卢湘仪离心机仪器有限公司;PB-10 PH计,德国Sartorius公司;MP200A精密电子天平,上海良丰仪器仪表有限公司;101-1电热鼓风干燥箱,北京中兴伟业仪器有限公司;DF-1集热式恒温磁力搅拌锅,金坛市中大仪器厂。
1.3 实验方法
1.3.1 窖泥样品采集
对河南一家知名浓香型白酒企业的老窖池(35年)进行取样,该企业浓香型白酒生产以多粮(高粱、小麦、大米、糯米、玉米)为原料,中高温大曲为糖化发酵剂,采用固定配醅比例入池,混蒸混烧、泥窖固态续茬发酵方式,分层蒸馏,分段摘酒,分级储存。随机选取2口窖池,每口窖池选取窖壁上层(PW-T,距窖口垂直距离约0.3 m)、中层(PW-M,窖壁中心)和下层(PW-U,距窖底垂直距离约0.3 m),以及窖底(PB)窖泥取样;每层选取2个(距每层中心两侧0.3 m处)窖泥样品并混匀作为该层代表性样品,窖底泥代表样品为窖底平面对角线交界点处窖泥和任一条对角线的一个四分位点处窖泥的混合物。即每口老窖池共取4个代表样品,共计8个窖泥样品。将每份窖泥样品分为2份于-20 ℃冰箱保存,1份用于理化性质分析,另1份用于高通量分析。
1.3.2 理化指标测定
参照李俊辉等[12]提出的烘干法和电位法分别测定窖泥含水量及pH。采用酸、碱中和滴定法测定总酸含量[13]。采用重铬酸钾氧化分光光度法测定乙醇含量[14]。采用靛酚蓝比色法测定窖泥中氨态氮的含量[15]。参照NY/T 1121.7—2014行业标准测定窖泥中有效磷含量。
1.3.3 窖泥宏基因组提取及 Illumina Miseq 测序
利用Magen HiPure Soil DNA Kit试剂盒并参照说明书对窖泥样品进行总DNA提取,然后用Qubit 2.0荧光定量仪测定其浓度和纯度。将合格的DNA委托苏州金唯智生物科技有限公司完成建库及Illumina MiSeq双端测序。其中16S rDNA扩增子引物对为F:5’-CCTACGGRRBGCASCAGKVR VGAAT-3’和R:5’-GGACTACNVGGGTWTCTAATCC-3’,扩增区域为16S rDNA的V3-V4区。
1.3.4 数据分析
采用Cutadapt(v1.9.1)、Vsearch(v1.9.6)及Qiime(v1.9.1)软件对高通量测序序列进行质控,包括序列拼接,以及去除含有 N 的序列、引物和接头、质量值<20的碱基、长度<200 bp的序列及嵌合体序列得到有效序列。使用 VSEARCH(v1.9.6)将有效序列进行聚类,其中相似性≥97%的序列归为1个OTU。然后利用 RDP classifier (ribosomal database program) 贝叶斯算法对 OTU 的代表性序列进行物种分类学分析,并在不同物种分类水平下统计每个样本的群落组成。基于 OTU得到分析结果,采用对样本序列进行随机抽平的方法,分别计算 Shannon、Chao1等α-多样性指数反映群落的物种丰度和多样性。采用软件Canoco 5绘制RDA图谱;SPSS 20软件(IBM Corp., Armonk, NY)进行单因素方差分析(ANOVA);Venn图采用在线软件(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制;Heml软件绘制热图。
2 结果与分析
2.1 窖泥样品理化性质
由表1可知,不同位置窖泥样品的平均pH为5.43~8.66,与报道的正常窖泥及老窖泥的pH(5~7.61)具有一定的可比性,高于一般的新窖(1年)窖泥及退化窖泥(pH<4.5)[4,9,16-18],说明本实验所取窖池与老窖及正常窖池特征相似。从空间位置分析,窖泥含水量(35.8%~45.3%)、乙醇(10.6~20.4 mg/g FPM)、总酸(3.5~5.2 mg/g FPM)及有效磷(147.3~348 mg/kg FPM)含量随窖壁深度增加基本均呈上升趋势,pH(5.4~5.9)与铵态氮含量(593.1~419.6 mg/kg FPM)变化趋势与之相反。但除了铵态氮和有效磷外,上述理化性质在窖壁不同位置的窖泥样品中不存在显著差异(P>0.05)。与窖壁泥相比,窖底泥中pH、有效磷和铵态氮含量较高,且前两者显著高于窖壁上层窖泥(P<0.05)。由于pH和有效磷与微生物群落α-多样性呈正相关[4],因此推测窖底泥原核微生物群落物种丰度及多样性均应高于窖壁上层窖泥。综上,经长期发酵,不同位置窖泥样品理化性质呈现一定的差异,这种差异可能是由不同位置窖泥与空气接触频次、与黄水接触程度、持水性差异、微生物组成差异等因素造成的[2]。

表1 窖泥样品的理化指标Table 1 Physicochemical indexes of pit mud samples
注:FPM为新鲜窖泥;a,b代表不同位置窖泥样品的理化性质存在显著性差异(P<0.05)
2.2 窖泥微生物群落α-多样性
如图1所示,当测序深度超过1万条时,稀疏曲线进入平台期。由于本研究测序深度(≥43 276条)远大于1万条且覆盖率均超过99%(表2),说明本次测序深度可覆盖样品中绝大多数微生物信息。
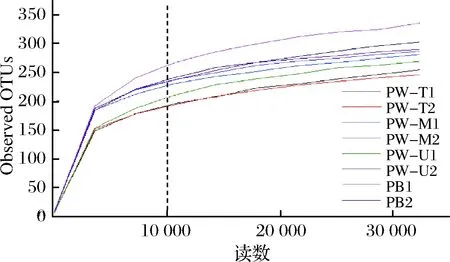
图1 基于窖泥微生物群落Observed OTUs的稀疏曲线Fig.1 Rarefaction curves of pit mud microbialcommunity based on observed OTUs
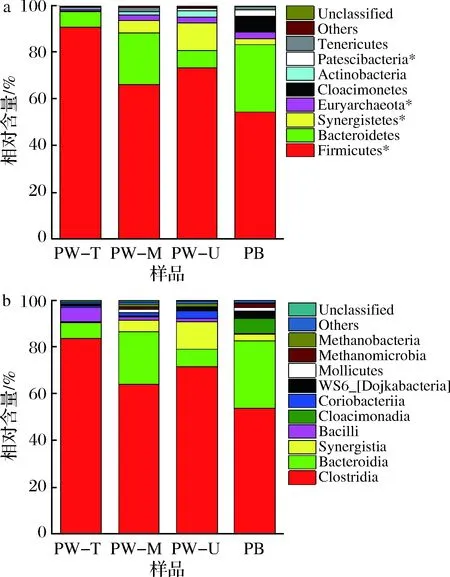
由表2可知,上层窖泥物种丰度(Chao1指数)及多样性(Shannon指数)均最低,窖底泥物种多样性最高,但其物种丰度仅高于窖壁上层窖泥,中层和下层窖泥物种丰度较高,但其物种多样性介于上层和窖底泥之间。对于窖壁泥来说,中层窖泥的物种丰度和多样性高于上层和下层窖泥。此外,窖底泥均高于窖壁上层窖泥原核微生物群落物种丰度及多样性,这也与上述理化性质分析的推测结果一致。但整体上,不同位置窖泥样品微生物群落OTU数量(249~305)、物种丰度Chao1(298.6~339.7)及物种多样性Shannon(2.98~3.69)无显著差异(P>0.05),表明正常老窖池不同位置窖泥原核微生物群落α-多样性差异不显著(P>0.05)。我们推测这种现象主要是与窖泥pH有关,由于pH是影响环境微生物群落α-多样性(Chao1、Shannon等)的主要因素,在一定的pH范围内(3 表2 窖泥样品原核微生物有效序列数、丰度及α-多样性指数Table 2 Effective sequence number, abundance and α-diversity index of prokaryotic microorganisms in pit mud samples 基于窖泥样品OTU组成的层次聚类分析(hierarchical cluster analysis,图2),将不同位置的窖泥划分为2个簇,上层窖泥单独聚为1簇(I),其他3个位置的窖泥聚为另一簇(II);第II簇又可以分为2个亚簇,下层窖泥和1个中层窖泥聚在第i亚簇,窖底泥和和另一个中层窖泥聚在第ii亚簇,表明窖池长期使用后其窖泥微生物群落呈现出明显的空间异质性,其中上层窖泥微生物群落变化程度要快于其他位置的窖泥。这可能是由于窖壁上层含水量低及有效磷含量低有关(表1),张会敏等[2]和HU等[4]研究结果表明其均能显著影响窖泥微生物群落结构。因此,进一步解析不同位置窖泥微生物群落(门、纲、属水平)组成及理化因子对其影响有助于深入揭示窖泥微生物群落的空间异质性及其形成的理化原因。 图2 不同位置窖泥样品的层次聚类分析Fig.2 Hierarchical cluster analysis of pit mudsamples in different locations 2.3.1 窖泥原核微生物门/纲水平组成 经OTU注释,所有样品中共检测到12个可鉴定门,包括11个细菌门及1个古菌门。如图3-a所示,8个优势菌门(至少在2个样品中含量均>1%的门)占每个样品总含量的98.9%~99.9%,除软壁菌门(Tenericutes,0.99%)外,其余优势菌门平均含量均大于1%。其中平均含量>2%的优势门分别为厚壁菌门(Firmicutes,71.1%)、拟杆菌门(Bacteroidetes,16.3%)、互养菌门(Synergistetes,5%)和广古菌门(Euryarchaeota,2.1%),其常以优势菌广泛存在于四川[20]、安徽[21]和江苏[4]产区的老窖泥、老熟窖泥或优质窖泥中。但本文窖泥中Euryarchaeota 的含量远低于已报道的四川、安徽和江苏产区的老窖泥或优质窖泥样品(8.7%~27.6%)[4,9,21],这可能是由窖泥的综合理化性质差异造成的,如该酒企的铵态氮或有效磷含量低于上述窖泥,其中铵态氮含量远低于上述四川(≥3.55 g/kg)和安徽窖泥(≥2.96 g/kg),而其有效磷含量明显低于上述优质窖泥(805 mg/kg),而这些理化因子含量与窖泥中Euryarchaeota含量呈极显著的正相关[4,9]。Tenericutes在近老熟的窖泥中含量较高[22],放线菌门(Actinobacteria)在老窖泥含量(50年,1.09%~7.58%)及类群(67个OTUs)均较新窖(1年和5年窖龄,0.34%~0.97%,54个OTUs)高或多[9,23]。Cloacimonetes为个别酒企老窖泥(25年)中的优势菌门。此外,Proteobacteria为新窖或退化窖泥优势菌门,在本文所用窖泥中的含量均很低(0.24%)。上述结果再次表明本文供试窖泥微生物群落组成特征与上述老窖泥相似。此外,目前Patescibacteria门在其他浓香型白酒主产区窖泥中鲜有报道,推测其可能为该酒企特有的优势菌门。 从空间分布来看,随窖池深度增加,Firmicutes呈下降趋势,其中PW-T窖泥Firmicutes(90.6%)显著高于PB(54.4%,P<0.05)。Bacteroidetes和Tenericutes门呈波动趋势,在PW-M和PB中含量较高,但无显著差异。Synergistetes和Actinobacteria呈先升后降趋势,在PW-U中含量最高,分别为11.8%和3%,并分别显著高于PW-T中的Synergistetes及PB中的Actinobacteria含量。Euryarchaeota和Patescibacteria呈上升趋势,且PW-T中Euryarchaeota显著低于其他层次的窖泥。较之于窖壁泥(0.1%~0.2%),Cloacimonetes主要存在于PB中(6.4%)。 在纲水平,共20个可鉴定纲,10个优势纲(至少在2个样品中含量均>1%的纲,图3-b)。含量超过2%的优势纲分别为梭菌纲(Clostridia,68.3%)、拟杆菌纲(Bacteroidia,16.3%)、互养菌纲(Synergistia,5%)和芽孢杆菌纲(Bacilli,2.3%),占每个样品的79.3%~97.6%,其中前2个纲是老窖泥、正常窖泥或优质窖泥中的含量较高的优势菌纲[4,9]。从空间位置来看,优势菌纲的分布情况与其对应门分布情况基本一致(图3-a和3-b),如Clostridia和Bacilli的变化规律与其对应的Firmicutes一致,呈下降趋势;Bacteroidia(属Bacteroidetes门)呈波动趋势;Synergistia(属Synergistetes门)呈先升后降趋势且在PW-U中含量最高等。 2.3.2 窖泥原核微生物属水平组成 共检测到142个属,其中上层窖泥属数量最少(92个),中层最高(120个),下层(106个)和窖底泥(110个)介于两者之间,与表2中OTU变化规律一致。Venn图显示特有属数量在中层窖泥最多(17个,占总的50%),但其在每类窖泥中的含量均很低(0.03%~0.2%,图4)。不同位置窖泥共有属数量共75个,每类样品中含量均为98%左右,表明共有属可能是老窖池窖泥中的重要微生物类群,其总含量不受空间位置影响。 a-门水平;b-纲水平图3 窖泥原核微生物门和纲水平组成Fig.3 Composition of prokaryotic microorganisms in pit mudat the level of phylum and class注:“*”表示不同位置窖泥存在显著差异(P<0.05) 图4 属水平Venn图Fig.4 Venn diagram of microbial flora at genus level 将每个样品中含量≥1%的属定义为优势属,共32个(图5),占每个样品的83.3%~93.4%,包括24个可鉴定属(71.8%)及8个未鉴定属(17.5%),表明该企业窖泥中可能蕴含着较丰富的特有微生物资源,菌群复杂[2]。优势菌属隶属于9个纲,主要集中在Clostridia(19个属,总含量为61.4%)、Bacteroidia(6个属,占16.0%),其中12个属在所有样品中的平均含量≥2%(图5中标记“**”的属),产己酸菌属(Caproiciproducens,27.3%)最高,其次为Proteiniphilum(9.9%)。Caproiciproducens是我国浓香型白酒其他主产区(四川、安徽)老窖泥或正常窖泥的优势菌属[7,16,21 ];但乳杆菌属(Lactobacillus)含量(2.3%)远低于已报道的新窖(62.3%)和退化窖泥(91.5%)[4,9],再次说明本研究供试窖池为正常老窖池。 热图进一步展示了32个窖泥优势属空间分布差异(图5),其中上层窖泥含量最高的属有10个、中层2个、下层6个和窖底14个。例如,上层窖泥中Caproiciproducens(45.6%)、氢孢菌属(Hydrogenispora,5.5%)和Lactobacillus(6.1%)平均含量最高,其中Caproiciproducens属随窖池深度增加呈逐渐下降趋势,Lactobacillus窖底泥含量最低。Fastidiosipila属含量下层>窖底>中层>上层。沉积菌属(Sedimentibacter)和互营单胞菌属(Syntrophomonas)窖底泥含量>任何窖壁泥。甲烷短杆菌(Methanobrevibacter)和氨基杆菌属(Aminobacterium)含量下层>中层>窖底>上层。发酵单胞菌属(Fermentimonas)含量中层>下层>窖底>上层窖泥,等等。 图5 基于优势属的热图分析Fig.5 Heatmap analysis based on dominant genera注:“**”表示含量≥2%的属 综上,窖泥微生物群落组成存在明显的空间异质性,整体来说75%优势属的含量在上层或窖底窖泥中最高;且相同位置窖泥之间也存在一定的差异(如2个PB样品中Proteiniphilum含量差异较大等)。与之前关于不同位置(仅选2个位置,窖壁和窖底)窖泥的研究相比[2],本研究采用高通量测序技术系统地解析了窖壁上层、中层、下层及窖底泥4个位置窖泥微生群落多样性,有助于揭示窖泥微生物群落在老窖池中的空间分布规律。同时为不同位置窖泥的定向微生物强化,以及特有窖泥微生物资源的开发提供一定的理论依据,如从富含未鉴定属(Clostridiaceae_1_Un)的PW-U中筛选新的种属。 如前所述,窖泥是一个以兼性(如Lactobacillus)和专性(如Clostridia纲中的属)厌氧微生物为主要菌群的特殊且复杂的微生态体系[1,4],且存在大量未知种属。这种原核微生物群落复杂性和多样性是窖泥菌群功能多样性和鲁棒性(指生物体抵抗外界扰动或自体内部摄动的能力)的基础。例如,Clostridia纲中Clostridiumspp.(ClusterI)能利用多种底物(简单或复杂碳源、蛋白质等)合成多种不同碳链长度脂肪酸(己酸、乙酸、丁酸和辛酸等)、醇类(己醇、丁醇和乙醇等)及CO2和H2等气体,其中己酸衍生物(己酸乙酯)是浓香型白酒主体香,该属是窖泥中较易筛选到的梭菌[8,24-26],如C.kluyveri、C.carboxidivorans、C.sporogenes和C.tyrobutyricum等。Syntrophomonas属(Clostridia:ClusterVIII)能将长链脂肪酸降解为乙酸和H2,可为氢或乙酸营养型甲烷菌提供底物[8-9]。Synergistia纲中的Aminobacterium属能发酵氨基酸,如Aminobacteriumcolombiensegen能利用多种氨基酸(甘氨酸、丝氨酸等),且与氢营养型甲烷菌共生时氨基酸底物谱扩大[27];其代谢物铵态氮可为其他微生物生长繁殖提供氮源[2]。Sedimentibacter属能将硫代硫酸盐和元素硫还原为硫化物[28]。Bacteroidia 纲中的属(如Proteiniphilum、Petrimonas和Fermentimonas等)能水解多糖、蛋白质及发酵糖类生产乙酸和丙酸等脂肪酸,是一类生物质厌氧消化的重要微生物类群[29]。此外,HU等[4]通过同现性网络分析展示出窖泥不同微生物之间存在显著正相关性,且Clostridia、Bacteroidia、Methanobacteria、Methanomicrobia及Synergistia等纲中的属为窖泥复杂菌群网络中的主要枢纽,其存在代谢关联性。WANG等[5]通过微生物溯源(Source Tracker)分析发现酒醅原核菌群的14%来源于窖泥厌氧菌,如Petrimonas、Sedimentibacter和Syntrophomonas等属。综上,窖泥中微生物主要有4大主要功能:(1)窖泥微生物的高底物多样性使其具有促进窖泥中的物质(碳源、氮源及硫元素等)循环的能力;(2)窖泥微生物群落的复杂性(多样性高)及其代谢关联性有助于增强窖泥菌群的鲁棒性及其网络结构的稳定性;(3)为发酵过程中的酒醅提供重要的厌氧微生物菌群;(4)可为浓香型白酒提供重要的呈香物质或其前体物质(己酸、丁酸、辛酸及其相应乙酯等),如Clostridia类群的代谢物。 窖泥理化因子是影响微生物群落α-及β-多样性的重要因素[4,22]。冗余分析将32个优势属大致分为4个类群(图6-a阴影区域),每个类群对应一类位置的窖泥(图6-b)。结合热图分析(图5)发现每个类群在其对应窖泥中的含量最高,例如图6-a左上阴影区域的10个属的含量均在PW-T中最高,右侧阴影区域14个属的含量均在PB中最高。窖泥因子对优势属菌群结构的总解释贡献度为71.4%(图6-a和6-b),其中Axis1轴占43.3%,可将窖壁泥和窖底泥较好地区分开;Axis2轴占28.0%能将窖壁泥(PW-T、PW-M和PW-U)区分开。但对优势属菌群结构的影响是多个理化因子的综合作用,如PB与pH、有效磷和铵态氮呈正相关,与乙醇和总酸呈负相关;PW-T与多种理化因子呈负相关,尤其是含水量和有效磷等(图6-b)。 a-优势属;b-样品图6 基于冗余分析的环境因子分别与优势属及样品关系图Fig.6 The relationship between environmental factors anddominant genera and samples based onredundancy analysis 条件限制分析(conditional term effects)揭示了每个理化因子对优势属菌群结构影响程度,其中pH(33.8%)和有效磷(20.1%)对菌群影响较大,然后依次为总酸(13.5%)>铵态氮(12.6%)>含水量(10.4%),乙醇影响最小(6.3%),且只有pH值与优势属菌群结构呈极显著相关(P<0.01),而其他因子均不显著(P>0.05)。此外,相关研究表明pH、有效磷或铵态氮与老、优质窖泥呈显著正相关,与退化窖泥呈显著负相关[4,9]。综上,pH、有效磷或铵态氮不仅是影响窖泥微生物菌群在不同窖龄和质量窖泥中分布的主要理化因子,在一定程度还影响着其在正常老窖池中的空间分布,尤其是pH。 河南作为我国浓香型白酒主产区之一,但关于其窖泥微生物群落α-及β-多样性及其窖池空间异质性研究鲜有报道。结合理化因子分析,本文对河南某浓香型白酒企业老窖池(35年)4个不同位置(窖壁上、中、下层和窖底)窖泥原核微生物群落多样性进行了解析,结果均表明供试窖池特征与老窖池相似。群落α-多样性(Chao1和Shannon)分析表明不同位置窖泥之间存在差异但不显著(P>0.05)。该酒企老窖泥中共8个优势菌门,主要为Firmicutes(71.1%)和Bacteroidetes(16.3%),并推测Patescibacteria可能为河南产区或该酒企特有的优势菌门。32个优势属隶属于9个纲,主要集中在Clostridia和Bacteroidia纲,其中Caproiciproducens属含量最高。群落β-多样性分析、层次聚类分析及Venn分析表明窖泥原核微生物群落组成具有明显的空间异质性。例如,4个菌门的含量在窖池空间分布存在显著差异且75%优势属的含量在上层或窖底窖泥中含量最高;窖泥微生物群落呈现出明显的窖池空间异质性,其中上层窖泥微生物群落变化程度要快于其他位置的窖泥;中层窖泥特有属数量(17个)最多但含量很低(0.2%)等。RDA分析显示pH和有效磷与窖泥菌群的相关性的解释度最高,表明两者可能是影响窖泥微生物群落窖池空间分布的主要理化因素。
2.3 窖泥微生物群落β-多样性分析

2.4 窖泥理化因子与微生物群落的冗余分析(redundancy analysis, RDA)
3 结论
