牛血清蛋白与邻苯二酚、间苯三酚相互作用的机理探究
2020-06-15褚千千艾健方佳琪韩秋煜包斌孙永军
褚千千,艾健,方佳琪,韩秋煜,包斌,2*,孙永军
1(上海海洋大学 食品学院,上海,201306) 2(食品科学与工程国家级实验教学示范中心(上海海洋大学),上海,201306) 3(好当家集团有限公司,山东 荣成,264305)
蛋白质不仅为人类提供了必需的营养物质,并且在食品加工中具有胶凝、乳化、起泡、水结合等多种功能性质[1-3]。一些蛋白质由于受固有结构的限制,导致其功能性质缺乏,或者由于环境条件变化、食品加工处理,功能性质也会受到负面影响[4-6]。为了改善蛋白质的功能性质,可以在含蛋白质食品中添加一些外源性成分,以更好地满足加工业的需求,例如酚类化合物、淀粉、非肌肉蛋白、转谷氨酰胺酶等[7-9]。酚类化合物由于具有抗氧化、抗糖尿病、抗肿瘤等多种生物活性[9-10],而被应用于食品、药品中。一些学者研究发现植物多酚提取物可以作为鱼糜凝胶的增强剂[10-13],改善鱼糜制品的口感和质地。PRIGENT等[14]发现原花青素可以改善球蛋白(牛血清蛋白、溶菌酶、α-乳白蛋白)的泡沫稳定性。ALU′DATT等[15]研究发现,从亚麻籽蛋白质分离物中去除游离和结合的酚类化合物降低了亚麻籽蛋白的热稳定性、持水性和黏弹性。
近年来关于酚类化合物与蛋白质相互作用的机理逐渐成为研究热点,有学者探究了氧化的单宁酸、阿魏酸、绿原酸、没食子酸等与蛋白质的共价结合[16-18],推测这些酚类化合物被氧化后可以形成相应的醌类物质,氨基酸侧链和醌之间的反应可能导致蛋白质分子聚合,从而形成复合物,进而影响蛋白质功能性质[19]。也有学者提出酚类化合物也可以与蛋白质发生非共价相互作用[20-21],徐洁琼等[22]探究了热加工处理对β-乳球蛋白与酚酸(绿原酸、咖啡酸、阿魏酸)间相互作用的影响。
前期有研究表明,褐藻多酚提取物能够提高鱼糜凝胶的破断力和凝胶强度[23],说明褐藻多酚和鱼糜蛋白质发生了反应。褐藻多酚是间苯三酚的脱氢聚合物,有时带有额外的卤素或羟基[24]。为了进一步研究褐藻多酚与蛋白质之间的反应机理,本文选择其单体酚——间苯三酚 (m-trihydroxybenzene,MP) 作为研究对象,同时选择与间苯三酚结构相近的邻苯二酚(o-dihydroxybenzene,OP) 作为比较。RAWEL等[25]提出,牛血清蛋白 (bovine serum protein,BSA)由于具有较高的分子量,并且可以与酚类化合物形成可溶性复合物,适合用于这类机理的研究。因而本文先将OP、MP进行氧化,将氧化和未氧化的OP、MP与BSA进行反应,从共价相互作用和非共价相互作用2个角度比较研究BSA与邻苯二酚、间苯三酚相互作用的机理,以期为酚类化合物在开发健康和营养食品中的应用提供依据。
1 材料与方法
1.1 试剂与设备
BSA(优级纯),上海美伦生物科技有限公司;OP、MP,均为优级纯,国药集团化学试剂有限公司;三硝基苯磺酸(trinitro-benzene-sulfonic acid, TNBS),美国Sigma公司;L-亮氨酸、NaCl、尿素、溴化钾、三羟甲基氨基甲烷(Tris)、甘氨酸(Gly)、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、NaH2PO4·2H2O、Na2HPO4·12H2O、NaHSO3,均为分析纯,国药集团化学试剂有限公司;2-硝基苯甲酸、8-苯胺-1-萘磺酸(ANS),分析纯,生工生物工程(上海)股份有限公司。
UV1102紫外分光光度计,上海谱元仪器有限公司; Synergy2多功能酶标仪,美国伯腾仪器有限公司;96孔酶标板,上海康宁有限公司;HH-4数显恒温水浴锅,深圳市超杰生物科技有限公司;真空冷冻干燥机、NICOLET iS5傅里叶变换红外光谱(fourier transform infrared spectroscopy, FTIR),美国Thermo公司;高速冷冻离心机,上海卢湘仪离心机仪器有限公司;Chirascan圆二色谱(circular dichroism, CD),英国Leatherhead公司;差示扫描量热仪 (differential scanning calorimeter, DSC),美国TA仪器。
1.2 实验方法
1.2.1 酚类化合物-蛋白质复合物的制备
参考RAWEL等[26]的方法制备酚类化合物-蛋白质复合物,略有改动。
氧化邻苯二酚-牛血清蛋白 (OOP-BSA)、氧化间苯三酚-牛血清蛋白 (OMP-BSA) 复合物的制备:将10 g/L的邻苯二酚、间苯三酚水溶液用NaOH调pH为9,暴露于空气中在 25 ℃的条件下连续搅拌氧化24 h。分别取2 mL氧化的邻苯二酚、间苯三酚水溶液加入到20 mL 1 mg/mL的BSA水溶液中,反应2 h。
邻苯二酚-牛血清蛋白(OP-BSA)、间苯三酚-牛血清蛋白(MP-BSA) 复合物的制备:分别取2 mL 10 g/L的邻苯二酚、间苯三酚水溶液加入到20 mL 1 mg/mL的BSA水溶液中,加入液体石蜡液封以隔绝氧气,反应2 h。
对照组:取2 mL 超纯水加入到20 mL 1 mg/mL的BSA水溶液中。
将上述反应后的复合物及对照组透析24 h,每隔4 h换一次水,以除去未反应的酚类化合物。取一部分透析液进行真空冷冻干燥,备用。剩下的透析液用做液体样品。
1.2.2 游离氨基含量的测定
参照CROWELL[27]采用TNBS的方法测定样品中游离氨基含量的变化,略有改动。取待测溶液125 μL,加入1 mL pH 8.2的磷酸缓冲溶液及1 mL 1 g/L TNBS,将混合好的样品置于50 ℃的暗处摇匀1 h。将样品取出后加入2 mL 0.1 mol/L的NaHSO3,至于暗处,30 min后于420 nm下测吸光值。以0.1~0.5 mmol/L 浓度的L-亮氨酸作标准曲线来定量游离氨基含量。
1.2.3 巯基含量的测定
参照BEVERIDGE等[28]的方法,准确称取0.4 g DTNB于100 mL Tirs-Gly缓冲溶液 (每升溶液含10.4 g Tirs,6.9 g Gly,1.2 g EDTA,pH 8) 中,配制成4 mg/mL的Ellman’s试剂。取0.5 mL样品加入2 mL 8 mol/L尿素 (溶于Tirs-Gly缓冲溶液) 及40 μL Ellman’s试剂,在室温下放置1 h后于412 nm处测吸光度,巯基的计算如公式(1)所示:
(1)
式中:S,疏基含量,μmol/g;73.53来自106/(1.36×104),106表示从摩尔基础到μmol/mL基础以及从mg固体到g固体的转化率,1.36×104是摩尔吸光系数,L/(mol·cm);D,稀释倍数;ρ,蛋白质量浓度,mg/mL。
1.2.4 OP、MP与BSA非共价相互作用力的测定
离子键的含量以溶解于A、B溶液中蛋白质含量之差来表示;氢键以溶解于B、C溶液中蛋白质的含量之差来表示;疏水性相互作用以溶解于C、D溶液中蛋白质的含量之差来表示。
1.2.5 表面疏水性的测定
参照文献[30]的方法,略有改动。以ANS试剂为荧光探针,将样品用磷酸缓冲液 (0.01 mol/L,pH 7.0) 稀释为5个蛋白终浓度 (0.1、0.2、0.3、0.4 和 0.5 mg/mL)。取2 mL上述稀释液加入40 μL 8 mmol/L ANS溶液,室温下放置15 min。用 Synergy 2多功能酶标仪在激发光波长360 nm、发射光波长460 nm下测定样品的荧光强度。同时,分别以相同浓度的邻苯二酚、间苯三酚溶液作为试剂空白。最后,以荧光强度对BSA浓度作图进行线性分析,所得曲线斜率即为该样品的蛋白质表面疏水性。
1.2.6 酚类化合物-蛋白质复合物构象的表征
1.2.6.1 傅里叶变换红外光谱分析
采用溴化钾压片法进行FTIR分析。分别取冻干后的对照组样品和复合物1 mg加入适量的KBr,用玛瑙研钵研磨成均匀细粉状,压片。扫描条件:波数范围4 000~650 cm-1,次数16 次,分辨率为4 cm-1。采用KBr做空白对照,每个样品在相同条件下重复3次取平均值。
使用OMNIC 9软件, 对样品谱图进行修整校正。剪切蛋白质酰胺Ⅰ带 (1 600~1 700 cm-1) 的数据在Peakfit 4.12软件中进行基线校正,去卷积,采用Gausse函数进行二阶导数拟合,直至拟合相关系数R2≥0.99, 且稳定不再变化, 确定各子峰与各二级结构的对应关系, 计算各子峰面积的相对百分含量。
1.2.6.2 圆二色谱分析
通过圆二色谱仪对酚类化合物-蛋白质复合物中蛋白质的二级结构进行分析。测定在室温且持续通氮气的条件下进行,扫描速度100 nm/min,带宽1.0 nm,路径长度0.5 mm。将样品浓度稀释到0.1 mg/mL,在190~260 nm范围内进行测定,平均测定3次。
1.2.6.3 变性温度分析
采用差式扫描量热法,参考曹艳芸[31]的方法,称取 5 mg 左右冻干的对照组样品和复合物,置于铝制坩埚中。加热温度范围为20~120 ℃,升温速率为10 ℃/min。空样品坩埚作为空白对照。用 Universal analysis分析软件 (TA公司) 计算样品在升温过程中的最大转变温度。
1.2.7 统计与分析
本文实验所有样品均为3组平行。作图采用OriginPro 9.1软件,采用SPSS statistic 22.0进行显著性分析。
2 结果与讨论
2.1 邻苯二酚和间苯三酚对BSA游离氨基和巯基的影响
BSA与酚类化合物反应前后游离氨基和巯基含量如表1所示。与对照相比,OOP-BSA、OMP-BSA复合物中游离氨基和巯基的含量均显著降低(P<0.05),并且OOP-BSA的降低量大于OMP-BSA。说明氧化的邻苯二酚、间苯三酚与牛血清蛋白的游离氨基、巯基发生共价反应,而且该反应与酚羟基的反应活性有关。OP由于其羟基取代的高反应性,很容易被氧化,在O2存在的碱性条件下即可进行自动氧化[32]。OP被氧化成相应的邻苯二醌,醌是一种反应性亲电子中间体,可能会和BSA氨基酸侧链中的游离氨基、巯基发生反应,形成C—N或C—S共价键。氨基酸侧链和醌之间的反应会导致蛋白质分子的聚合,从而形成复合物[33]。但是对于间苯三酚来说,MP不能被氧化成相应的醌,而是形成了半醌自由基[34],半醌自由基可以攻击亲核反应配偶体,从而和BSA的游离氨基、巯基反应,形成复合物。半醌自由基的反应活性低于醌,因而导致OOP-BSA复合物游离氨基和巯基较BSA的降低量大于OMP-BSA复合物。RAWEL等[35]比较了邻苯二酚、间苯二酚与溶菌酶的共价反应活性,结果显示邻苯二酚的反应活性更高。对于未氧化的邻苯二酚和间苯三酚而言,OP-BSA、MP-BSA复合物中游离氨基和巯基的含量较对照均没有显著性变化(P<0.05),进一步说明了酚类化合物只有在被氧化形成醌或半醌自由基后才能与蛋白质发生共价反应。

表1 BSA及其复合物的游离氨基与巯基含量(n=3)Table 1 Free amino and sulfhydryl content of BSA andits complexes
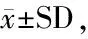
2.2 邻苯二酚、间苯三酚与BSA之间的非共价相互作用力分析
KANG等[36]提出绿原酸和阿魏酸与人血清蛋白的非共价相互作用主要包括芳香环与疏水氨基酸残基之间的疏水力,羧酸盐基团与碱性氨基酸残基之间的静电力以及羟基与多肽链之间的氢键。鉴于未氧化的OP、MP不能和BSA发生共价相互作用,因而对OP、MP和BSA之间的非共价相互作用进行探究 (图1)。酚类化合物和蛋白质之间的非共价相互作用包括5种类型:氢键,疏水相互作用,静电相互作用,范德华力和离子键[37]。其中氢键和疏水相互作用被认为是酚类化合物和蛋白质之间相互作用的主要驱动力[38]。从图1可见,和对照相比,OP-BSA、MP-BSA离子键没有显著变化(P<0.05),说明OP、MP未与BSA形成新的离子键。氢键含量显著升高(P<0.05),并且MP-BSA的增加量大于OP-BSA。因为酚基团是一种优良的氢供体,很容易与蛋白质的羧基形成氢键,从而导致OP-BSA、MP-BSA复合物中氢键含量升高,并且间苯三酚的羟基数量大于邻苯二酚,因而与BSA形成更多的氢键。OP-BSA的疏水相互作用较对照显著提高(P<0.05),而MP-BSA的疏水相互作用显著下降。酚类化合物中的芳基和BSA分子内部的疏水性基团发生聚集,降低了其结合水的能力,疏水相互作用增强[39],而MP由于含有较多的羟基,羟基是一种亲水性基团,羟基的亲水性可能会阻碍芳基和BSA疏水性基团的聚集,也可能是氢键成为了MP和BSA之间相互作用的主要驱动力,因而导致MP-BSA中疏水相互作用降低。

图1 邻苯二酚、间苯三酚与BSA的非共价相互作用Fig.1 Effect of OP and MP on the interaction force of BSA注:上标不同字母表示显著性差异(P<0.05)(下同)
2.3 邻苯二酚、间苯三酚对BSA表面疏水性的影响
蛋白质的表面疏水性变化可以反映蛋白质与水、其他化学物质产生作用时的实际情况[40]。氧化与未氧化的邻苯二酚、间苯三酚对BSA表面疏水性的影响如图2所示,与对照相比,OP、MP、OOP、OMP的引入都会使BSA的表面疏水性显著降低 (P<0.05),这说明酚类化合物与BSA的疏水性氨基酸发生了反应。RAWEL等[41]讨论了氧化邻苯二酚在色氨酸的杂环N-原子上发生反应的可能性,证实了酚类化合物被氧化成醌后和蛋白质色氨酸发生了共价反应,导致蛋白质表面疏水性降低。而未氧化的酚类化合物的氢原子也很容易和色氨酸的氮原子形成分子间氢键,发生非共价相互作用。图2显示OOP-BSA、OMP-BSA复合物的表面疏水性显著低于OP-BSA、MP-BSA复合物,说明相较非共价反应,蛋白质如果与酚类化合物发生共价反应,会对蛋白质的表面疏水性产生更大的影响。另一方面,OP-BSA、OOP-BSA复合物表面疏水性显著低于MP-BSA、OMP-BSA复合物,说明邻苯二酚对蛋白质表面疏水性的影响大于间苯三酚。

图2 邻苯二酚、间苯三酚对BSA表面疏水性的影响Fig.2 Effect of OP and MP on the surfacehydrophobicity of BSA
2.4 邻苯二酚、间苯三酚对BSA二级结构的影响
2.4.1 傅里叶变换红外光谱分析


图3 邻苯二酚、间苯三酚与BSA相互作用的红外光谱图Fig.3 Infrared spectrum of interaction between OP,MP and BSA
与BSA比较,4种复合物在酰胺I和酰胺II带也发生了位移,说明BSA与邻苯二酚、间苯三酚的相互作用伴随着蛋白质二级结构的变化。对酰胺I (1 600~1 700 cm-1) 的光谱进行高斯拟合,得到二级结构含量,如表2所示。OP-BSA、OOP-BSA、MP-BSA、OMP-BSA复合物中α-螺旋含量分别降低15.40%、15.60%、16.00%、16.00%, β-折叠分别上升25.60%、28.90%、18.20%、14.00%,β-转角分别上升7.10%、5.90%、7.70%、17.20%,无规则卷曲分别上升5.10%、5.60%、1.20%、3.40%。表明引入氧化和未氧化的OP、MP都会破坏BSA的二级结构,并且OP、OOP对BSA二级结构的影响大于MP、OMP,这与邻苯二酚对BSA一级结构有更大影响相对应。蛋白质中的α-螺旋、β-折叠结构是靠氢键来稳定的,酚类化合物的加入造成蛋白分子内部的氢键发生改变,从而导致BSA二级结构的变化。RAWEL等[25]在探究绿原酸共价结合诱导牛血清白蛋白的结构变化时发现,绿原酸和BSA的反应导致BSA α-螺旋减少,而其余结构增加。JIANG等[43]在研究乳清蛋白分离物(whey protein isolates, WPI) 和酪蛋白(casein, CS) 与绿原酸非共价相互结合时,发现WPI、CS红外光谱图中酰胺I和酰胺II的移动,并且α-螺旋含量减少,β-折叠含量增加。这些结果与本研究结果一致。
表2 基于FTIR的BSA及其复合物二级结构分析 单位:%
2.4.2 圆二色谱分析
圆二色谱是研究蛋白质构象的一种常用方法,在近紫外区,蛋白质的圆二色性主要由侧链基团所贡献,主要用来分析蛋白质二级结构的变化。酚类化合物与BSA结合前后的结构变化如图4所示。BSA处于天然状态时圆二色谱线在190 nm左右为正峰,205~235 nm时为负槽。在209和222 nm左右呈现出2个负槽,称为双负槽曲线,代表BSA的α-螺旋结构;在215 nm左右的负槽代表β-折叠结构。当BSA与酚类化合物反应后,CD峰强度发生改变,图谱出现轻微的蓝移现象,表明氧化与未氧化的OP、MP与BSA的反应改变了蛋白质的二级结构。

图4 邻苯二酚、间苯三酚与BSA相互作用的近紫外圆二色谱图Fig.4 Near-UV circular dichroism of interaction betweenOP, MP and BSA
采用Dichroweb程序对BSA及BSA复合物的二级结构的百分含量进行了估算,结果如表3所示,CD结果与红外结果一致。与BSA相比,4种BSA复合物的α-螺旋含量降低,而其余结构增加。CD结果在数值上与FTIR的结果存在一些差异,这可能由于样品不同所致,红外光谱测定的样品为冻干样,而远紫外CD色谱测定的样品为水溶液。

表3 基于CD的BSA及其复合物二级结构分析 单位:%
2.5 邻苯二酚、间苯三酚对BSA变性温度的影响
DSC是测定蛋白质变性温度的一种常用手段,进而反映出蛋白质构象的变化。MOSTAFA等[44]在研究咖啡酸和乳清蛋白相互作用时发现,绿原酸在碱性条件下修饰乳清蛋白会提高蛋白的热稳定性。本文所研究的BSA变性温度为86 ℃,如图5所示,与酚类化合物反应后,OOP-BSA、OP-BSA、OMP-BSA、MP-BSA的Tmax分别为90、89、87、90 ℃,均有所升高。
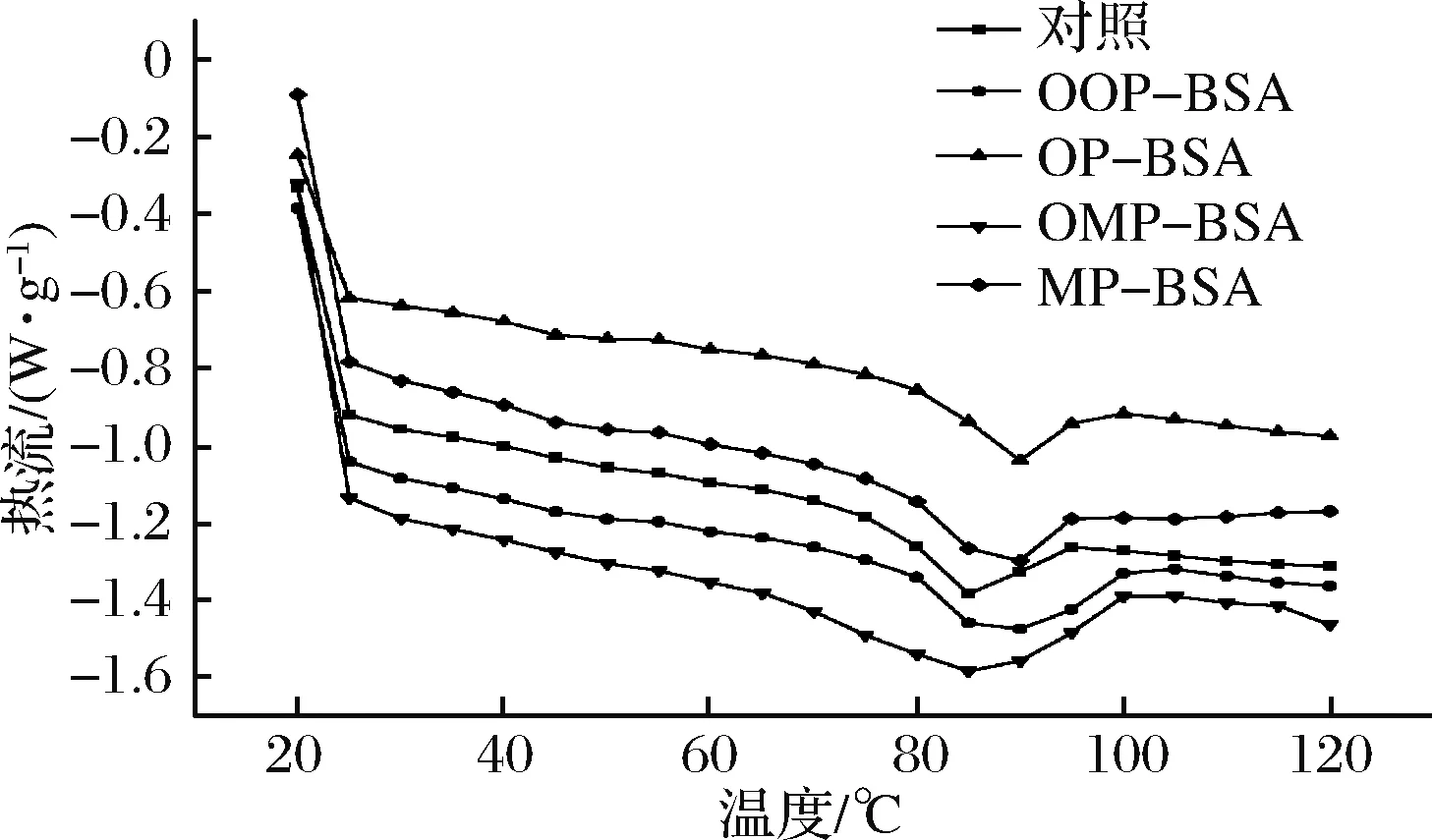
图5 BSA及其复合物的差式扫描图Fig.5 Differential scan of BSA and its complexes
热变性温度与蛋白质的二级结构密切相关,蛋白质二级结构的β-折叠比α-螺旋的疏水性更强,因此β-折叠含量更高的蛋白质的热变性温度更高[37]。因此当邻苯二酚、间苯三酚与蛋白质相互作用使β-折叠增加时,会导致变性温度升高。根据FTIR分析结果,OMP-BSA 复合物β-折叠含量增加幅度最低,因此其变性温度的变化幅度最小。并且OP、MP的引入使BSA无规则卷曲含量升高,说明BSA的有序相结构含量减少,无序结构增加,这也可能导致BSA变性温度升高[44]。
3 结论
邻苯二酚、间苯三酚与BSA既能发生共价相互作用也能发生非共价相互作用。共价相互作用是蛋白质氨基酸侧链和醌之间的反应,非共价相互作用主要是氢键和疏水相互作用,导致BSA表面疏水性降低。这些反应使BSA的构象发生显著变化,主要是二级结构改变 (α-螺旋含量降低,β-折叠、β-转角和无规则卷曲含量増加)、热变性温度升高。这些结果对于进一步研究褐藻多酚与蛋白质相互作用的机理提供了依据。
