KLF9 基因腺病毒载体的构建及其脂肪酸氧化功能
2020-06-15黄金灿张磊常永生
黄金灿,张磊,常永生
(天津医科大学基础医学院生理与病理生理学系,天津300070)
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是一种常见的代谢紊乱疾病,随着饮食结构、生活习惯的改变,患病率正呈现快速增高的趋势。其主要特征为循环中葡萄糖、脂质和炎症因子的增加,脂肪酸氧化异常等,脂肪酸氧化的减少,使得细胞内的脂质积累,严重时会导致肝脏脂肪变性[1]。
Krüppel 样转录因子 9(KLF9)属于 KLFs 家族中的一员,又称基础转录元件结合蛋白1(basic transc ription element-binding protein-1, BTEB1),是一种锌指蛋白,初期是从大鼠肝脏cDNA 文库中克隆获得,参与调节真核细胞的基因转录[2]。其中KLF9 在肾、肺、肝脏、脑、胸腺、睾丸及脾脏中均有表达,但是其表达量在脑组织中相对较高[3-5]。KLF9 与C/EBPα直接相互作用并结合到过氧化物酶体增殖物活化受体PPAR-γ 的启动子激活元件上促进其转录,从而调节脂肪细胞的发育分化[6]。在肝癌细胞系HepG2 细胞中,KLF9 通过激活 PPAR-γ 的表达,促进脂合成,从而导致脂滴的异位储存影响脂肪变性[7]。有最新研究报道,地塞米松可促进KLF9 表达,增加肝脏糖异生,最终导致高血糖现象[8]。但是有关KLF9 在脂肪酸氧化的研究鲜有文章报道。本研究通过构建及验证KLF9 基因过表达的腺病毒,进一步在肝原代细胞和小鼠体内过表达KLF9,初步探究KLF9 在肝脏脂肪酸氧化方面的功能。
1 材料与方法
1.1 材料 KLF9 扩增序列引物(TSINGKE),扩增序列:5′-TTGGCGCGCC AAGCCACCATGTCCGCGGCC GCCTACAT-3′(正向);5′-CGACGCGTCGTCACTTGTC ATCGTCATCCTTGTAGTCGATGTCATGATCTTTATA ATCACCGTCATGGTCTTTGTAGTCCAAGGGGCTGG CAAGAGCCT-3′(反向);两端分别添加 PmeI 和PacI 酶切位点,C 端加 3×Flag 标签。PmeI 和 PacI 酶、primer star DNA 聚合酶、T4 DNA 连接酶、dNTPs(Takara 公司);T-easy 质粒、实时定量 PCR MIX、Trizol(Invitrogen);细胞培养基DMEM 和胎牛血清(Sigma),Lipofectamine2000。pAdTrack-CMV,pAd-Track-U6,E.coli.BJ5183,DH5α 感受态细菌,HepG2细胞系,PPAR-γ 协同刺激因子PGC 1-α 启动子以及人胚肾细胞系 293A 由本实验室保存。pGL3-Basic,pRL-TK 载体购自Promega 公司,pcDNA3.1 购自 Invitrogen 公司,Dual-Luciferase Reporter Assay system(Promega);逆转录试剂盒(ABI 公司);青霉素、链霉素、胰酶(Solarbio);明胶和胶原酶(Sigma公司)。anti-KLF9 抗体(abcam,ab227920),anti-PGC1-α 抗体(abcam,ab54481),anti-flag 抗体(Sigma,F7425)。雄性,6 周龄,体质量 22~25g 的 12 只 C57BL/6J 小鼠购自北京斯贝福生物技术有限公司,小鼠饲养和管理按照天津医科大学动物饲养标准执行。
1.2 KLF9 腺病毒的构建
1.2.1 KLF9 重组质粒的构建及腺病毒包装 将测序正确的连接在T-easy 质粒上KLF9 酶切下来,定向连入穿梭载体pAdTrack-CMV 后提质粒。取8 μg质粒,经PmeI 酶切7 h 充分线性化,用酚/氯仿抽提,乙醇沉淀后溶于 20 μL 去离子水中。取100~500 ng 酶切质粒,转化到E.coli.BJ5183 感受态细菌。以200 μL LB 培养基重悬细菌,涂于卡那霉素抗性的LB 平板,置于37℃孵箱内培养15~20 h。挑克隆,置于5 mL 有卡那霉素抗性的LB 培养基,37℃摇床过夜后提质粒,通过PacI 酶切可得3.0 和4.5 kb两条带,即为阳性克隆。将阳性克隆的质粒转化到大肠杆菌DH5α,涂板挑菌培养提取质粒。取14 μg所得的重组质粒用PacI 酶切7~9 h,经酚/氯仿抽提,溶于20 μL 去离子水。将重组质粒以转染密度50%~80%接种于10 cm 培养皿的293A 细胞中,孵箱中培养10~15 d,不用换培养基,隔天补500 μL DMEM 完全培养基。一般转染5~7 d 后可以通过荧光显微镜观察到GFP 斑。
1.2.2 KLF9 腺病毒的扩增 将构建好的KLF9 腺病毒转染进293A 细胞,48 h 后将细胞收到50 mL离心管中。离心去上清后,在液氮和37℃反复冻融4次,4℃12 000 r/min 离心,收集上清,即病毒裂解液。第2 轮扩增,加病毒裂解液到6 个15 cm 培养皿(接种293A 细胞,汇合度90%),细胞全部呈绿色且30%~50%细胞悬浮时,收集细胞,离心去上清,在液氮和37℃反复冻融4 次,收集病毒裂解液。第3 轮扩增,步骤同第2 轮扩增。
1.2.3 KLF9 腺病毒的纯化 先在50 mL 离心管中缓慢加入1.4 g/mL 氯化铯8 mL,再缓慢加入1.2 g/mL氯化铯6 mL,在不连续梯度顶部加入20 mL DMEM 5%病毒保存液。4℃,100 000×g,离心 90 min。抽吸病毒带至无菌15 mL 离心管中,加入1×TE 把溶液浓度降低到1.2 g/mL 以下。用连续密度发生器将12 mL 1.4 g/mL 和14 mL 1.29 g/mL 氯化铯连续密度梯度加入,在密度梯度顶部加入8~10 mL 上述稀释的病毒悬液,4 ℃,100 000×g离心 16~20 h。抽吸蓝白色病毒带透析后,即为纯化的腺病毒,可用于下一步尾静脉注射老鼠。
1.3 细胞实验
1.3.1 腺病毒感染细胞及Trizol 法提取RNA 用经典的灌流-胶原酶消化法获得小鼠肝脏原代细胞,铺至 6 孔板中,用 1640(10%的血清,100 U/mL青霉素和0.1 mg/mL 链霉素)培养,感染病毒前换新鲜的培养基。每个孔加120 pfu 的病毒。采用含10%FBS 的DMEM 培养基培养293A 细胞,培养基中添加100 U/mL 青霉素和0.1 mg/mL 链霉素,细胞在37℃、5%CO2的孵箱中培养,实验时取对数生长期细胞。感染病毒前换新鲜的培养基。每个孔加120 pfu的病毒,Trizol 法提取293A 细胞和肝脏原代细胞总RNA,超微量分光光度计定量,取 2 μg 总 RNA,加入Random primer 用Thermofisher 逆转录酶逆转录成cDNA。以100ngcDNA 为模板,在罗氏LightCycler96仪器上进行扩增反应,条件为:95℃10 min、95℃30 s、55℃ 30 s、72℃ 30 s(捕捉荧光值),循环 55 次,并作熔解曲线。各基因的Q-PCR 引物序列见表1。样本结果以目的基因与36B4 的比值做相对定量分析,数据分析采用比较CT 法,重复样本(n=3)取平均值。
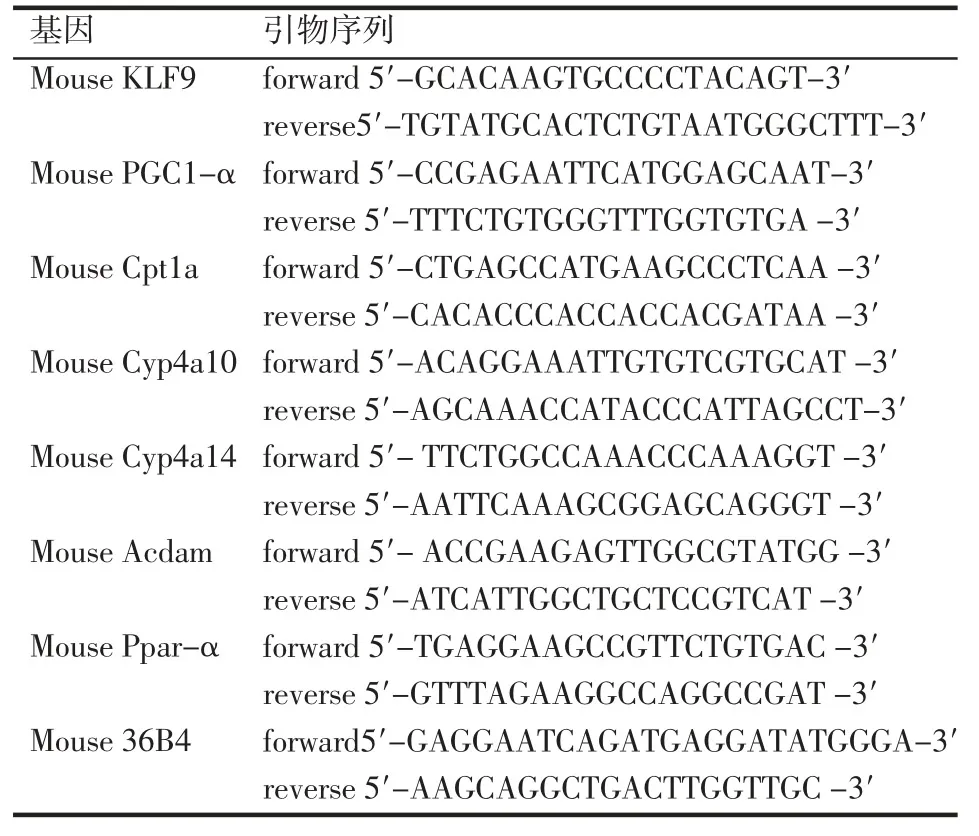
表1 实时荧光定量PCR 的引物序列Tab 1 The primer sequence of real-time quantitative PCR
1.3.2 双荧光素酶报告试剂盒测定PGC1-α 基因启动子活性 将HepG2 细胞接种至24 孔板,待细胞达到80%融合时进行转染。用50 μL 无血清DMEM分别稀释3.2 μL 转染试剂Lipofectamine2000(1 mg/mL)和 0.8 μg 质粒(表达质粒:报告质粒:TK 质粒=30:30:1),轻轻混匀后室温静置5 min,其中质粒(μg):Lipofectamine 2000(μL)=1:4 将稀释后的转染试剂逐滴加入DNA 混悬液中室温静置15 min。将DNA 和转染试剂的混悬液逐滴加入24 孔板细胞中,混匀后放回细胞培养箱继续培养。转染48 h 后弃去培养基,用 100 μL 1×passive lysis buffer 裂解细胞20 min,取10 μL 转移至96 孔荧光检测板中。将荧光素酶底物反应液混匀备用。按照Promega 公司的双荧光素酶报告试剂盒说明,在荧光检测仪Turner Modulus 上对每孔细胞Firefly 和Renilla 荧光素酶活性进行检测。
1.3.3 ChIP 实验 通过经典的灌流-胶原酶消化法获得小鼠肝原代细胞并在室温下用1%甲醛处理10min,然后用ChIP 细胞裂解缓冲液(10 mmol/L pH 8.0 的Tris-HCl,10 mmol/L NaCl,3 mmol/L MgCl2,0.5%NP-40 和蛋白酶抑制剂混合物)和ChIP 核裂解缓冲液(50 mmol/L Tris-HCl,pH 8.05 mmol/L EDTA,1%SDS和蛋白酶抑制剂混合物)处理细胞。通过超声处理细胞裂解液以剪切染色质,并用对KLF9 特异的抗体和非特异性IgG 进行免疫沉淀。使用蛋白A/G-琼脂糖珠(Invitrogen)分离免疫沉淀物,将其洗涤,并用0.1%NaHCO3洗脱。在65℃孵育过夜并使用蛋白酶K 解交联后,通过酚氯仿抽提免疫沉淀DNA 片段和Input 的DNA 片段。纯化的DNA 用于扩增小鼠PGC1-α 启动子。PGC1-α 的引物设计见表2。

表2 ChIP 的引物序列Tab 2 The primer sequence of ChIP
1.4 小鼠分组和处理 从北京斯贝福生物科技有限公司购买C57BL/6J 小鼠12 只,随机选择6 只小鼠用脂肪含量10%普通饲料适应性喂养7 d,另外6只用脂肪含量60%高脂饲料喂养90 d,小鼠自由饮食饮水,饲养在温度(22±2)℃、湿度(55±10)%、12 h 照明/非照明循环房间。将普通饲料喂养的小鼠随机分为2 组:(1)对照组3 只:尾静脉注射纯化过的腺病毒空载体(Ad-GFP),注射量为 100 μL/只;(2)实验组3 只:尾静脉注射纯化过的Ad-KLF9,注射量为100 μL/只。腺病毒注射10 d 后处死小鼠,取肝脏组织,提取组织总蛋白和RNA,检测KLF9、PGC1-α、Cpt1a、Cyp4a10、Cyp4a14、Acdam、PPAR-α以及内参基因36B4。高脂饮食小鼠的处理同上。
1.5 Western blot 蛋白样品以SDS-PAGE(分离胶浓度为10%)分离;电泳结束后将凝胶中的蛋白样品电转至PVDF 膜上,电转2 h,5%牛奶室温封闭PVDF 膜 1 h;PVDF 膜置于一抗溶液中,4℃摇床过夜;TBST 洗 PVDF 膜 3 次,每次 15 min;PVDF 膜与辣根过氧化物酶标记的二抗(用TBST 配制的5%牛奶以 1∶5 000 稀释) 室温作用 1 h;TBST 洗 PVDF 膜5 次,每次10 min;将ECL 化学发光试剂A 液和 B液以1∶1 的比例混匀,滴加在PVDF 膜上,室温反应3 min 后在化学发光凝胶成像仪中曝光。
1.6 统计学方法 采用GraphPad Prism8 统计软件进行统计学分析,实验数据均以表示,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 Ad-KLF9 在293A 细胞中过表达 使用融合表达3×Flag 的 KLF9 过表达腺病毒转染 293A 细胞,48 h 后通过荧光显微镜可见明显的绿色荧光,感染效率达90%以上(图1A)。收集细胞并提取总细胞蛋白和RNA,通过Western 印迹检测后,发现在分子量35 KD 处有一条特异性的条带,而感染Ad-GFP 的对照组则没有条带(图1B)。通过Q-PCR 检测,发现与感染Ad-GFP 组相比,感染Ad-KLF9 组293A 细胞中 KLF9 的表达量上调约 20 倍(图1C,1D)。
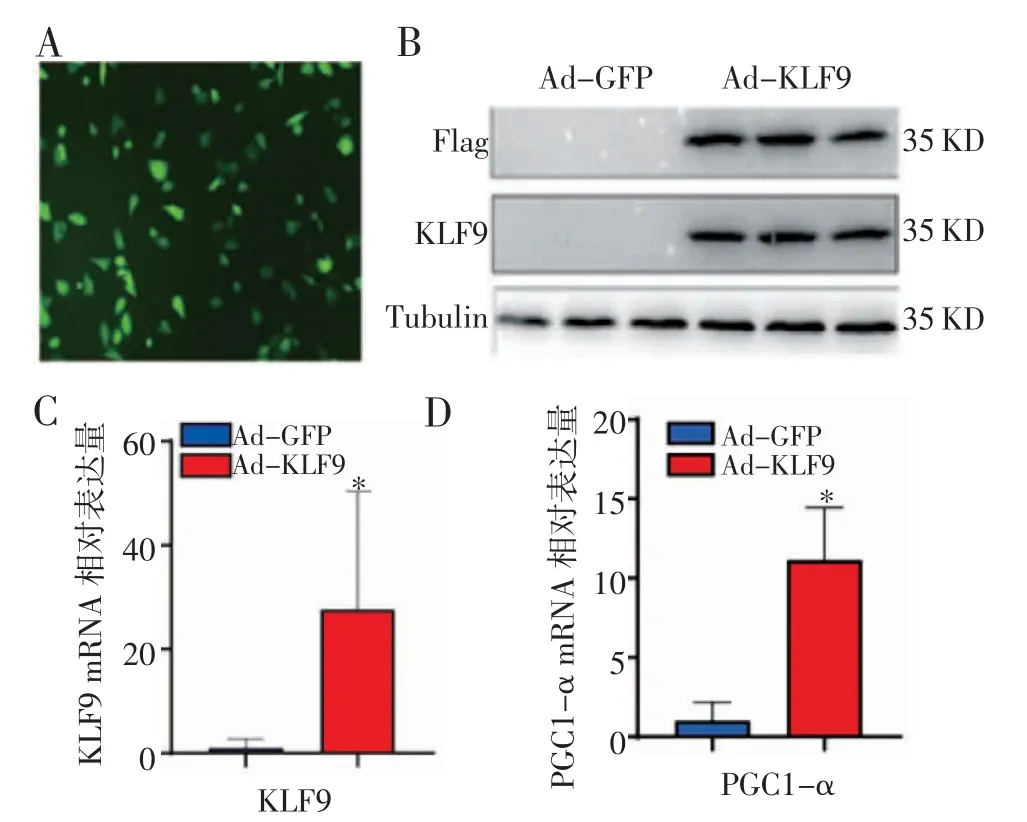
图1 KLF9 基因腺病毒载体的包装验证Fig 1 The identification of KLF9 adenoviral vector
2.2 KLF9 直接调控PGC1-α 的转录 通过荧光素酶报告基因实验发现,PGC1-α 上存在KLF9 能够结合的顺式作用元件,ChIP-Q-PCR 实验进一步证明KLF9 能够直接结合到PGC1-α 的启动子上,促进 PGC1-α 基因的表达(图2)。
2.3 Ad-KLF9 促进小鼠肝原代细胞中脂肪酸氧化相关基因的表达 用经典的灌流-胶原酶消化法获取成活率为90%以上的C57BL/6J 小鼠肝原代细胞,铺至6 孔板中,分别感染Ad-GFP 和Ad-KLF9,48 h后提取细胞总蛋白和RNA。通过Western blot 检测,发现感染Ad-KLF9 与感染Ad-GFP 的肝原代细胞相比,在分子量100 KD 和35 KD 处,靶基因PGC1-α和KLF9 蛋白表达增强(图3A)。经Q-PCR 检测,发现脂肪酸氧化的基因表达(Cpt1a,Cyp4a10,Cyp4a14,Acdam,PPAR-α)呈上调趋势(图3B,3C)。
2.4 KLF9 促进小鼠肝脏中脂肪酸氧化相关基因的表达 将纯化过的Ad-GFP 和Ad-KLF9 分别通过尾静脉注射到老鼠体内,10 d 后,取肝脏组织,提取组织总蛋白和RNA。通过Western blot 检测,与注射Ad-GFP 相比,注射Ad-KLF9 的小鼠肝脏中,在分子量分别为 100 KD 与 35 KD 处,PGC1-α 和KLF9表达增强(图4A)。经Q-PCR 检测,KLF9 以及促进脂肪酸氧化相关基因(Cpt1a,Cyp4a10,Cyp4a14,Acdam,PPAR-α)的表达均明显上调(图4B,4C)。
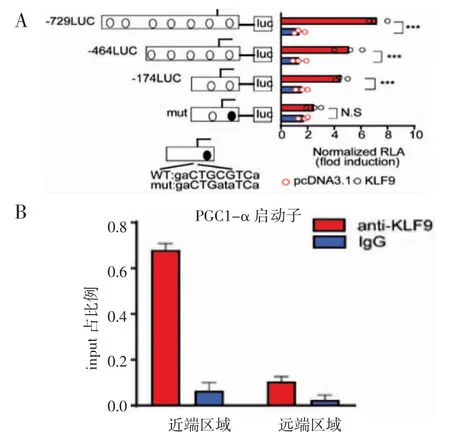
图2 KLF9 促进 PGC1-α 的表达Fig 2 KLF9 promotes expression of PGC1-α
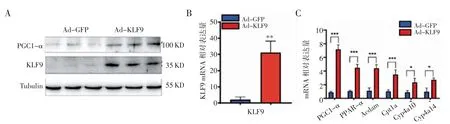
图3 KLF9 上调小鼠肝原代细胞脂肪酸氧化相关基因的表达Fig 3 The expression of fatty acid oxidation genes in mouse primary hepatocytes infected with Ad-GFP and Ad-KLF9
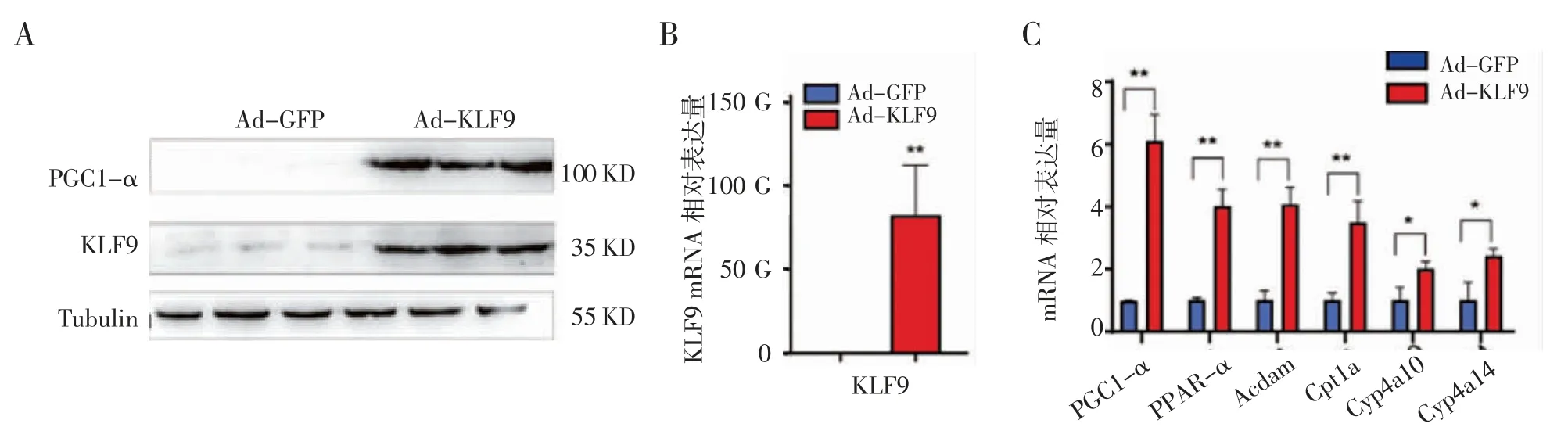
图4 KLF9 上调小鼠肝脏组织中脂肪酸氧化相关基因的表达Fig 4 The expression of fatty acid oxidation genes in mouse liver injected with Ad-GFP and Ad-KLF9 via the tail vein
2.5 KLF9 改善高脂小鼠非酒精性脂肪肝 将纯化的Ad-GFP 和Ad-KLF9 分别通过尾静脉注射到高脂小鼠体内,10 d 后,取肝脏组织做HE 染色和油红O 染色,同时提取组织总蛋白和RNA。通过HE 和油红O 染色,可以观察到注射Ad-KLF9 的高脂小鼠肝脏脂滴形态变小,数量明显减少,肝脏中脂肪堆积明显得到改善(图5A)。通过Western blot 和Q-PCR检测,发现与注射Ad-GFP 相比,注射Ad-KLF9 的高脂小鼠肝脏中,脂肪酸氧化相关基因(Cpt1a,Cyp4a10,Cyp4a14,Acdam,PPAR-α)表达明显上调(图 5B,5C,5D)。由此说明KLF9 可以促进脂肪酸氧化相关基因的表达,改善高脂小鼠脂肪肝。
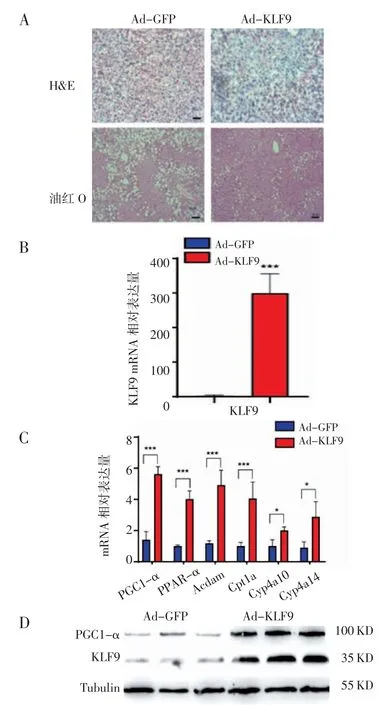
图5 KLF9 上调高脂小鼠肝脏组织中脂肪酸氧化相关基因的表达Fig 5 The expression of fatty acid oxidation genes in liver of highfat mice increased by KLF9
3 讨论
NAFLD 是世界范围内越来越常见的肝功能障碍疾病,影响着全球30%的人群,对人类健康产生巨大的威胁。其是肝脏脂质堆积引发的肝细胞损伤、炎症和纤维化,从而导致更严重的肝脏疾病,如肝硬化以及肝细胞癌等[9-10]。研究表明肥胖和2 型糖尿病都与NAFLD 密切相关[11]。肝脏作为机体内主要代谢器官,可以调节脂质代谢,包括脂肪酸氧化,脂肪生成以及高、低密度脂蛋白吸收。其中脂肪酸氧化异常和过量转移脂肪脂代谢异常相关疾病的风险因素[12]。
有研究报道,KLF3 通过促进脂肪酸β 氧化来调节脂质代谢[13]。KLF5 可以调控糖尿病小鼠心肌细胞PPAR-α 的表达进而调控脂质代谢[14]。KLF11 过表达激活PPAR-α 信号通路和脂肪酸氧化,进而改善DIO 小鼠和db/db 小鼠的脂肪肝表型,减少巨噬细胞浸润[15]。由此,笔者对KLF 家族中的另外一位成员KLF9 与脂肪酸氧化之间的关系产生了兴趣。在调节肝脏脂代谢的众多因子中,转录因子PGC1-α和PPAR-α 尤为重要。PGC1-α 是一种多功能的转录调节因子,可以募集转录因子或转录复合体到达下游靶基因启动子周围并与其相互作用,从而调节下游靶基因的转录。有研究报道,与野生型小鼠相比,PGC1-α 基因敲除小鼠表现出肝脏糖异生功能下降,脂肪酸氧化和线粒体能量代谢下降,并且编码脂肪酸氧化和三羧酸循环相关酶的基因表达都下降[16]。转录因子PPAR-α 一旦被配体激活,可以诱导与脂代谢平衡相关基因的表达。PPAR-α 基因缺陷小鼠在禁食状态下肝脏中将会积累大量的甘油三酯,并且会出现低酮体和低血糖症状[17]。在众多被PPAR-α 调节的基因中,编码肉毒碱棕榈酰转移酶1a(Cpt1a)和中链乙酰辅酶 A 脱氢酶(MCAD)基因与线粒体的脂肪酸氧化有关;编码微粒体细胞色素P450 酶(Cyp4a10 和Cyp4a14)的基因与催化微粒体中的脂肪酸氧化相关[15]。
本研究中首先通过双荧光素酶报告基因和ChIP 实验得出,KLF9 可以结合到 PGC1-α 的启动子上,促进PGC1-α 基因的表达。然后将过表达KLF9 的腺病毒感染小鼠肝原代细胞,检测与脂肪酸氧化相关基因的表达,同时在蛋白水平验证KLF9 和PGC1-α 的表达情况。为了证实细胞实验的结果可靠性,进一步通过尾静脉注射过表达腺病毒和空载,同样在蛋白水平验证KLF9 和PGC1-α的表达情况,进而检测脂肪酸氧化相关基因的表达情况。结果表明,在小鼠肝原代细胞或者在小鼠体内过表达 KLF9 都会增强 PGC1-α、PPAR-α 及其下游靶基因的表达,并且进一步改善肝脏脂肪变,笔者初步证实KLF9 在脂肪酸氧化中存在调控作用。
