电解质溶液中“三大守恒”式的书写技巧与方法
2020-06-13李营营王福强
李营营 王福强
电解质溶液中离子浓度大小关系的判断是教学中的重、难点,也是高考中的必考知识点,能否准确并快速写出电解质溶液中的“三大守恒”关系是解决此类题型的关键,笔者通过查阅相关文献并结合自身教学体会,进行了大量分析、归纳和总结.
1 单一溶液


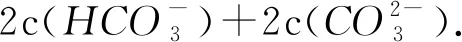
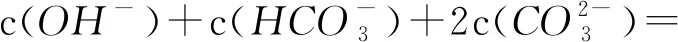
3)质子守恒. 质子守恒的书写可根据物料守恒式和电荷守恒式进行书写,方法为消去物料守恒和电荷守恒式中既不发生水解也不发生电离的粒子,例如本道题中应该消去K+,可得
也可通过图示法得出答案,分析如图1.
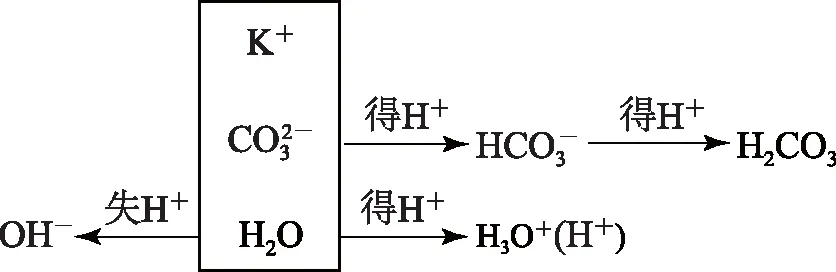
图1
根据水电离出的OH-和H+数相等得
2 混合溶液


反应前n(K+)=2n(CH3COOH)+2n(CH3COO-);等体积混合充分反应后,在不考虑水解和电离的情况下,得到物质的量比为1∶1的KOH与CH3COOK的混合溶液,此时与反应前相比较K+、CH3COOH和CH3COO-的量均没有发生改变,仍然存在反应前的关系,即混合溶液中的物料守恒式为
c(K+)=2c(CH3COOH)+2c(CH3COO-).
2)电荷守恒.
混合溶液中存在的阴离子有CH3COO-、OH-;阳离子有K+、H+;根据电荷守恒得
c(OH-)+c(CH3COO-)=c(K+)+c(H+).
3)质子守恒.
根据物料守恒式和电荷守恒式,消去不水解、不电离的K+,得质子守恒式:
c(OH-)=c(H+)+
2c(CH3COOH)+c(CH3COO-).
对于物料守恒的书写,无论是单一溶液还是混合溶液,首先是锁定除氢、氧两种元素以外的元素,并确定其等量关系,其次写出被锁定元素在溶液中的所有存在形式,最后根据等量关系即可写出物料守恒式.对于电荷守恒式,首先是写出溶液中存在的所有阴阳离子,然后根据阳离子所带的电荷总数等于阴离子所带的电荷总数,即可写出电荷守恒式,书写过程应准确体现离子浓度与电荷数的关系.对于质子守恒的书写,可根据物料守恒和电荷守恒,消去物料守恒和电荷守恒式中既不水解也不电离的粒子,即可写出质子守恒式,对于单一溶液还可根据图示法进行快速书写.
基于以上分析,电解质溶液中的三大守恒式的书写是有规律可循的,首先需要熟练掌握书写步骤,其次能准确分析出溶液中存在的各种微粒,并找出它们之间的相互关系,最后通过适当的训练即可熟练写出各种溶液中的三大守恒式.
