与量有关的离子方程式的书写方法
2020-06-13谭明福
谭明福
与量有关的离子方程式的书写与正误判断是学生学习的难点,也是近几年高考的热点.与量有关的反应绝大多数都是由几个简单的离子反应组合而成的,但最后的呈现方式是一个整体,不能分开写.所以笔者认为与量有关的离子方程式可以按照以下步骤书写:先根据实际情况将简单的离子方程式写出来,并弄清楚这几个反应的相互关系,再根据实际参加反应的微粒的物质的量之比将它们合并起来.根据反应间的关系和处理方式可以分为以下三种情况,现分别举例进行解释.
1 无相互关系的平行反应


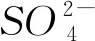
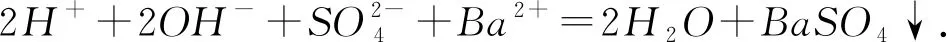
变式向Ba(OH)2溶液中逐滴滴加NaHSO4溶液至Ba2+恰好沉淀完全,写出该反应的离子方程式.
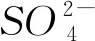
在这类反应中,本质上是相对独立的几个离子反应在同时进行,互不干扰,完全可以分开分析和计算.但由于反应的物质之间存在一定组成关系,参与反应的各离子间存在确定的量的关系,所以呈现出的离子方程式必须反映出所有参与反应的离子及离子间的物质的量的关系.
2 有竞争关系的先后反应

分析第1步:分析实际的反应关系.当氯气通入溶液中后,溶液中的Fe2+、Br-均能还原Cl2, 有竞争关系,但Fe2+还原性更强,优先反应.
第2步:分析参与反应的微粒间的量的关系.Fe2+优先与Cl2反应,故只有0.1molFe2+完全反应后(2Fe2++Cl2=2Cl-+2Fe3+),剩余的Cl2才能氧化Br-(2Br-+Cl2=2Cl-+Br2).标准状况下2.688L氯气的物质的量为0.12mol,根据上述反应关系可知,0.1molFe2+只消耗0.05molCl2,剩余的0.07molCl2能氧化0.14molBr-,溶液中有0.2molBr-,反应后剩余0.06molBr-,所以实际参加反应的Fe2+、Br-、Cl2分别为0.1mol、0.14mol、0.12mol.
第3步:依据参加反应的微粒的物质的量书写离子方程式.离子方程式中Fe2+、Br-、Cl2的化学计量数之比必须符合实际反应的微粒的物质的量之比,即满足0.1∶0.14∶0.12,故离子方程式为10Fe2++14Br-+12Cl2=10Fe3++24Cl-+7Br2.
变式向含有0.1molFeI2的溶液中缓慢通入标准状况下的氯气2.8L,请写出该反应的离子方程式.
分析本题的思考和书写方式与例2是一样的,仍然要考虑反应中的竞争关系,还原性强的微粒优先被氯气氧化,I-的还原性强于Fe2+,优先反应.分析可知实际参加反应的I-、Fe2+、Cl2分别为0.2mol、0.05mol、0.125mol,故离子方程式为8I-+2Fe2++5Cl2=2Fe3++10Cl-+4I2.
在这类反应中,有多种离子能与某一种离子反应,但存在竞争关系,必须考虑反应的先后顺序,只有在竞争中先反应的微粒完全反应后,第二反应的微粒才能反应,以此类推.在最终呈现的离子方程式中,各微粒的化学计量数之比满足实际参加反应的微粒的物质的量之比.
3 有递进关系的先后反应




变式向含有1.5molCa(OH)2的澄清溶液中加入含有1molCa(HCO3)2的溶液,写出该反应的离子方程式.

在这类反应里,有一类比较特殊的反应,即二元弱酸的酸酐与强碱的反应,解题过程中也完全可以找出反应的先后关系,再按上述方法书写.
上述3种类型基本上涵盖了所有复杂的与量有关的离子方程式,虽然题目的呈现形式不一样,反应过程与类型不一样,但我们可以用统一的思想、统一的方法去分析思考,以不变应万变,取得良好的学习效果.
