关于电解质溶液的问题剖析
2020-06-13陈晓燕
陈晓燕
涉及电解质溶液的相关问题在高考中占据较大比重,尤其是强弱电解质、电离平衡以及电解池工作原理等知识,涉及的题型较多,解题难度较大.因此,教师应对电解质溶液的问题进行深入剖析和解读,使学生能够熟练掌握电解质溶液的解题技巧与方法,为提升化学成绩保驾护航.
1 弱电解质溶液的电离平衡问题
电离平衡是指具有极性共价键的弱电解质(例如部分弱酸、弱碱、水)溶于水时,其分子可以微弱电离出离子;同时,溶液中的相应离子也可以结合成分子.从开始发生化学反应,弱电解质分子电离出离子的速率不断降低,当二者速率相等时,溶液便达到了电离平衡.电离平衡是电解质溶液中的重点内容,涉及的考点较多,学生在学习过程中,应熟练掌握弱电解质电离平衡的基本原理.

A. 强极性共价化合物不一定都是强电解质
B. 电解质溶液的浓度越大,其导电性能一定越强
C. 强酸和强碱一定是强电解质,不论水溶液浓度大小,都能够完全电离
D. 多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强

2 电解质溶液的导电特性
电解质导电属于离子导电,比如将二氯化镍溶于水后,能够分解成带正电荷的镍离子和带负电荷的氯离子,在二氯化镍溶液中插入2个金属棒并与电源的正负极接通,带电的正、负离子就分别向2个金属棒运动,2个氯原子结合成氯分子后,以气泡形式冒出.因此电源、导线、金属棒和二氯化镍水溶液组成的整个回路中就有电流通过.

A. 导电能力的强弱由自由移动的离子浓度决定
B. 强电解质溶液导电能力一定比弱电解质溶液强
C. 导电性强的溶液中自由移动的离子数目一定比导电性弱的溶液中自由移动的离子数目多
D. 二者没有本质区别
分析电解质溶液的导电性与离子浓度有关,也与离子所带电荷数有关,但与电解质的强弱无关,分析可知选项A正确,选项B、C错误.
3 判定电解质溶液浓度的方法
如何判断微粒浓度大小关系是高中化学需要重点学习和掌握的知识点,因此,在教学过程中,教师可以结合电荷守恒、物料守恒、质子守恒的三大守恒定律讲授判断电解质溶液浓度的方法.


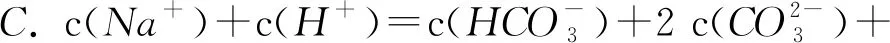

在平时的学习中,大家要及时记录和积累电解质溶液的相关知识,养成多听、多看、多做的良好学习习惯,以促进化学成绩的提升.
