急性脑梗死患者外周血Th17、Treg、Th17/Treg及炎症因子的动态变化过程研究
2020-06-13刘洁胡小辉龚道恺
刘洁,胡小辉,龚道恺
急性脑梗死(AIS)能激活一系列炎症细胞、细胞因子及趋化因子等,从而加重神经损伤,影响预后[1]。其中,辅助性 T细胞17(Th17)和调节性 T 细胞(Treg)是保持相对平衡的T淋巴细胞亚群;但是,Th17和Treg细胞平衡一旦打破,能加剧疾病的发展[2]。另外,IL-6、中性粒细胞与淋巴细胞比值(NLR)、C反应蛋白(CRP)和红细胞沉降率(ESR)等是临床上常用来评估全身炎性反应的指标[3]。目前缺乏Th17、Treg及Th17/Treg平衡与AIS炎症反应关系的研究。因此,本研究旨在阐述外周血Th17、Treg及Th17/Treg平衡和炎症因子动态变化情况,并分析其在AIS患者中的免疫调节作用。
1 对象与方法
1.1 对象 纳入2019年1月至2019年8月荆州市中心医院神经内科住院治疗的急性动脉粥样硬化性AIS患者32例,其中男19例,女13例;年龄为39~81岁,平均(63.1±10.7)岁。纳入标准:(1)所有患者均符合《中国急性缺血性脑卒中诊治指南2014》诊断标准,并经头颅CT 和(或)MRI证实诊断;(2)发病48 h内入院治疗;(3)首次发病。排除标准:(1)存在脑血管动脉瘤、心源性脑栓塞、静脉窦血栓、动静脉畸形、夹层、动脉炎及烟雾病的患者;(2)住院期间合并感染者;(3)合并急性心肌梗死、严重肝肾疾病、恶性肿瘤、内分泌疾病、血液循环系统及免疫系统疾病;(4)近期4周内存在感染、骨折外伤、手术及服用抗炎药物、免疫抑制剂。对照组为同期健康体检者,共32名,其中男14名,女18名; 年龄为30~78岁,平均(59.5±11.2)岁。均排除脑血管病、心肌梗死、糖尿病、恶性肿瘤、内分泌疾病及自身免疫性疾病,近期4周内无感染、骨折外伤、手术,未服用抗炎药物及免疫抑制剂。对照组与AIS组间在性别和年龄方面差异均无统计学意义(均P>0.05)。本研究获得知情同意并经医院伦理委员会批准通过。
1.2 方法
1.2.1 采血及实验室检查 所有AIS患者给予常规治疗。于住院后第1 d、4 d、7 d清晨,分别使用 EDTA 抗凝管采取空腹外周肘静脉血5 ml,平均分为两管,并在6 h内进行流式细胞术检测Th17、Treg比例。抽静脉血在3 h内,用Sysmex XN-1000全自动血液分析仪检测血常规,并计算中性粒细胞与淋巴细胞比值。采用赛科希德SD-100动态血沉压积测试仪测ESR,并采用电化学发光法测IL-6,免疫比浊法测CRP。
1.2.2 主要试剂和设备 Anti-CD127-PE-Cy7抗体、Anti-IL-17A-PE抗体、Leukocyte Activation Cocktail细胞刺激阻断剂(含有佛波醇酯、离子霉素和蛋白转运抑制剂)、Cytofix/Cytoperm 破膜固定试剂盒均购自于美国BD公司。Anti-CD25-PE抗体、Anti-CD4-FITC抗体购自于美国Biolegend 公司。OptiLyse C溶血素、Epics-XL流式细胞仪均购于美国Beckman Coulter公司。
1.2.3 Th17的检测方法 取新鲜无菌EDTA-K2抗凝全血和PRMI 1640培养液各200 μl混匀,加入细胞刺激阻断剂1 μl置于37 ℃、5% CO2刺激培养5 h;加入Anti-CD4-FITC 5 μl,室温避光孵育20 min;加入溶血素,室温避光孵育10 min;加入1 ml PBS,避光静置5 min 后,1 500 r/min 离心5 min,倒上清液;加入500 μl破膜固定剂避光20 min,离心去上清液。加入稀释后的缓冲液Wash buffer 2 ml,室温避光静10 min,离心去上清液。加Wash buffer 100 μl,加Anti-IL17A-PE 20 μl,室温避光孵育30 min。加Wash buffer 2 ml,离心去上清液后,加入0.5 ml PBS 重悬细胞,应用流式细胞仪,以淋巴细胞群设门,对 CD4+T 细胞分泌IL-17A的Th17进行检测。
1.2.4 Treg的检测方法 在流式管中加入Anti-CD4-FITC、Anti-CD25-PE及Anti-CD127-PE-Cy7各5 μl;再加入EDTA-K2全血100 μl,混均,避光孵育20 min; 加入OptiLyse C溶血素0.5 ml,混匀,避光孵育10 min; 加入1 ml PBS,避光静置5 min后,1 500 r/min 离心 5 min,倒上清液后,加入0.5 ml PBS 重悬细胞,应用流式细胞仪,以淋巴细胞群设门,检测CD4+CD25+CD127-调节 T 细胞占CD4+T 细胞的百分率。
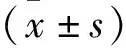
2 结 果
2.1 AIS组早期外周血Th17、Treg的表达及Th17/Treg比值动态变化情况 见表1。AIS组第1 d、4 d,患者外周血Th17比例明显高于对照组(P<0.05);第7 d患者外周血Th17比例减小,与对照组比较,差异无统计学意义(P=0.114)。外周血Treg比例在第1 d明显低于对照组,第4 d Treg比例增高,但仍低于对照组,差异均有统计学意义(P<0.05);第7 d患者外周血Treg比例继续升高,恢复至对照组水平,差异无统计学意义(P=0.507)。AIS患者外周Th17/Treg比值在第1 d、4 d、7 d逐渐减小,但均高于对照组,差异有统计学意义(P<0.05)。
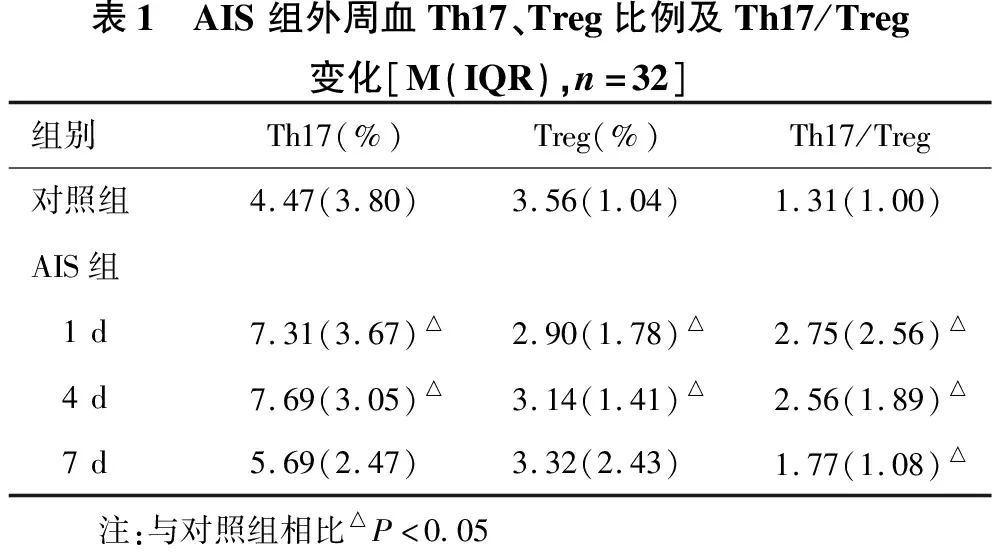
表1 AIS组外周血Th17、Treg比例及Th17/Treg变化[M(IQR),n=32]组别Th17(%)Treg(%)Th17/Treg对照组4.47(3.80)3.56(1.04)1.31(1.00)AIS组 1d7.31(3.67)△2.90(1.78)△2.75(2.56)△ 4d7.69(3.05)△3.14(1.41)△2.56(1.89)△ 7d5.69(2.47)3.32(2.43)1.77(1.08)△ 注:与对照组相比△P<0.05
2.2 AIS组早期炎性指标IL-6、NLR、CRP及ESR动态变化情况 见表2。AIS组第1 d、4 d、7 d,IL-6逐渐减低,但均高于对照组,差异有统计学意义(均P<0.05)。NLR和CRP在AIS后第1 d高于对照组,第4 d继续增高,第7 d有所下降,整个过程持续高于对照组(均P<0.05)。ESR在AIS后第1 d,与对照组比较,无统计学意义(P=0.278);第4 d明显高于对照组(P<0.05),第7 d有所下降,但高于对照组(P<0.05)。
2.3 AIS组Th17及Treg细胞比例、Th17/Treg、NLR、CRP、ESR水平分别与IL-6的相关性分析 见图1。AIS患者第1 d、4 d、7 d外周血Th17比例及Th17/Treg、NLR、CRP、ESR分别与IL-6呈正相关(ρ=0.298,P=0.007;ρ=0.351,P=0.001;ρ=0.377,P=0.001;ρ=0.582,P=0.000;ρ=0.388,P=0.000);Treg比例与IL-6呈负相关(ρ=-0.242,P=0.029)。
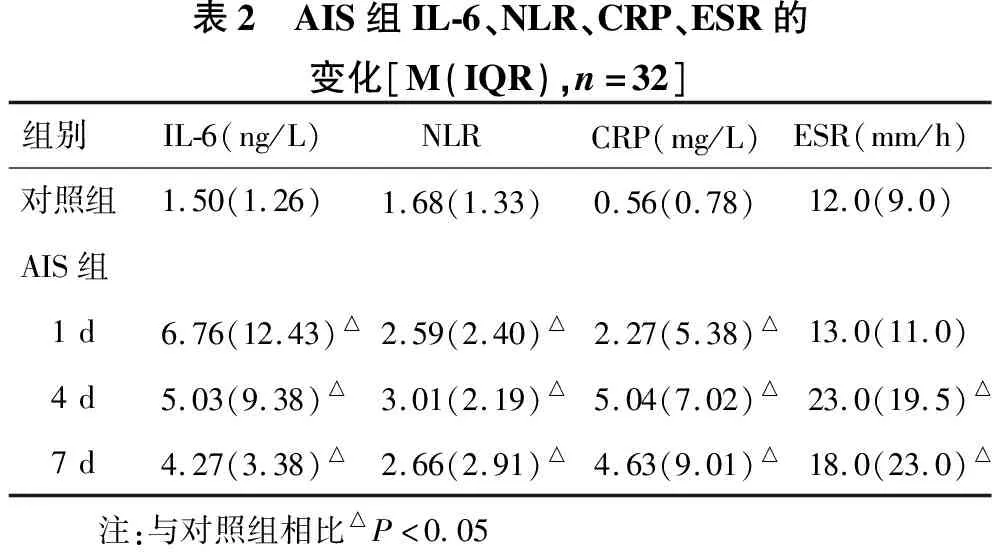
表2 AIS组IL-6、NLR、CRP、ESR的变化[M(IQR),n=32]组别IL-6(ng/L)NLR CRP(mg/L)ESR(mm/h)对照组1.50(1.26) 1.68(1.33) 0.56(0.78)12.0(9.0)AIS组 1d6.76(12.43)△2.59(2.40)△2.27(5.38)△13.0(11.0) 4d5.03(9.38)△3.01(2.19)△5.04(7.02)△23.0(19.5)△ 7d4.27(3.38)△2.66(2.91)△4.63(9.01)△18.0(23.0)△ 注:与对照组相比△P<0.05

图1 AIS患者Th17及Treg细胞比例、Th17/Treg、NLR、CRP、ESR水平分别与IL-6的相关性分析;ρ为相关系数
3 讨 论
AIS发生后局部炎症可迅速激活全身性炎症级联反应,从而诱发脑组织的二次损伤[4]。Th17是参与组织炎症和自身免疫的主要细胞类型,Treg则介导免疫耐受、防止脑组织损伤,因此Th17/Treg细胞的平衡是AIS缺血性脑损伤的重要决定因素[5]。探索AIS早期外周免疫状态,有助于了解疾病的发展过程。
Th17和Treg都起源于CD4+T淋巴细胞,不仅在功能上相互拮抗,而且在细胞分化上可以相互影响和转化[6]。Th17分泌的细胞因子可以影响Treg分化形成,加剧脑损伤;与此同时,Treg也可以通过转录的特异性Foxp3抑制Th17分化和IL-17表达,发挥抗炎作用[7]。因此,Th17/Treg可以反映这两类细胞外周免疫平衡状态。已有研究表明,Th17和Treg参与了动脉粥样硬化的形成,而且Th17/Treg的失衡可诱导斑块破裂或内皮侵蚀,最终导致血栓形成[8]。但是,目前缺乏人外周血Th17、Treg 的表达与AIS病情进展的动态研究。本研究结果显示,在AIS后的第1 d,Th17显著升高,而Treg表达受到抑制,Th17/Treg的平衡被打破,说明早期炎症反应以促炎反应为主,免疫保护作用减弱。随后,Th17逐渐减少,Treg表达逐渐增多,并在AIS第7 d基本恢复至对照组水平。表明随着机体免疫调节,Treg抗炎作用增强,限制Th17表达。但此时,与对照组相比,Th17/Treg紊乱仍然存在,说明在AIS后的第7 d细胞免疫稳态尚未完全恢复。由此可见,比起Th17和Treg,Th17/Treg能反映AIS后的免疫平衡状态。
IL-6可以由小胶质细胞、淋巴细胞、内皮细胞等多种细胞分泌,介导、参与AIS的全身炎性反应[9]。IL-6不仅能促进初始T淋巴细胞向Th17分化,还能使扩增的Treg转化为效应Th17,干预Th17/Treg的平衡调节[10]。本研究发现,AIS患者血清中IL-6的水平与Treg的表达呈负相关,而与Th17水平呈正相关。这与Li等的研究结果一致[11]。而且,本研究进一步证实,IL-6在AIS后的第1 d表达水平最高,之后表达逐渐降低,第7 d时IL-6水平仍高于对照组,这一变化趋势与Th17/Treg一致。而且,IL-6水平与Th17/Treg呈正相关,说明IL-6可能参与了AIS外周细胞免疫稳态调节的全过程。
NLR是简单易行的新型炎性标志物,与AIS缺血灶体积大小密切相关[12]。AIS局部的促炎介质可迅速释放到体循环中,中性粒细胞大量激活,并分泌基质金属蛋白酶9破坏血-脑屏障,从而诱导周围炎症因子和细胞浸入脑实质[13]。同时,交感神经的过度反应导致成熟淋巴细胞凋亡,AIS患者处于免疫抑制状态,增加感染机会[14]。本研究发现NLR脑卒中第1 d升高,在第4 d达到高峰,此后缓慢降低,因此推测AIS早期高水平的NLR有神经功能损伤的风险,并且容易合并感染。IL-6能诱导肝脏合成CRP[15],并与CRP水平呈正相关,但并不完全同步增长,CRP表达高峰可能出现滞后现象(表2)。ESR是非特异性炎性标志物,尽管灵敏度和特异性不高,但可以联合其他炎症指标,共同评估动脉粥样硬化狭窄程度和AIS不良预后[16-17]。ESR、NLR及CRP三者变化趋势基本一致,即逐渐上升再下降,并且均与IL-6的表达水平密切相关。因此推测,IL-6、NLR、CRP及ESR在AIS患者全身炎症反应中发挥重要作用。
综上所述,外周Th17、Treg参与AIS发生和发展过程;IL-6不仅可作用于Th17/Treg平衡的调节,还能与ESR、NLR及CRP共同反映了AIS患者全身炎症动态变化情况。临床上,采用多个炎症指标联合更有利于 AIS的早期诊断、病情变化的判断。
