乳腺癌MDA-MB-231细胞中Rab7a基因的网络分析
2020-06-12徐凤英曲一帆肖伟利王玉珍谢基明
徐凤英, 刘 儒, 马 丽, 曲一帆, 肖伟利, 王玉珍,谢基明
( 1.内蒙古医科大学研究生学院,内蒙古 呼和浩特 010110;2.内蒙古自治区人民医院检验科,内蒙古 呼和浩特 010010;3.内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010018)
Rab7a基因和Rab7b基因是Rab7基因家族的2个同源亚型,具有较高的序列相似性[1]。与负责从核内体向高尔基体转运的Rab7b不同[2],Rab7a位于晚期核内体,控制向内吞降解室的转运[3]。Rab7a是溶酶体、吞噬体和自噬体成熟所必需的,并已被证明可调节细胞的存活和凋亡。最近报道[4]表明:Rab7a在癌症中也发挥了重要作用。波形丝蛋白是反映上皮间质转化的一个指标[5],在癌细胞中由Rab7a调控[6]。伏立诺和辛伐他汀可通过抑制Rab7协同抑制三阴性乳腺癌(tripe-negative breast cancer,TNBC)的发展[7]。然而目前尚未见关于Rab7a相关联基因如何参与TNBC发生发展的报道。本研究利用慢病毒载体敲除TNBC MDA-MB-231细胞中Rab7a基因,通过与阴性对照组比较,对差异基因进行分析,推断Rab7a及其关联基因的相互作用以及其可能参与的重要病理过程。
1 材料与方法
1.1 细胞、病毒、主要试剂和仪器人乳腺癌ZR-75-30、T-47D、HCC-1937、MDA-MB-231和MCF-7细胞购自美国模式菌种收集中心(American Type Culture Collection,ATCC)。慢病毒lv-Rab7a-sgRNA和阴性对照CON251购自上海吉凯基因化学技术有限公司。DMEM培养基购自美国Invitrogen公司,Ausbian胎牛血清(FBS)购自上海威正翔禹生物科技有限公司,BCA试剂盒和RIPA裂解液均购自上海碧云天生物有限公司。 anti-Rab7a和anti-GAPDH均购自美国Santa Cruz公司,TRIzol试剂盒购自上海普飞公司,M-MLV反转录试剂盒、dNTP和Rnase Inhibitor均购自北京Promega公司,SYBR Master Mixture购自日本TaKaRa公司,人基因表达谱芯片(货号:901838)、安捷伦RNA 6000 Nano 试剂盒、3′IVT PLUS基因芯片和基因芯片杂交洗涤染色试剂盒均购自美国Affymetrix公司。
1.2 细胞培养人乳腺癌ZR-75-30、T-47D和HCC-1937 细胞置于RPMI1640培养基中培养,乳腺癌MCF-7细胞采用DMEM培养基培养,MDA-MB-231细胞采用L-15培养基培养。培养基中血清含量均为10%。MDA-MB-231 细胞隔天换液1次,当细胞生长至80%~90% 融合时,采用含 EDTA 的 PBS 平衡盐溶液漂洗,再采用0.25%胰蛋白酶消化传代,均在37℃、5%CO2培养箱中培养。
1.3 Western blotting法检测乳腺癌ZR-75-30、MCF-7、T-47D、MDA-MB-231和HCC-1937细胞中Rab7a蛋白表达水平收集对数生长期目的细胞,提取总蛋白,采用BCA试剂盒测定蛋白水平。取50 μg蛋白样品按比例加入上样缓冲液,沸水浴5 min,冷却离心后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),采用湿转法120 V、90 min将蛋白质电转至聚偏二氟乙烯(PVDF)膜上,然后采用磷酸盐缓冲液和吐温20 (TBST)溶解的5%脱脂奶粉室温封闭4 h,阻断与抗体的非特异性结合。膜与一抗(1∶1 000) 4℃孵育过夜,次日采用TBST洗涤3次(每次10 min),室温孵育辣根过氧化物酶标记的二抗(1∶10 000) 2 h,TBST洗涤3次(每次10 min)后检测PVDF膜上Rab7a蛋白表达水平。
1.4 慢病毒载体介导的Rab7a基因敲除将处于对数生长期的MDA-MB-231 细胞经胰酶消化,完全培养基制成细胞密度为(3~5)×104mL-1的细胞悬液,取2 mL接种于 6孔板 ,培养24 h后,采用感染复数(MOI)为10的慢病毒感染MDA-MB-231细胞以敲除Rab7a基因,培养12 h后采用完全培养液代替病毒感染液继续培养。慢病毒载体上的绿色荧光蛋白(green fluorescent protein,GFP)表达率为90%时,收集细胞进行后续Rab7a基因敲除效率的验证。Rab7a基因敲除组根据敲除的4种不同Rab7a基因序列分为KD1组、KD2组、KD3组和KD4组,并设置阴性对照组。各组Rab7a基因敲除序列见表1。

表1 各组Rab7a基因敲除序列
1.5 qPCR法检测各组乳腺癌MDA-MB-231细胞中Rab7a基因敲除效率采用TRIzol试剂盒对病毒感染的各组乳腺癌MDA-MB-231细胞进行裂解和总RNA提取。取2 μg总RNA和2 μL反转录引物,根据 M-MLV试剂盒说明进行反转录合成cDNA,采用qPCR法扩增目的基因和内参基因。Rab7a基因敲除效率为Rab7a mRNA表达水平降低百分比,Rab7a mRNA表达水平以每组测得的目的基因Rab7a和内参基因GAPDH的CT值并采用2-ΔΔCt法进行计算。ΔCt=目的基因Ct值-内参基因Ct值,ΔΔCt=阴性对照组ΔCt平均值-各样品ΔCt值。Rab7a基因引物序列见表2。
表2 Rab7a基因和内参基因引物序列
Tab.2 Primer sequences of Rab7a gene and internal reference gene

GeneSequence (5'-3')Rab7a senceGTCGGGAAGACATCACTCARab7a antisenceCTAGCCTGTCATCCACCATGAPDH senceTGACTTCAACAGCGACACCCAGAPDH antisenceCACCCTGTTGCTGTAGCCAAA
1.6 芯片实验采用TRIzol法抽提阴性对照组和KD2组样品总RNA,抽提所得总RNA经NanoDrop 2000和Agilent Bioanalyzer 2100质检,合格样本进入芯片实验。芯片实验的步骤主要包括样品的制备、芯片杂交、芯片洗染、芯片扫描和结果分析。
1.7 Rab7a基因敲除后一体化通路分析(IPA)IPA是一个一体化在线整合分析软件(www.ingenuity.com)[8],用于基因、microRNA数据和小规模实验数据的分析。IPA建立了可视化的实验系统,用于理解基因、蛋白质、化学物质和药物等属性,同时可呈现分子之间相互作用的关系网。IPA使用网络生成算法,按照本课题组预设的网络大小将分子之间的网络图分割成多个网络,并给每一个网络进行打分。Score基于P值计算,反映了网络中的数据集分子出现在该网络中为随机过程的概率。Score打分是基于超几何分布,通过右尾的Fisher精确检验获得显著性水平的负对数值。所有的网络使用Score值进行排序。Score值大于2代表该功能被显著激活,Score值小于-2代表该功能被显著抑制。
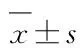
2 结 果
2.1 各组乳腺癌细胞中Rab7a蛋白表达以表达Rab7a的293T细胞作为阳性对照,收集对数生长期乳腺癌ZR-75-30、MCF-7、T-47D、MDA-MB-231和HCC-1937细胞总蛋白,Western blotting法分析结果显示:与阳性对照组比较,乳腺癌ZR-75-30、T-47D、MDA-MB-231和HCC-1937细胞中均可见Rab7a蛋白表达。见图1。

Lane 1: Positive control group(293T cells);Lane 2:ZR-75-30 cells;Lane 3:MCF-7 cells;Lane 4:T-47D cells;Lane 5:MDA-MB-231 cells;Lane 6:HCC-1937 cells.
图1 各组乳腺癌细胞中Rab7a蛋白表达电泳图
Fig.1 Electrophoregram of expressions of Rab7a protein in breast cancer cells in various groups
2.2 慢病毒感染MDA-MB-231细胞中荧光表达MDA-MB-231细胞感染慢病毒96 h后,阴性对照组和KD1、KD2、KD3及KD4组细胞生长状态良好,病毒感染率达到90%以上。见图2(插页三)。
2.3 各组MDA-MB-231细胞中Rab7a基因敲除效率与阴性对照组比较, KD1组MDA-MB-231细胞中Rab7a mRNA表达水平下调了76.2%,即Rab7a基因敲除效率为76.2%;KD2组MDA-MB-231细胞中Rab7a mRNA表达水平下调了87.9%,KD3组MDA-MB-231细胞中Rab7a mRNA表达水平下调了86.2%,KD4组MDA-MB-231细胞中Rab7a mRNA表达水平下调了58.2%;与其他各组比较,KD2组细胞的靶序列具有最高的敲除效率(P<0.001),即KD2组细胞的靶序列是敲除效率最高的靶点。见图3。

*P<0.01 vs negative control group.
Fig.3 Expression levels of Rab7a mRNA in MDA-MB-231 cells in various groups
2.4 Rab7a基因敲除后的显著性差异基因分布对Rab7a敲除效率最高的KD2组与阴性对照组进行基因芯片检测结果显示:与阴性对照组比较,KD2组检测的上调基因数(262个)增多(P<0.01),下调基因数(372个)增多(P<0.01)。火山图展示了与阴性对照组和KD2组差异基因分布情况。横坐标代表经过以2为底对数转换的差异倍数,纵坐标代表经过以10为底对数转换的矫正显著性水平;红色表示差异倍数大于1.5、显著性水平小于0.05的所有探针。横坐标0左侧代表下调的基因数,右侧代表上调的基因数。见图4(插页三)。
2.5 差异基因相关疾病与功能关系对这634个差异基因进行疾病与功能的IPA,疾病与功能柱状图展示差异基因在疾病与功能分类中的富集情况。所有疾病与功能使用-Log(Pvalue)值由高到底排序(即按照P值由小到大排序)。与阴性对照组比较,KD2组中与Rab7a相关联的基因主要与癌症、机体损伤和异常及细胞存活等有密切关联。见图5。

1:Cancer;2:Organismal injuries and abomalities;3:Cell death and survival;4:Cell growth;5:Protein synthesis;6:Cell-to-cell signaling and interaction;7:Cellular movement;8:Cellular development;9:Tumor morphology;10:Organismal survival;11:Gastrointestinal disease;12:Hematological system development and function;13:Immune cell trafficking;14:Hematological disease;15:Immunological disease.
图5 差异基因相关疾病与功能关系的直条图
Fig.5 Histogram of disease and function associated with different genes
2.6 指定基因IPA网络图根据指定基因VEGFA、IRS1、RPS6KB1、EIF4E和PRKAA1,添加目的基因Rab7a,通过IPA分析平台绘制基因关系网络图。在网络图中,Rab7a基因敲除导致eIF4F和IRS1表达下调以及激酶RPS6KB1表达下调;激酶PRKAA1和IKBKE表达上调及VEGFA和转录因子ATF2表达上调。见图6。
3 讨 论

图6 指定基因的IPA网络图
乳腺癌已成为全球女性发病率最高的恶性肿瘤[9],且死亡率持续升高[10],其中TNBC占浸润性乳腺癌的10%~20%,严重影响女性健康与生活质量[11]。由于TNBC不表达雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2),因此内分泌治疗及抗HER2分子靶向治疗对TNBC患者无效[12]。目前有效的全身治疗方法是具有细胞毒性的化疗,这种治疗方式不良反应大且耐药性高[13]。因此,探索TNBC发生变化的分子机制可能有助于深入了解这种疾病的治疗策略[14]。
本课题组前期的研究[4]已经证实:Rab7a在乳腺癌中发挥致癌基因的作用,促进乳腺癌的生长和侵袭。本研究中采用重组的4 种不同靶序列的慢病毒敲除MDA-MB-231细胞的Rab7a基因,并成功获得持久基因沉默、稳定低表达Rab7a的MDA-MB-231 细胞。通过对不同靶点敲除效率的验证,筛选出Rab7a敲除效率最高的KD2组进行基因芯片分析,结果显示:与Rab7a敲除相关联的基因有262个上调基因,372个下调基因。对差异基因进行IPA分析可见Rab7a及其相关联基因与癌症、细胞存活、机体损伤和异常、炎症、免疫反应等有密切联系,提示Rab7a及相关基因参与多种病理过程[15-18]。在指定的基因列表中,本研究通过添加目的基因Rab7a进行IPA分析,在基因网络分析图中,Rab7a与指定各基因相互作用并发生变化。真核起始因子(eIFs)在肿瘤发生发展起重要作用,mTOR/eIF4F轴有助于乳腺癌的维持和进展[19]。本研究中,eIF4F被Rab7a敲除后表达下调,提示Rab7a可能通过调节eIF4F而促进乳腺癌发生。此外,Rab7a沉默还导致RPS6KB1表达降低,有研究[20]显示:RPS6KB1在乳腺癌组织中发生了改变。本研究结果显示:Rab7a耗竭增强了PRKAA1的表达。目前PRKAA1在癌症发展中的作用尚不明确,PRKAA1和RPS6KB1在乳腺癌发展中的作用需要进一步研究。
综上所述,可将TNBC细胞中Rab7a作为一个靶基因,对其相关联基因进行IPA分析,全面预测Rab7a可能参与的疾病进程,并将Rab7a与其相关基因进行相互关联分析,为将来更深层次的研究奠定基础。
