FAT4在三阴性乳腺癌组织中的表达及其临床意义
2020-06-12陈茂山莫琳龙杨宏伟谢少利侯令密
陈茂山,莫琳龙,杨宏伟,谢少利,侯令密
(1.四川省遂宁市中心医院 乳腺甲状腺外科,四川 遂宁 629000;2.皖南医学院附属医院 甲状腺乳腺外科,安徽 芜湖 241001;3.川北医学院附属医院 甲状腺乳腺外科,四川 南充 637000)
乳腺癌发病率位居女性恶性肿瘤首位,乳腺癌病死率在发达国家和发展中国家中女性中分别排名第2位和第1位[1-2]。三阴性乳腺癌(triple negative breast cancer,TNBC)在所有乳腺癌中占比约19%~38%,缺乏内分泌治疗和确切的靶向治疗靶点,手术和化疗是该类乳腺癌的主要治疗方式,其5年复发和转移率非常高[3-4]。目前,寻找TNBC特异性的治疗靶点是该类患者诊治的重点与难道[5]。脂肪非典型钙黏蛋白4(FAT atypical cadherin 4,FAT4)作为钙黏蛋白家族重要成员之一,在细胞增殖、凋亡、器官大小和细胞极性方面起重要作用[6-7],并且作为Hippo信号通路的上游跨膜受体在许多肿瘤的发生发展中发挥了关键效应[8-11]。研究[6,9-10,12]发现,在恶性黑色素瘤、食管癌、鳞癌和胃癌等多种恶性肿瘤组织中检出FAT4呈低水平表达,可能是FAT4基因的突变或缺失,或FAT4基因的高甲基化所致。Qi等[13]在乳腺癌组织中对FAT4的表达情况进行研究,但未在TNBC患者中进行分析。本研究检测了FAT4在TNBC中的表达情况,并分析FAT4的表达水平与TNBC临床病理特征及预后的关系。
1 材料与方法
1.1 标本来源与病例资料
10例TNBC患者癌组织及癌旁组织(距离肿瘤外缘2 cm以上)新鲜标本,取自2015年9月—2016年9月在川北医学院附属医院,穿刺活检病理诊断为浸润性导管癌(非特殊类型),免疫组化确认为TNBC并行乳腺癌根治术的患者;标本经过剪切,剔除肉眼可见的坏死、钙化、出血,用冻存管于-80 ℃冰箱储存备用。病理切片来源于2007年3月—2012年3月在川北医学院附属医院病理确诊乳腺癌并接受乳腺癌改良根治术标本。所有患者均经川北医学院附属医院病理科确诊为浸润性导管癌(非特殊类型),经免疫组化确认为TNBC,即雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER-2)均为阴性。包括60例乳腺癌组织及60例癌旁正常乳腺组织(距离肿瘤外缘2 cm以上)。所有患者在术前均未接受任何新辅助治疗;患者均为女性;年龄在29~64岁之间,中位年龄41岁。根据美国癌症联合会(AJCC)第7版TNM分期:I期乳腺癌6例,II期乳腺癌28例,III期乳腺癌26例。本研究纳入的标本均获得患者或家属的同意,临床病理资料及随访资料完整。
1.2 主要仪器设备
蛋白定量仪:德国Eppendorf公司;PCR仪:美国Bio-Rad公司;凝胶成像系统:美国Bio-Rad公司;转膜仪:美国Bio-Rad公司;-80 ℃超低温冰箱:英国Abcam公司;低温离心机:美国Thermo公司。
1.3 主要试验试剂
RNA提取试剂盒:美国Gibco公司;蛋白质提取试剂盒:美国Bio-Rad公司;蛋白质裂解液:美国Bio-Rad公司;PVDF膜:美国Millipore公司;SDS-PEGE凝胶试剂盒:中国碧天云公司;Western blot电泳液:中国碧天云公司;Western blot封闭液:美国KPL公司;抗FAT4抗体(IHC):美国Novus Biologicals公司;抗FAT4抗体(Western blot):英国Abcam公司;山羊抗兔IgG/H&L二抗:中国碧天云公司;山羊抗兔IgG/HRP二抗:美国Invitrogen公司;DAB显色试剂盒:美国Invitrogen公司;免疫组化试剂盒:中国北京中杉金桥生物有限公司。
1.4 实验方法
1.4.1 FAT4 mRNA表达检测按照GIBCO公司RNA提取试剂盒操作说明提取组织总RNA;配置反转录体系,加入RT-PCR仪中进行反应,PCR产物的特异性由溶解曲线的Tm值来确认,将特异性反应结果去除后,FAT4的相对表达水平使用2-△△Ct方法计算得出。
1.4.2 FAT4蛋白表达检测按照BIO-RAD公司蛋白质提取试剂盒操作说明书提取总蛋白;蛋白质纯化、定量,制备SDS-PAGE胶;吸取5 μL蛋白样品加入5 μL×上样缓冲液,电泳槽内装配转移三明治,将蛋白转移至PVDF膜,BCIP避光显色。通过Imager Lab图像分析软件对PVDF膜各条带的灰度进行扫描,得出FAT4的相对表达量。
1.4.3 免疫组化染色将乳腺癌石蜡块切成5 µm厚度的组织并制成白片;按照免疫组化操作步骤,脱蜡、至水、热修复、封闭、加入抗体(一抗:兔多克隆抗FAT4抗体,1:150,Novus Biologicals,USA;二抗:山羊抗兔IgG/HRP,1:5 000,Invitrogen,USA)、DAB试剂盒显色、脱水、透明、封片。通过Image-Pro-plus软件对组织切片染色结果进行量化,测定相对表达量。
1.5 统计学处理
实验中涉及的所有需要进行统计学处理的实验数据,均采用SPSS 24.0 for Windows统计软件(SPSS Inc.,Chicago,IL,USA)进行分析,并用均数±标准差(±s)表示,组间比较采用独立样本t检验。FAT4与乳腺癌临床病理学参数之间的关系采用Person χ2检验分析,FAT4与乳腺癌患者的生存期采用Kaplan-Meier分析,多因素分析采用Cox风险比例模型。检验水准α=0.05。
2 结 果
2.1 FAT4 mRNA与蛋白在TNBC中的表达
对10例TNBC患者的新鲜癌组织及癌旁组织总RNA进行提取,采用qRT-PCR法检测FAT4 mRNA的表达量。结果显示,以癌旁正常组织中FAT4 mRNA的相对表达量为参照,TNBC组织中FAT4 mRNA的相对表达量为0.482±0.092,两组比较差异具有统计学意义(t=17.731,P<0.001)。表明FAT4的mRNA在癌组织中的表达明显低于癌旁正常组织(图1A)。提取10例TNBC患者新鲜癌组织及癌旁组织的总蛋白质,通过Western Blot法检测其中FAT4蛋白的相对表达水平。结果显示,以癌旁正常组织中FAT4蛋白的相对表达水平为参照,TNBC组织中FAT4蛋白相对表达量为0.437±0.082,两组差异有统计学意义(t=21.694,P<0.001)(图1B)。
2.2 FAT4蛋白表达与TNBC患者临床病理特征的关系
采用免疫组化法检测60例TNBC患者癌组织及癌旁正常组织的FAT4蛋白表达情况,FAT4蛋白在细胞膜上成棕黄色染色(图2)。FAT4在TNBC组织中的阳性率为23.33%(14/60),在癌旁正常组织中阳性率为71.67%(43/60),差异有统计学意义(χ2=28.104,P<0.001)。FAT4蛋白表达水平在TNBC中的表达与年龄(χ2=0.106,P=0.744)和月经状态(χ2=0.007,P=0.933)无关;与淋巴结状态(χ2=4.488,P=0.034)、肿瘤大小(χ2=14.852,P=0.001)、TNM分期(χ2=7.155,P=0.028)、组织学分级(χ2=5.203,P=0.023)及Ki-67指数(χ2=4.641,P=0.031)明显有关(表1)。

图1 FAT4 mRNA与蛋白TNBC组织与癌旁组织中表达蛋白表达Figure1 Expressions of FAT4 mRNA and protein in TNBC and adjacent tissueB:FAT4 protein expression detected by Western blot

图2 免疫组化检测FAT4蛋白在TNBC组织与癌旁正常组织中的表达(×400)Figure2 Immunohistochemical staining for FAT4 protein expression in TNBC and adjacent tissues (×400)

表1 FAT4表达与TNBC患者临床病理特征的关系[n(%)]Table1 Relations of FAT4 expression with the clinicopathologic factors of TNBC patients [n (%)]
2.3 FAT4的表达水平与患者预后的关系
根据FAT4蛋白表达水平将患者划为阳性组和阴性组,比较两组无病生存期(diseasefree survival,DFS)。中位随访45个月(范围:7~64个月),总事件数19例,其中FAT4阳性组4例(肺转移2例,骨转移1例,原位复发1例),FAT4阴性组15例(肺转移5例,骨转移4例,肝转移2例,原位复发4例)。FAT4阳性患者的中位DFS长于阴性患者(42.0个月vs.34.6个月),经Log-rank检验差异有统计学意义(P=0.037)(图3)。预后单因素分析显示,淋巴结状态(P=0.011)、TNM分期(P=0.023)和Ki-67(P=0.032)与DFS有关(表2)。经多因素Cox风险比例模型分析,FAT4蛋白阳性表达患者预后优于阴性患者(HR=0.52,95% CI=0.29~0.98,P=0.041),是TNBC患者的独立预后因素(表3)。

图3 FAT4表达情况与TNBC患者DFS的关系Figure3 Relationship between FAT4 expression and DFS of TNBC patients

表2 临床病理因素与TNBC患者DFS关系的单因素分析Table2 Univariate analysis of association of clinicopathologic factors and DFS of TNBC patients
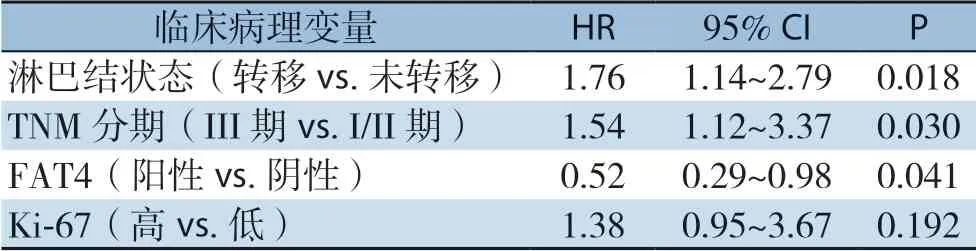
表3 TNBC预后因素Cox模型多因素分析Table3 Cox multivariate proportional hazard analysis of prognostic factors for TNBC
3 讨 论
本研究通过对TNBC新鲜癌组织和癌旁组织标本进行FAT4的mRNA和蛋白表达进行分析,结果表明与临近的非肿瘤组织相比,TNBC组织中FAT4在转录水平和蛋白水平均被下调,与其他肿瘤中的研究结果相似[6,9-10,12]。Ma等[11]通过免疫组化检测发现,胃癌组织中FAT4相对表达水平显著降低,且与肿瘤浸润、淋巴结转移和累积生存率呈负相关。Pilehchian等[12]采用Taqman real time PCR检测30个胃癌和癌旁组织的标本中FAT4的表达,也得到了类似的结果。
为明确FAT4与TNBC疾病进展的关系,本研究通过免疫组化分析FAT4的相对表达水平与临床病理指标的关系,通过对60例TNBC患者肿瘤组织与癌旁组织进行免疫组化染色,结果显示,FAT4在约23.33%的TNBC组织中具有阳性的表达,显著低于癌旁组织中的71.67%。这与本研究通过临床肿瘤标本提取RNA和总蛋白来鉴定FAT4的基因和蛋白的相对表达水平结果一致。可见,FAT4在TNBC组织中的低水平表达水平可以明确。免疫组化结果发现,FAT4的表达水平与Ki-67指数呈负相关。Ki-67抗原是与细胞增殖相关的核抗原,在1983年被Gerdes首次发现,参与到细胞的有丝分裂进程,可作为肿瘤细胞的增殖活性标志物[14]。Ki-67指数与肿瘤细胞的增值及侵袭转移密切相关,成为乳腺癌独立预后的指标,其高水平表达可以在一定程度上反映肿瘤细胞的增殖和侵袭能力强,恶性程度高[15-16]。近年来,研究发现Ki-67指数还可以作为内分泌治疗、化疗等治疗的疗效预测指标[17-19]。随着精准治疗的普及与提高,乳腺癌的异质性倍受关注,在乳腺癌的分子分型中,Ki-67指数被用于评判Luminal A型和Luminal B型乳腺癌的重要参考指标之一,而在最新的乳腺癌临床指南规范中,将30%作为乳腺癌Luminal分子分型的高低表达界限[20]。Ki-67的表达水平与乳腺癌的化疗敏感性有一定关系,但是并不是Ki-67高表达就对化疗敏感。Yaqi等[21]通过免疫组化检测geminin高表达的乳腺癌患者预后更差,结果提示其他生物标志物有助于识别Ki-67高表达患者可避免不必要的化疗。而FAT4与Ki-67的研究数据还有待进一步开拓。FAT4作为Hippo信号通路的上游跨膜表达受体,该通路在哺乳动物体内对于细胞增殖与器官发育有重要作用,器官的大小调节是一个高度协调和复杂的生物学过程,但最主要受细胞大小、细胞数目、细胞外基质和体液等因素的影响[9,22]。在一定程度上TNBC的恶性程度与Ki-67指数呈正相关,但是FAT4在TNBC组织中的低表达与肿瘤细胞增殖能力的关系目前尚不明确,其具体的分子机制仍需探究,是否通过Hippo信号通路进行调控也没有明确的报道。
通过对60例TNBC组织中FAT4的相对表达水平与肿瘤分期的关系,在6例I期TNBC患者中FAT4阴性表达与阳性表达相同,均占3例;在28例II期TNBC患者中FAT4阴性表达占19例,而阳性表达只占9例;在26例III期TNBC患者中FAT4阴性表达占24例,而阳性表达只占2例;可见肿瘤TNM分期越高,FAT4的阳性表达水平越低,结果提示FAT4表达水平与肿瘤TNM分期呈负相关。直接证明了FAT4在疾病中起到了抑癌因子的作用。肿瘤的大小与肿瘤细胞的增殖能力和生长速度有关,而淋巴结状态及远处转移水平主要与肿瘤细胞的浸润和转移的能力有关。FAT4对TNM分期的影响即是FAT4对肿瘤细胞增殖水平、生长速度、及浸润和迁徙能力的改变,在进一步的机制探讨研究中,我们也将从这几个方面进行详细分析。
初步研究结果表明FAT4作为肿瘤抑制因子在TNBC的疾病进程中起到了积极的抵抗作用,但是FAT4与乳腺癌患者预后的关系尚不明确。经过对患者的随访资料进行统计分析,中位随访45个月,FAT4阳性表达的患者与阴性表达患者相比,DFS中位生存时间显著延长,结果证实了FAT4的相对表达水平能够影响TNBC患者的预后的结论。通过临床病理因素与TNBC患者DFS的单因素分析,结果显示FAT4阳性表达水平作为影响临床研究事件(DFS)的保护因素,即FAT4表达水平越高,患者复发风险越高。然后我们通过Cox风险比例模型多因素回归分析,结果表明FAT4的相对表达水平是影响TNBC患者累计生存率低下的独立预后因素。通过生存分析结果说明了FAT4在TNBC的发生发展中起到了至关重要的作用,结合相关乳腺癌研究报道中发现的FAT4突变的证据[13],在TNBC中FAT4的表达水平下调是明确的,然而FAT4调节TNBC的功能和分子机制仍不清楚。
该研究发现,FAT4在TNBC癌组织中相对表达水平较低,其表达水平与癌症的恶性生物学特性呈负相关,且癌组织中FAT4蛋白的相对表达水平是影响TNBC患者术后预后的独立预后因素。说明FAT4可能在TNBC发生发展中扮有重要作用,其是否可作为预后预测因子或潜在诊治靶点,有待进一步研究。
