颈部异位胸腺瘤1例报道并文献复习
2020-06-12王海涛王培松金美善赵红光苏畅黄沛飞王贵民
王海涛,王培松,金美善,赵红光,苏畅,黄沛飞,王贵民
(吉林大学第一医院 1.甲状腺外科 2.病理科 3.核医学科,吉林 长春 130000)
颈部异位胸腺瘤(ectopic cervical thymoma,ECT)是由于胚胎期胸腺未能充分下降滞留于颈部所引起的一种极为少见的肿瘤[1],多表现为无痛、进行性增大的颈部肿物,以局部压迫症状为主,影像学检查常提示甲状腺下极或甲状腺后方占位,FNAC的诊断价值并未得到认可[2],手术仍是目前最佳的确诊和治疗方案,由于该病临床表现缺乏特异性,极易误诊为甲状腺或甲状旁腺来源肿物,因此熟悉本病的临床及病理特征、诊断要点有助于临床医生制订合理的治疗方案,避免误诊误治。我科曾收治例ECT患者。主因颈部肿物1年,进行性增大3个月入院,术前检查均未能明确肿瘤来源,后经手术病理证实为AB型胸腺瘤,本例患者结合相关文献报告如下。
1 病例报告
患者 女,51岁。因“发现颈部肿物1年,进行性增大3个月”入院。患者1年前无意中发现左颈前肿物,约蛋黄大小,自觉近3个月增大遂就诊,病程中无心慌、多汗、乏力,声音嘶哑、吞咽及呼吸困难等症状。既往史:无高血压及糖尿病病史,无肝炎结核病史,无恶性肿瘤病史。体检:气管颈前居中,甲状腺左叶下极前方可触及一肿物,约4.0 cm×3.0 cm大小,质硬,轻压痛,不随吞咽上下移动,甲状腺及右颈部未触及肿物。术前甲状腺功能5项、降钙素、癌胚抗原、甲状旁腺素和血钙均正常范围。超声提示(图1A):左颈前(甲状腺左叶下极部位)见一肿物回声,约39.5 mm×29.5 mm×25 mm,边界清楚,呈低回声,形状欠规则,内部回声不均;CDFI:肿物内及边缘见较丰富条状血流信号,并可探及动脉血流频谱,建议进一步检查。肺CT:未见明显异常。颈部增强CT提示(图1B):甲状腺左叶下方占位性病变,与甲状腺分界清晰,与食道左侧壁关系紧密,增强扫描可见不均匀强化。99mTc-MIBI SPECT/CT显示(图1C-D):15 min见甲状腺显影,甲状腺左叶下极下后方可见异常放射性增高区,CT见低密度影,大小 24.1 mm×29.7 mm×38 mm,部分层面与甲状腺左叶下极分界不清,2 h甲状腺影基本消退,该放射增高区依然存在。诊断意见:⑴ 甲状腺腺瘤;⑵ 功能亢进之甲状旁腺组织,建议结合病理学检查。鉴于肿物位于甲状腺背侧,为甲状旁腺疾病好发部位,同时99mTc-MIBI SPECT/CT阳性,因此考虑肿物来源于甲状旁腺可能性大。入院诊断:左侧颈前肿物(性质及来源待定),不除外无功能甲状旁腺癌。术中所见(图1E):甲状腺左叶下极下部背侧、喉返神经后方1枚肿物,约4.0 cm×3.0 cm×2.5 cm大小,实性,包膜完整,质硬,活动度欠佳,与甲状腺、喉返神经界限明显,与食管粘连紧密,左下甲状旁腺未探及。肿瘤切面呈黄白色,鱼肉状,未见明显包膜侵犯、钙化及坏死(图1F)。术中快速病理报告:恶性肿瘤(来源待定)。遂决定行左侧颈部肿物切除+左侧中央区淋巴结清扫术。术后石蜡病理回报:胸腺瘤AB型,有包膜,边界清,无外周脂肪组织浸润,脉管及神经未见肿瘤浸润,周边淋巴结未见肿瘤转移,HE染色可见大量胸腺瘤细胞及淋巴细胞共存(图2A);上皮细胞免疫组化结果:Ki-67(15%+),vimentin(+)(图2B),CK-pan(+)(图2C),CgA(-),PAX-8(-),SF1(-),Syn(-),TTF-1(灶状+),CK19(+),SMA(-),CK5/6(+),P63(+),CD34(-);淋巴细胞免疫组化结果:CD1a(+),CD99(+),TdT(+),CD3(+)。根据WHO发布的组织学分型标准及Masaoka分期系统,该肿瘤最终诊断为AB型 胸腺瘤 I 期,患者术后恢复良好,随访5个月未复发。
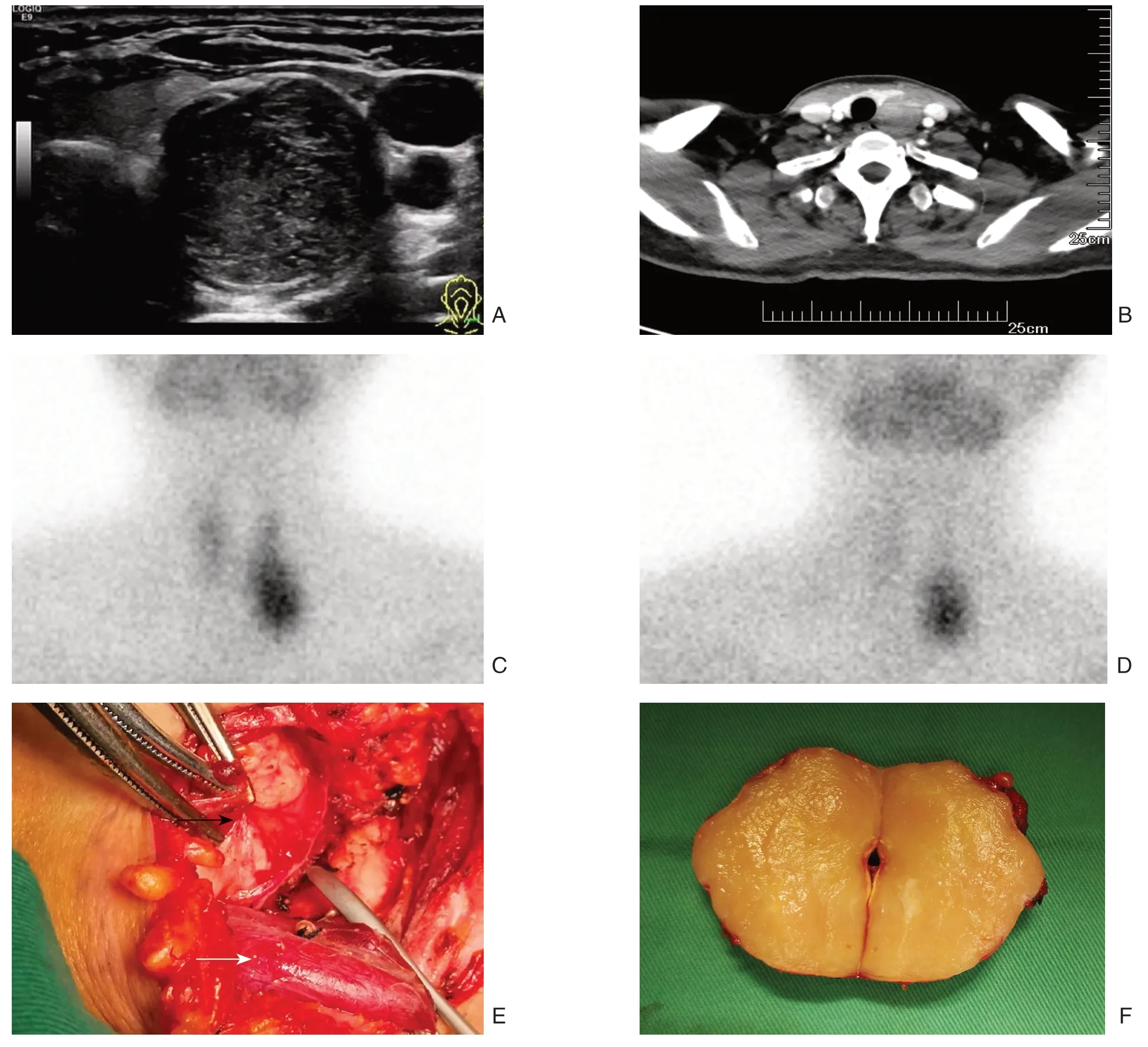
图1 术前检查及术中发现
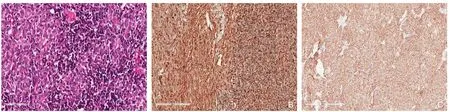
图2 术后病理结果
2 文献复习并讨论
2.1 胸腺瘤来源
胸腺从第三、四咽囊发育而来,并在胚胎的 第5~6周下降至前纵隔,90%的胸腺瘤好发于此[3],也可因胸腺异位或胚胎期下降不完全而发生于颈部或纵膈其他部位[4]。如甲状腺、后纵隔或中纵隔、肺和胸膜,约占所有胸腺瘤的4%[5]。约30%~50%的胸腺瘤患者有重症肌无力(MG)症状,但多数患者仅表现为局部压迫,甚至于胸部CT或冠脉造影中偶然发现[6]。其确诊依靠病理结果,手术完整切除是最佳的治疗方式,是否辅助放化疗取决于病理类型、局部浸润及转移情况。本例ECT患者最终接受了肿瘤的完整切除,且暂无复发。
2.2 临床特征
ECT是源自胸腺组织的上皮细胞肿瘤,临床罕见,发病率不足1%。通常发生在颈前区、甲状腺下极下方或甲状腺内,容易误诊为甲状腺或甲状旁腺病变[7]。1941年Boman[8]首次报道了ECT,据统计,纵膈胸腺瘤的发病率无性别差异,Chan等[9]报道的16例ECT患者中女性更常见(男女比例为1:7),平均发病年龄为42.7岁(11~71岁)。Peel等[10]报道甲状腺临近肿物是ECT最常见的首发症状,也可因局部压迫出现疼痛、呼吸不畅或上腔静脉综合征等,文献[11]报道:30例患者中仅有 3例(10.0%)ECT患者出现重症肌无力。ECT的大体和组织学特征与纵隔胸腺瘤基本相同,通常为一个良性的临床病程,副肿瘤综合征在ECT中少见,手术切除后转移和复发率均极低[12]。
2.3 诊断
术前细针穿刺细胞学(FNAC)用于ECT的诊断价值不高,据文献[13]统计,迄今只有14例ECT病例术前行FNAC并进行细胞学特征的描述。淋巴细胞和上皮细胞组成的双相细胞结构是ECT的典型病理学特征,但因为ECT罕见,常被误诊为恶性淋巴瘤[14]。Sadohara等[15]描述了低危胸腺瘤的CT表现,57%的低风险胸腺瘤边界清晰,90%无包膜,67%有同质特征,13%有间隔,13%有囊性或坏死成分。CT、MRI和99mTc-MIBI显像有助于ECT的诊断,99mTc-MIBI显像主要与细胞内线粒体含量有关,所以线粒体含量较高的恶性肿瘤也可摄取99mTc-MIBI,例如转移性肺癌、胸腺瘤、精原细胞瘤或淋巴瘤等[16]。文献[17]报道MRI对胸腺瘤包膜和间隔的显像较CT有优势,本例彩超及CT结果显示甲状腺下极部位的孤立结节,边界清晰,无坏死,增强CT可见肿物不均匀强化,99mTc-MIBI显像阳性,回溯这些影像学特征均符合ECT的表现。
2.4 病理
目前,ECT主要参照WHO组织学分类系统和Masaoka分期系统[18]。根据WHO组织学分类标准,A型胸腺瘤细胞呈梭形/椭圆形,核不典型性差,且分裂像低,缺乏不成熟的TdT阳性T细胞;B型胸腺瘤细胞多呈多角形,进一步可分为3种亚型。B1型以淋巴细胞为主,B3型中上皮细胞占优势,B2型介于B1与B3之间。Masaoka分期系统主要依据原发肿瘤的局部浸润程度。肿瘤局限在包膜内为I期,镜下穿透包膜浸润周边脂肪组织为IIa期,肉眼可见侵犯周边脂肪组织、但未侵犯至纵膈胸膜为IIb期,镜下侵犯临近器官(心包、大血管、肺)为III期,胸膜或心包播散为IVa期,IVb期为有远处器官转移者。本例肿瘤局限于包膜内,同时有A型、B型的病理学特征,且A型占主导,最终确诊为AB型,I期。
2.5 治疗及预后
手术切除是治疗ECT的首选方法,Yokoyama等[19]对类似的ECT病例进行了颈部淋巴结清扫术和胸腔镜下胸腺切除。Peel等[10]更倾向在确保完整切除肿瘤的同时尽量采用微创手术方式,如仅行异位胸腺瘤的局部切除。对Masaoka II、III期胸腺瘤完整切除后,可从辅助放疗中获益,以降低局部复发率[20]。目前大多数化疗试验为病例报告或 II期临床试验,尚无大规模前瞻性随机试验来比较不同的化疗药物效果。判断ECT预后最重要的因素是肿瘤分期、WHO组织学类型和手术切除的完整性,该患者确诊为AB型胸腺瘤I期,总体出良性的临床行为,因此完整切除肿瘤后,未行其他辅助治疗。
2.6 诊治体会
虽然ECT罕见,临床上遇到来源不明的颈部肿物应警惕ECT的可能。但由于术前FNA诊断价值有限,故需要结合CT、MRI和99mTc-MIBI SPECT等检查综合判断。甲状腺背侧肿物往往需要与甲状旁腺肿物鉴别,甲状旁腺功能亢进一般伴有PTH升高,无功能性甲状旁腺肿瘤罕见,所以如血清PTH正常,而99mTc-MIBI SPECT阳性时,需要考虑是ECT导致的假阳性。必要时可以考虑FNA+洗脱液检查或者手术活检。治疗上,Masaoka I期ECT建议仅行肿瘤切除,II期以上建议扩大手术范围并给予辅助放化疗。
