甲状腺癌合并糖尿病患者的临床病理特征分析
2020-06-12邓媛媛柯飒刘慧霞萧梅芳章鑫旭向娟蒲颖
邓媛媛,柯飒,刘慧霞,萧梅芳,章鑫旭,向娟,蒲颖
(中南大学湘雅医院 1.老年内分泌科 2.健康管理中心,湖南 长沙 410008)
甲状腺癌(thyroid cancer,TC)不仅是内分泌最常见的恶性肿瘤之一,且已经成为现阶段发病率增长最快的恶性肿瘤[1]。糖尿病(diabetes mellitus,DM)已经成为全球的公共卫生难题,目前DM及其并发症、合并症是医疗领域的研究热点[2]。已有研究[3-4]证实,DM与多种恶性肿瘤的发生、发展存在关联。TC是头颈部最常见的恶性肿瘤,随着人们健康意识的提高和甲状腺超声检查与细针穿刺活检广泛应用,TC的发病率逐年攀升,我国近年的发病率增长了223.75%[5]。甲状腺癌的病因多,发病机制复杂。研究[6-7]显示,TC常见的危险因素是患病年龄、性别、种族和遗传易感性,但是合并代谢综合征、环境致癌物、饮食习惯、放射线接触史、生活方式等可能成为TC发病的其他重要的危险因素。DM与TC均是内分泌常见疾病,已有研究证实,DM对于恶性肿瘤的影响是多方面的,导致恶性肿瘤的相关原因有氧化应激损伤、多种炎症因子聚集、肿瘤坏死因子α升高、胰岛素抵抗等[8-12],且DM患者空腹血糖持续升高≥7.0 mmol/L,即可增加肝细胞癌、胆管细胞癌等患病率[13]。
笔者前期研究[14]结果表明,DM患者较健康人群TC发病率增加,随着研究的深入,研究人员[15-17]发现在TC细胞和组织中胰岛素受体(insulin receptor,IR)经常过表达,一方面,在IR作用下,有丝分裂原激活的蛋白激酶(mitogenactivated protein kinase,MAPK)途径将被激活以促进细胞增殖,另一方面,胰岛素通过调节胰岛素样生长因子(insulin-like growth factor,IGF)系统在肿瘤发生中发挥间接作用血清胰岛素水平高会导致IGF-1水平升高,胰岛素抵抗可能是TC发生的早期事件并伴随TC患者肿瘤的发生、进展及转移的全过程。此外,有研究[18-19]发现,与正常组织相比,TC细胞分泌VEGF(vascular endothelial growth factor,VEGF)明显升高,而DM和雌激素可也会引起VEGF的升高,诱导TC细胞的生长与迁移[20]。
根据甲状腺超声影像报告和数据系统(thyroid imaging reporting and data system,TI-RADS),DM患者与健康人群相比,其甲状腺结节的TI-RADS 4a、4b、4c类甲状腺结节的恶性率也更高[21]。这表明在TC患者合并DM的情况下,“过度诊断”无法解释以上所有发现。但DM血糖控制情况对TC的临床病理因素影响研究结果不一,本研究旨在探讨TC合并DM血糖控制情况对TC临床病理因素的影响。
1 资料与方法
1.1 研究对象
收集中南大学湘雅医院2016年1月—2019年10月期间住院行TC手术患者共计1 064例。其中 245例为TC合并DM患者(TC+DM组),年龄19~77(48.75±11.63)岁;819例为单纯TC患者(TC组),年龄19~78岁,(46.27±11.74)岁。收集同期中南大学湘雅医院健康体检中心体检健康人群604例(健康对照组),年龄22~77岁,平均(44.09±11.00)岁。
1.2 研究指标与方法
一般资料:性别、年龄、体质量指数(BMI)。血生化指标:⑴ DM相关指标:空腹血糖(fasting plasma glucose,FBG)、餐后2 h血糖(2-hour post-meal blood glucose,PBG)、糖化血红蛋白(glycated hemoglobin,HbA1c);⑵ 甲功三项:促甲状腺激素(thyroid stimulating hormone,TSH)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4);⑶ 肿瘤标志物:甲胎蛋白(α-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、神经元特异性烯醇化酶(neuron specific enolase,NSE)。甲状腺B超:TI-RADS分级、结节个数、结节是否规则、有无钙化;均根据本院影像科专科医师所发甲状腺B超报告。临床病理资料:病理组织检查结果、肿瘤最大直径、TNM分期、颈部淋巴结转移个数、是否远处转移、包膜是否侵犯、食管是否受侵、病理微血管癌栓均根据手术标本病理确诊结果。
1.3 诊断标准
DM的诊断根据世界卫生组织1999年诊断标准[22]。TC的诊断符合手术病理活检结果。临床病理分期根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)颁发的第8版TC分期标准[23]。DM合并TC患者需要同时满足DM的诊断标准及TC的诊断标准。排除标准:⑴ 继发性DM或应激性血糖升高以及糖皮质激素等药物所致的血糖升高;⑵ 严重心、肺、肝、肾功能不全的患者。
1.4 统计学处理
实验数据采用SPSS 22.0进行统计学分析和图表制作,计量资料满足正态分布,采用均数±标准差(±s)表示;组间比较采用方差分析,LSD检验;计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组患者一般资料比较
健康对照组、TC组、TC+DM组中的女性占比及年龄依次增大,差异均有统计学意义(均P<0.05);TC+DM组BMI明显大于TC组与健康对照组(均P<0.05),而TC与健康对照组的BMI无统计学差异(P>0.05)(表1)。

表1 TC+DM组、TC组与健康对照组一般资料Table1 General data of TC+DM group,TC group and healthy control group
2.2 各组血液生化指标比较
TC+DM组与TC组的TSH、NSE水平均较健康对照组明显升高,且TC+DM组较TC组升高程度更为明显(均P<0.05);TC+DM组的FBG、PBG、HbA1C水平均较TC组与健康对照组明显升高(均P<0.05),而后两组间无统计学差异(均P>0.05);FT3、FT4及AFP、CEA水平在3组间均无统计学差异(均P>0.05)(表2)。
表2 TC+DM组、TC组与健康对照组生化指标比较(±s)Table2 Comparison of biochemical indicators among TC+DM group,TC group and healthy control group (±s)
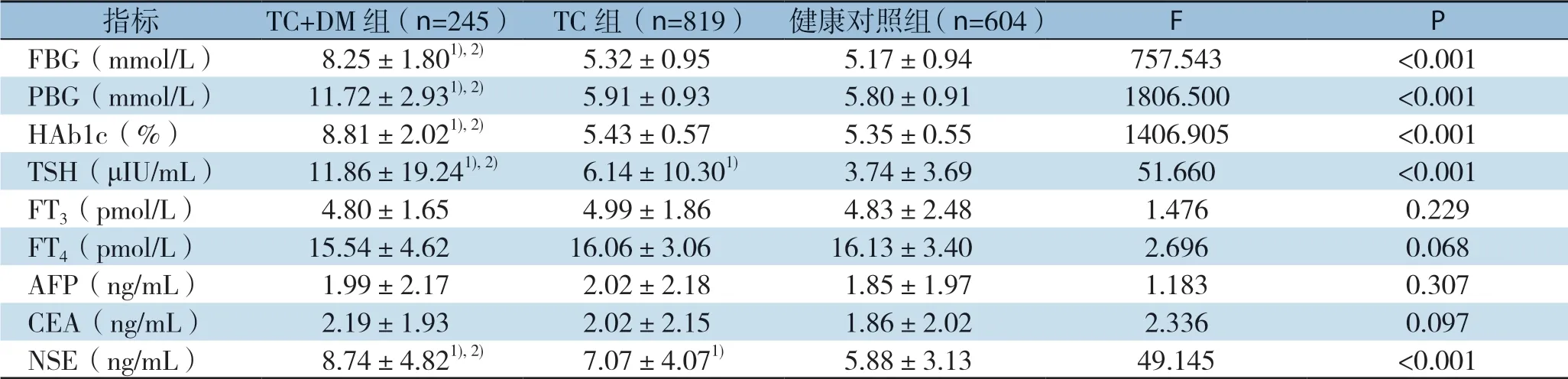
表2 TC+DM组、TC组与健康对照组生化指标比较(±s)Table2 Comparison of biochemical indicators among TC+DM group,TC group and healthy control group (±s)
注:1)与对照组比较,P<0.05;2)与TC组比较,P<0.05Note:1) P<0.05 vs.healthy control group; 2) P<0.05 vs.TC group
指标 TC+DM组(n=245) TC组(n=819) 健康对照组(n=604) F P FBG(mmol/L) 8.25±1.801),2) 5.32±0.95 5.17±0.94 757.543 <0.001 PBG(mmol/L) 11.72±2.931),2) 5.91±0.93 5.80±0.91 1806.500 <0.001 HAb1c(%) 8.81±2.021),2) 5.43±0.57 5.35±0.55 1406.905 <0.001 TSH(μIU/mL) 11.86±19.241),2) 6.14±10.301) 3.74±3.69 51.660 <0.001 FT3(pmol/L) 4.80±1.65 4.99±1.86 4.83±2.48 1.476 0.229 FT4(pmol/L) 15.54±4.62 16.06±3.06 16.13±3.40 2.696 0.068 AFP(ng/mL) 1.99±2.17 2.02±2.18 1.85±1.97 1.183 0.307 CEA(ng/mL) 2.19±1.93 2.02±2.15 1.86±2.02 2.336 0.097 NSE(ng/mL) 8.74±4.821),2) 7.07±4.071) 5.88±3.13 49.145 <0.001
2.3 TC+DM组与TC组临床病理因素比较
两组患者肿瘤直径、N分期(淋巴结转移)、M分期(远处转移)均有统计学意义(均P<0.05)。而T分期(肿瘤浸润深度、肿瘤大小)、包膜侵犯、食管侵犯、血管癌栓情况、临床病理分期差异无统计学意义(均P>0.05)(表3)。
2.4 TC+DM组与TC组甲状腺B超TI-RADS分级比较
两组患者甲状腺结节分度、结节个数差异有统计学差异,TC+DM组患者4c类和5类结节比例较高,且TC+DM组患者以多发甲状腺结节为主(均P<0.05)。而两组患者甲状腺结节形态、结节钙化无统计学差异(均P>0.05)(表4)。
2.5 不同血糖控制水平TC合并DM患者的临床病理因素比较
进一步以HbA1c水平将TC合并DM患者分为低HbA1c组(HbA1c<7%,162例)与高HbA1c组(HbA1c≥7%,83例)。比较两组患者临床病理资料,结果显示,两组M分期之间有统计学差异,高HbA1c组存在更高比例的远处转移(P<0.05)。两组患者的T分期、N分期、临床病理分期、肿瘤直径、食管侵犯、包膜浸润、血管癌栓等均无统计学差异(均P>0.05)(表5)。
2.6 不同血糖控制水平TC合并DM患者甲状腺B超TI-RADS分级比较
低HbA1c组与高HbA1c组患者TI-RADS分级示,高HbA1c组患者的多发结节比例更高(P<0.05)。两组患者甲状腺结节分度、结节形态、结节钙化情况差异无统计学意义(均P>0.05)(表6)。
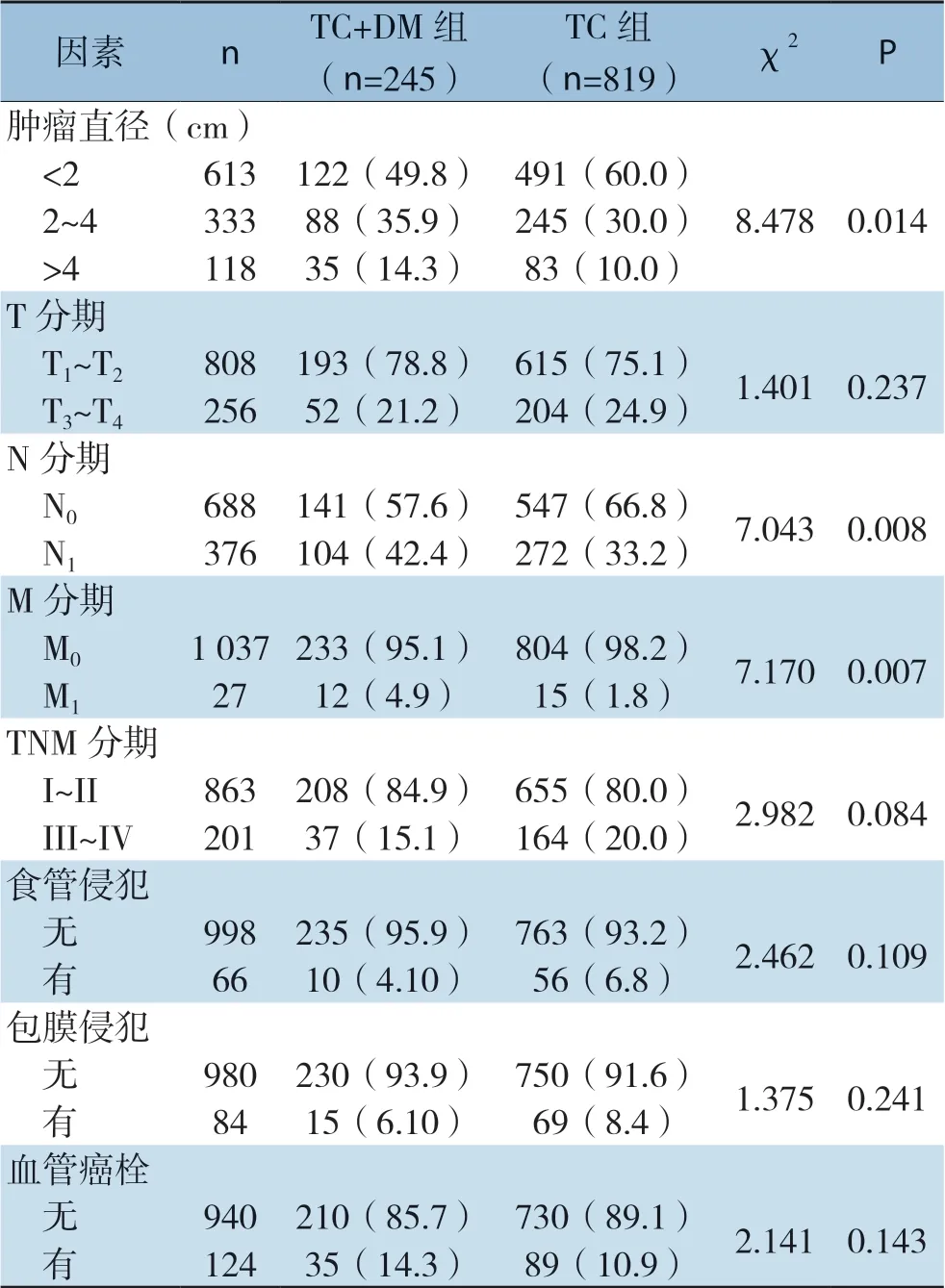
表3 TC+DM组与TC组临床病理因素比较[n(%)]Table3 Comparison of clinicopathologic factors between TC+DM group and TC group [n (%)]

表4 DTC组与TC组TI-RADS分级比较[n(%)]Table4 Comparison of TI-RADS classifications between TC+DM group and TC group [n (%)]
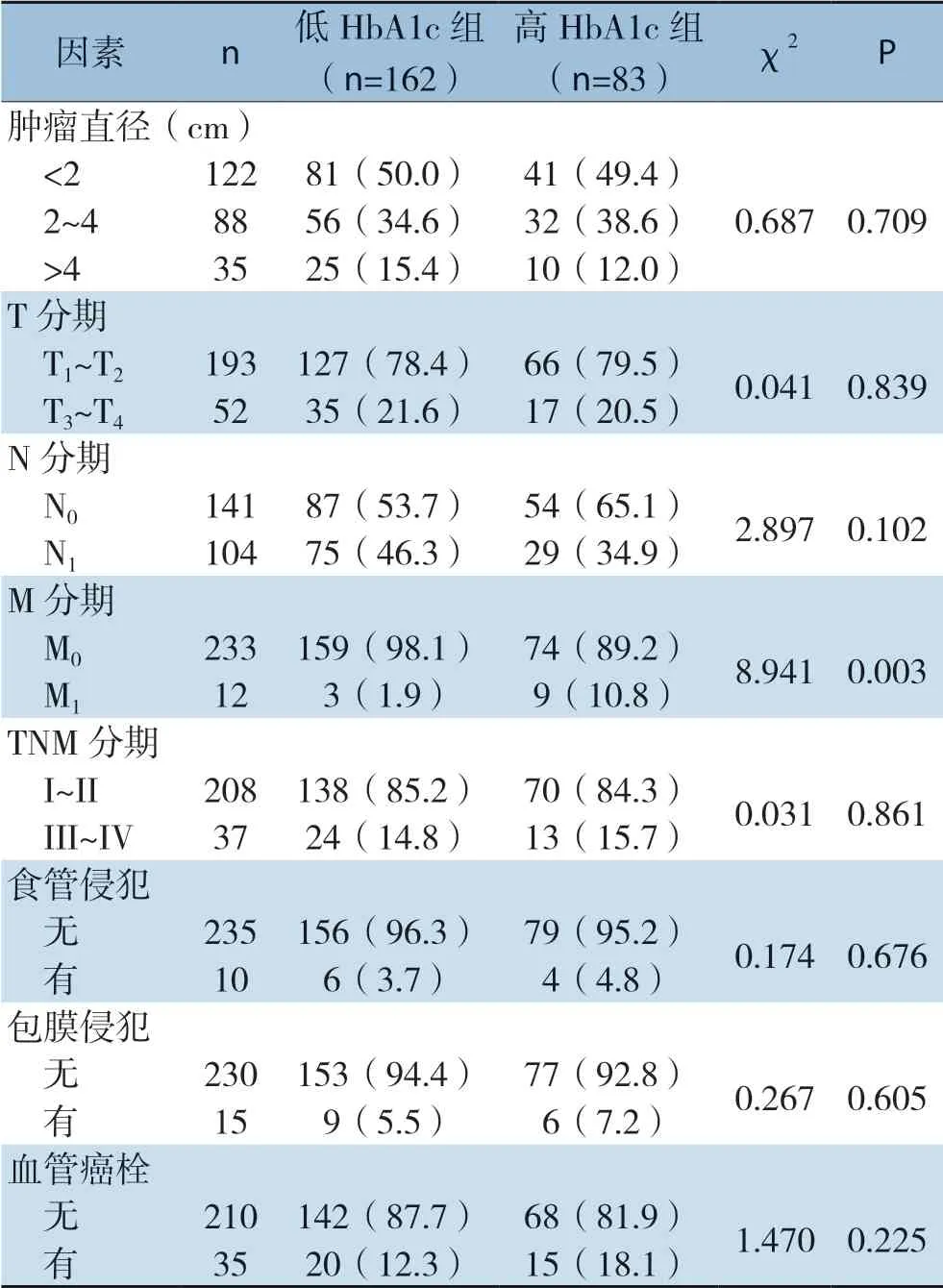
表5 不同血糖控制水平TC合并DM患者临床病理因素比较[n(%)]Table5 Comparison of clinicopathologic factors between TC plus DM patients with different blood sugar control profiles [n (%)]
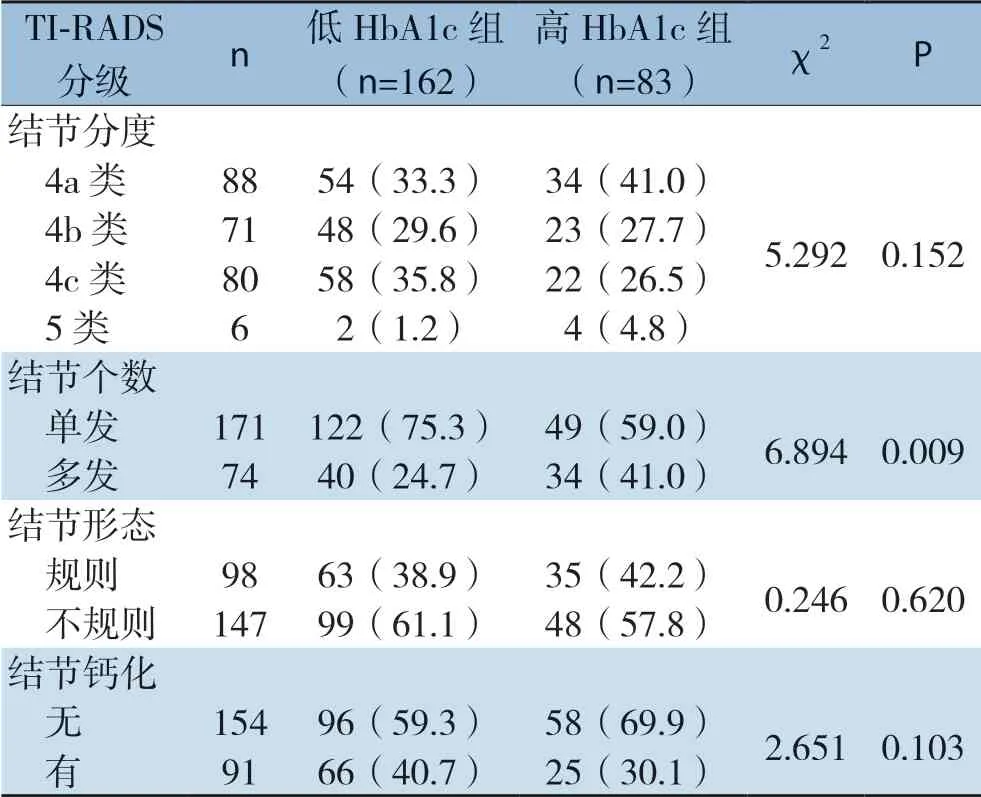
表6 DTC1和DTC2组甲状腺B超结果比较[n(%)]Table6 Comparison of thyroid ultrasound findings between TC plus DM patients with different blood sugar control profiles [n (%)]
2.7 病理检查结果
本组1 064例中,乳头状甲状腺癌(papillary thyroid carcinoma,PTC)1 056例(99.2%);滤泡状甲状腺癌(follicular thyroid carcinoma,FTC)4例(0.4%);甲状腺髓样癌(medullary thyroid carcinoma,MTC)4例(0.4%),且TC合并DM患者均为PTC。
3 讨 论
近年全世界范围内TC的患病率在不断攀升,在我国特别是沿海经济较发达地区的患病率近10年来已经增长了3倍[24-25]。随着甲状腺超声检查和细针穿刺活检广泛运用,能够精确检测到<1 cm的微小型TC[26-27],但增长如此之快的患病率同时也反映了TC多种致癌因素的变化。DM是常见的内分泌疾病,近年来的大量研究均提示DM与肿瘤的发生发展密切相关,但DM可能作为TC的一项独立的危险因素起作用[21]。
研究[28-29]结果表明,DM患者TC的发生率显著上升,而TC患者若合并DM则更容易出现淋巴结转移和远处转移,其预后也相对较差。TC的发生与进展与机体糖代谢、脂代谢、维生素代谢等有明显的相关性,而以糖代谢异常为主要表现的DM患者较正常人群有更高的TC风险,甲状腺组织细胞癌变的前期表现为细胞中IGF-1,IGF-2和IR的过表达,这些受体在细胞转化,增殖和凋亡过程中有重要的作用[30]。
有研究发现性别、年龄是TC患病的危险因素[14],已有研究[31]显示,TC细胞雌激素受体的过表达可能是女性出现高TC发病率的原因之一,雌激素能够增强目标基因转录,从而导致TC肿瘤细胞增殖与分化。女性TC的患病率在25岁以后与年龄的增长呈现正相关,至绝经前出现第一次高峰,绝经后至65岁出现第二次高峰[32]。但近期发现,PTC和FTC的发病年龄较其他肿瘤相比也有了年轻化趋势[33]。本研究结果表明,合并DM女性患者患TC风险更高,并与年龄相关。进一步发现,在无DM的TC患者中BMI与对照组无统计学差异,而DTC组BMI明显增加,考虑糖尿病患者肥胖以及导致的胰岛素抵抗可能促进TC的发生发展。此外,本研究还发现,TC合并DM的患者淋巴结转移及远处转移比例较单纯TC患者明显增多,尤其血糖控制欠佳患者(Hab1c≥7.0%)有更高的远处转移率,因此对于TC患者的预后产生不利的影响。由此可以推测,DM可能会使TC患者面临更高的转移风险。另外还有研究显示[34],TC合并DM患者常出现双侧多发癌结节,且易出现微小癌结节及钙化。
本研究发现TC组较健康对照组TSH升高,而TC+DM组患者较TC组患者TSH水平进一步升高,TSH是TC细胞的敏感的生长因子[35-36],可刺激和诱导甲状腺细胞分化和增殖。TSH在没有生长因子的情况下,其促肿瘤发生作用明显减弱,在DM患者中,由于胰岛素抵抗导致高胰岛素血症使胰岛素和/或IGF-1可极大的增强TSH的生理作用[37]。在TC组织中,IR受体主要表达为胰岛素受体A(insulin receptor-A,IR-A),IR-A的过度表达是未分化TC或干细胞样TC细胞的特征。IR-A不仅与胰岛素以高亲和力结合,还可以与癌细胞以自分泌方式产生的IGF-2结合,这种异常结合环的激活在肿瘤进展,去分化和肿瘤耐药中具有重要作用[38]。有研究[39]通过电子显微镜发现DM大鼠模型甲状腺滤泡组织主要表现为低功能滤泡,也印证了这一推测。
NSE是一种主要存在于神经元和神经内分泌细胞中的烯醇化酶基因超家族蛋白,因NSE对小细胞肺癌及神经内分泌肿瘤有较高特异性,常运用于临床作为其的诊断指标之一[40]。本研究发现,TC合并DM患者的NSE水平较TC患者升高,但均未超过正常范围,已有研究[41]显示,血清NSE水平与DM患者周围神经病变相关,可能的机制为:DM患者微循环障碍,导致机体出现血-神经屏功能障碍,甚至导致屏障被破坏。同时DM患者糖代谢障碍,进一步使得血-神经屏障处于缺血、缺氧状态中,持续的血-神经屏障功能异常,可导致血清NSE从中逃逸,使血清NSE水平升高。提示该指标可能对监测DM患者周围神经病变的发展有临床意义,但在DM合并TC患者中的具体临床意义,尚需进一步研究。
研究[42]表明甲状腺B超对甲状腺的诊断有重要作用。本研究首次比较了TC是否合并DM患者中以及血糖控制好坏与甲状腺B超TI-RADS分级的差异,结果表明,TC合并DM患者中肿瘤直径更大,其中4c类和5类结节比例较单纯TC患者更高,以多发甲状腺结节为主,且高HbA1c组患者出现甲状腺双侧结节比例高于低HbA1c组患者。这提示TC合并DM患者甲状腺结节恶性风险度评估更高,且血糖控制水平与甲状腺结节的发生也有关系。本研究中所有TC患者均以4a类结节最多,因此TIRADS分级中4a类结节需定期行甲状腺B超复查和进一步甲状腺穿刺活检排除甲状腺癌。有研究[43]发现,DM与甲状腺结节的发生显著相关,同时甲状腺结节恶性率与DM病程、血糖控制水平、DM并发症严重程度有关。甲状腺结节的大小与胰岛素抵抗的严重程度、结节内血管密度呈正相关。DM患者多存在较严重的胰岛素抵抗和全身炎症反应,促进甲状腺结节的生长、钙化等多种演变[43]。
本研究所收集的1 064例TC患者中经病理学检查确诊,其中99.2%为PTC,FTC和MTC分别为0.4%,而TC合并DM患者均为PTC,本研究结果对于进一步开发PTC诊治思路提供了临床病理依据。PTC虽然生物学行为上属于相对比较“良性”,但仍然存在侵袭、转移的恶性表现,目前对于一些失去手术机会的晚期PTC患者,尤其是131I治疗失效的患者,尚无明确安全有效的治疗方法。已有研究[44]通过指数富集配体系统进化技术筛选出了PTC特异性核酸适体TC-6,对于进一步开展PTC特异性靶向治疗成为可能。因FTC和MTC病例数过少,统计学上可能存在较大误差,所以本研究暂未涉及两组患者病理学差异的比较分析。未来笔者将进一步扩大样本量,特别是增加FTC、MTC及ATC的数量,深入研究FTC、MTC及ATC合并DM患者的临床病理数据和预后的差异分析,为其临床决策提供参考。
综上,女性及高龄DM患者患TC风险增加。合并DM的TC患者TI-RADS分级更高,易出现多发结节,淋巴结转移和远处转移风险更高。在TC合并DM患者中,血糖控制不佳的患者有更高的远处转移率及多发结节率,故此类患者应积极控制血糖,避免远处转移及多发结节。
