SO2与AgNO3溶液反应的实验探究
2020-06-11王春
王春


摘要: 对2019年北京高考理综卷第28题有关SO2与AgNO3溶液反应进行试题分析,结合相关文献提出几点问题思考;通过设计多组实验方案对SO2与AgNO3溶液反应生成沉淀的成分及上层清液中存在的离子种类进行实验探究,得出SO2与AgNO3溶液反应生成的沉淀主要为Ag2SO3和少量Ag、溶液中存在SO2-
4和[Ag(SO3)2]3-的实验结论。
关键词: SO2气体; AgNO3溶液; [Ag(SO3)2]3-配离子; 实验方案设计; 实验探究
文章编号: 10056629(2020)05007503
中图分类号: G633.8
文献标识码: B
1 问题的提出
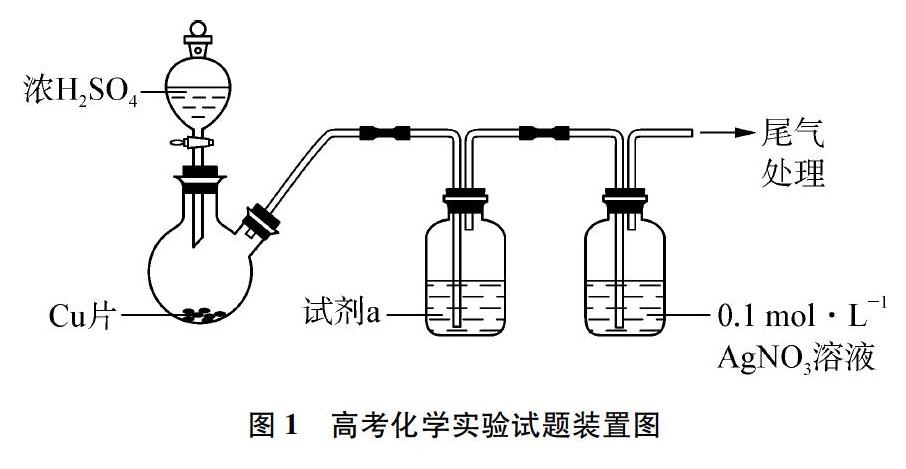
2019年北京高考理综卷化学科第28题借助如图1所示实验装置,探究SO2与AgNO3溶液反应生成沉淀的成分及反应后溶液中离子的成分。本试题中描述到: 当用图1所示装置(夹持、加热仪器略)制备SO2,经试剂a(饱和NaHSO3溶液)进行洗气后,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。试题首先围绕白色沉淀的成分可能为Ag2SO3或Ag2SO4或二者的混合物进行问题设置,试题给出的答案为足量SO2通入AgNO3溶液反应只生成Ag2SO3沉淀;试题接着在对溶液A的成分探究中指出当向溶液A中滴入过量盐酸,产生白色沉淀,取上层清液继续滴加BaCl2溶液,未出现白色沉淀,试题给出的答案为溶液中含有Ag+,不存在SO2-4[1]。本试题综合考查了学生运用元素及其化合物知识解决问题的能力,全面检测了学生对化学实验方案的分析评价及实验探究能力。笔者通过查阅相关文献分析SO2与AgNO3溶液一方面能发生沉淀反应,另一方面因为SO2气体具有较强的还原性,AgNO3溶液具有较强的氧化性,二者发生氧化还原反应的趋势较大,生成Ag2SO3沉淀同时应含有Ag单质。另外,反应后的溶液中银元素很难以Ag+形式存在,而应以配离子[Ag(SO3)2]3-形式存在,同时因为SO2与AgNO3溶液发生氧化还原反应,溶液中还应存在SO2-4。笔者与部分高中化学教师就上述问题进行交流时发现,很多教师对SO2与AgNO3溶液反应生成的沉淀成分和反应后的溶液中含有的离子成分尚不能给出明确的答案。为了能较为全面地探讨SO2与AgNO3溶液反应生成的沉淀成分和反应后溶液中离子的种类,笔者特进行如下相关实验的设计和探究。
2 二氧化硫与硝酸银溶液反应生成沉淀成分探究
2.1 实验设计
为探究SO2与AgNO3溶液反應生成沉淀的成分,笔者按照图1所示装置制取SO2气体,并用饱和NaHSO3溶液对气体进行洗气除杂。经多次实验发现所制得的气体中均含有SO2-4,分析原因一为用图1装置制取的SO2气体中带有硫酸酸雾(SO3+H2O),饱和NaHSO3溶液(试剂a)不能完全除去酸雾;二为实验室所配制的NaHSO3溶液因NaHSO3容易被氧化,很难得到纯净的溶液,经实验检验其中一般会混有硫酸盐,导致制取的SO2气体即使通过饱和NaHSO3溶液进行洗气,也很难得到纯净的SO2气体。为此,笔者对上述实验进行改进: 在通风橱中,向集气瓶中倒入一定体积的事先用煮沸的蒸馏水配制的0.1mol/L AgNO3溶液,向其中放入一粒磁子,然后将集气瓶放在磁力搅拌器上。用装有一定量硫磺粉的玻璃燃烧匙在盛有一定体积的AgNO3溶液的集气瓶中燃烧,并打开磁力搅拌器进行搅拌,在集气瓶口盖上玻璃片,让产生的SO2气体与AgNO3溶液快速均匀地发生反应,溶液中迅速产生大量白色沉淀。实验装置如图2所示。
为了检验SO2与AgNO3溶液反应生成白色沉淀的成分,本实验采取对比研究的方法,设计了表1所示实验方案。
2.2 实验分析与结果
2.2.1 实验分析
通过上述实验可知,SO2与AgNO3溶液能发生反应生成大量白色沉淀,白色沉淀的成分为Ag2SO3还是Ag2SO4呢?笔者查阅相关资料表明[2]: 室温时,SO2在水中溶解度为12.14g,经计算,此时溶液中c(SO2-3)=1.07×10-7mol/L。当向2mL 0.1mol/L AgNO3溶液中通入SO2时,溶液中: c(Ag+)2c(SO2-3)=(0.1mol/L)2×1.07×10-7mol/L=1.07×10-9(mol/L)3>Ksp(Ag2SO3),故理论上将SO2气体通入0.1mol/L的AgNO3溶液中能生成Ag2SO3白色沉淀。另外查阅相关数据知: Ksp(Ag2SO4)=1.4×10-5;Ksp(Ag2SO3)=1.5×10-14。Ag2SO3的溶度积远远小于Ag2SO4的,说明SO2与AgNO3溶液反应过程中Ag2SO3更易于生成,即发生的反应为: SO2+H2O+2AgNO3Ag2SO3↓+2HNO3[3]。
通过表1中设计的实验方案与探究可知,SO2与AgNO3溶液反应除了生成白色的沉淀外,还有灰色沉淀物生成,经过浓氨水进行洗涤后,沉淀量减少,但仍有灰黑色不溶物,向不溶物中加入浓硝酸,产生红棕色气体,说明沉淀中有单质Ag生成,即SO2与AgNO3溶液除发生沉淀反应生成Ag2SO3外,SO2与水反应生成的H2SO3进一步与Ag2SO3发生氧化还原反应,将Ag2SO3还原为单质Ag,即发生的反应为: Ag2SO3+H2SO32Ag↓+H2SO4+SO2↑。
2.2.2 实验结果
通过以上实验分析可以得出如下实验结论: SO2与AgNO3溶液能发生反应,主要反应为SO2与AgNO3溶液间的沉淀反应,反应生成Ag2SO3沉淀而不是Ag2SO4沉淀,同时还有部分SO2与Ag2SO3发生氧化还原反应生成单质Ag,因此沉淀的成分为Ag2SO3和单质Ag。
3 SO2与AgNO3溶液反应后溶液离子种类探究
3.1 实验设计
为进一步探究SO2与AgNO3溶液反应后溶液体系中含有离子的成分,设计了如表2所示实验方案进行探究。
3.2.2 实验结果
通过以上实验分析可以得出如下实验结论: SO2气体与AgNO3溶液发生反应的溶液体系中,因AgNO3溶液与SO2气体反应生成的Ag2SO3沉淀与SO2-3进一步发生反应生成[Ag(SO3)2]3-,溶液中银元素不是以Ag+形式存在,而是以配离子[Ag(SO3)2]3-形式存在;另外,SO2与水反应生成的H2SO3还与Ag2SO3发生氧化还原反应,使溶液中有少量SO2-4存在。
致谢: 衷心感谢首都师范大学附属丽泽中学郑晓红老师对本实验研究给予的支持和帮助!
参考文献:
[1]天利全国考试命题中心. 2019年全国各省市高考试题汇编全解[M]. 拉萨: 西藏人民出版社, 2019.
[2]徐泓, 沈艳, 吴宣东等. 由2013年北京理综卷第28(3)题引发的探究和思考[J]. 化学教学, 2014, (7): 93~96.
[3]马辉, 杨天足, 刘伟等. 亚硫酸钠从含银废液中还原银的研究[J]. 贵金属, 2009, (2): 7~10.
