LncRNA LINC00152过表达在替莫唑胺诱导脑胶质瘤干细胞周期阻滞中的作用机制探讨
2020-06-11张良龙安宏伟赵立智高桂艳
张良龙,安宏伟,赵立智,董 倩,高桂艳
1.沧州市人民医院神经外科,河北 沧州 061000;
2.德州市陵城区中医院神经外科,山东 德州 253500
脑胶质瘤是常见的颅内原发性恶性肿瘤,患者的中位生存期仅为15~19个月[1-2]。替莫唑胺(temozolomide,TMZ)属第二代烷化剂类抗肿瘤药物,不经过肝脏代谢、易于通过血脑屏障进入脑脊液,能引起脑胶质瘤细胞周期阻滞和凋亡,疗效确切[3]。但TMZ单独使用对恶性脑胶质瘤的有效率仍不足50%,这是临床治疗所面临的严重挑战。LINC00152是异常表达于肝癌、胃癌及结肠癌等恶性肿瘤中的长链非编码RNA(long non-coding RNA,lncRNA)之一,参与细胞增殖、迁移及转移等生物学行为[4-6]。最新研究显示,LINC00152与脑胶质瘤患者不良预后相关,下调LINC00152基因表达可抑制脑胶质瘤细胞的体内生长[7]。还有研究显示,上调LINC00152可促进胶质瘤细胞侵袭[8],提示LINC00152参与胶质瘤细胞的恶性生物学行为。脑胶质瘤干细胞(glioblastoma stem cell,GSC)是存在于脑胶质瘤中的一类细胞,具有自我更新迅速、无限增殖及多向分化潜能[9]。并且GSC与神经干细胞类似,在脑胶质瘤耐药和复发中起到关键性作用[10],但LINC00152与TMZ诱导的GSC周期阻滞的关系尚未见报道。本研究以神经干细胞培养液培养脑胶质瘤U251细胞,提取成球生长的GSC作为研究对象,以重组LINC00152基因慢病毒表达载体转染GSC,获得过表达LINC00152的GSC,并以嘌呤霉素筛选过表达LINC00152的细胞株,观察LINC00152在TMZ诱导GSC周期阻滞中的作用及其机制。
1 材料和方法
1.1 细胞株及主要试剂
人脑胶质瘤U251细胞购自中国科学院典型培养物保藏委员会细胞库;TMZ(货号34219)购自美国Sigma公司;胎牛血清(fetal bovine serum,FBS)、MEM全培养基、无血清干细胞MEM培养基、PBS、重组碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和表皮生长因子(epidermal growth factor,EGF)购自美国Gibco公司;CD133抗体(货号64326S)和Oct-4抗体(货号2750S)购自美国CST公司;GAPDH抗体(货号AP0063)、抗兔IgG-HRP二抗(货号BS13278)、抗小鼠IgG-HRP二抗(货号BS12478)购自南京巴傲得生物科技有限公司;总蛋白提取试剂盒和细胞裂解液购自上海碧云天生物技术有限公司;聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜购自美国Millipore公司;LINC00152慢病毒表达载体转染试剂盒购自上海吉凯基因化学技术有限公司。
1.2 细胞培养、GSC提取
U251细胞以含15%FBS及1%青链霉素的MEM培养基培养细胞放置于37 ℃、CO2体积分数为5%的培养箱中。将U251细胞转至无血清的神经干细胞培养液(含20 pg/L bFGF和20 pg/L EGF)中并加入B27补充剂培养并分离GSC。
1.3 免疫荧光鉴定GSC标志蛋白表达
GSC在4%多聚甲醛中固定30 min后,室温下用Triton X-100透核膜10 min。用含5%牛血清白蛋白(bovine serum albumin,BSA)的PBS封闭2 h,于4 ℃下温育一抗CD133(1∶400)和Oct-4(1∶500)过夜,同时以4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染核。室温温育荧光二抗2 h,PBS洗片后应用荧光显微镜观察拍照。
1.4 构建LINC00152过表达细胞株
以重组LINC00152基因慢病毒表达载体转染GSC细胞构建LINC00152过表达细胞株,设立过表达(LV-LINC00152)组和空载对照(LV)组,同时以正常GSC作为空白对照组。将U251细胞以每孔3×106个接种于6孔板中,当细胞汇合度达50%时进行转染。转染前配制病毒稀释液,各配备两管1 mL含10 μg/mL聚凝胺的MEM全培养基,分别加入100 μL重组LINC00152基因慢病毒原液和空载病毒原液,轻轻混匀。LVLINC00152组加入重组LINC00152基因慢病毒稀释液,LV组加入空载病毒稀释液,空白对照组细胞加入等量培养基,在37 ℃、CO2体积分数为5%的条件下过夜培养,12 h时更换为MEM全培养基,继续培养至对数期传代,嘌呤霉素筛选稳定过表达LINC00152的细胞株。
1.5 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测LINC00152表达水平
收集LV-LINC00152组、LV组和空白对照组细胞,TRIZOL法提取细胞总RNA,用酶标仪对各组细胞总RNA浓度进行定量,各取1 μg进行反转录,稀释cDNA至500 μL,充分混匀备用。各引物按正向引物与反向引物1∶1稀释,利用SYBR Premix Ex TaqTM Ⅱ在ABI 7300型RTFQ-PCR系统中进行扩增,反应条件:95 ℃10 s,95 ℃ 10 s,60 ℃ 60 s,共40个循环,每组设置6个复孔。2-△△Ct法计算LINC00152的相对表达水平。
1.6 TMZ处理
取空白对照组、LV组及LV-LINC00152组细胞,TMZ(200 μg·mL-1)处理LV组及LVLINC00152组细胞48 h,设立TMZ+LV组和TMZ+LV-LINC00152组。空白对照组和LV组以等量TMZ溶剂处理48 h。
1.7 细胞计数试剂盒(cell counting kit-8,CCK-8)法检测细胞活力
取所需空白对照组、LV组及LV-LINC00152组细胞,铺于96孔板中,每孔细胞数为6×103个,培养过夜后以TMZ处理细胞,每组设置5个复孔,同时设立调零孔和对照孔。继续培养48 h后每孔加入10 μL CCK-8溶液,培养箱温育3 h,酶标仪测定450 nm处的吸光度(D)值,计算细胞活力。
1.8 流式细胞术检测细胞周期
将处理好的各组细胞用不含乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)的胰酶消化。收集细胞于离心管中,1 200 rpm离心5 min,PBS洗2次后用70%乙醇在4 ℃环境中固定30 min,固定结束后1 200 rpm离心5 min,PBS洗2次,1 200 rpm离心5 min,加入300 μL PI/RNase染色液,室温避光温育60 min,将温育好的细胞悬液加入样品管中,用流式细胞仪在488 nm激发光处检测。
1.9 蛋白质印迹法(Western blot)检测蛋白水平
药物处理各组细胞48 h后,取出细胞并以蛋白刮刀将贴壁细胞刮下,收集细胞悬液并1 200 rpm离心5 min,弃去上清液,PBS清洗1遍,1 200 rpm离心5 min,弃去上清液,将管内液体吸净,各组细胞加入含1 mmol/L苯甲基磺酰氟的RIPA细胞裂解液,冰上裂解液裂解10 min,4 ℃下12 000 rpm离心20 min,吸取上清液置于冰上备用,二喹啉甲酸(bicinchoninic acid,BCA)法进行定量,制备样品。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白(各样品上样量为30 μg),转膜,5%脱脂牛奶封闭PVDF膜4 h,洗膜缓冲液(tris buffered saline Tween,TBST)洗膜3次,每次10 min;然后按要求加入CD133(1∶2 000)、Oct-4(1∶1 000)或GAPDH抗体(1∶1 000)4 ℃温育过夜。第2天,TBST洗膜3次,再加入相应的二抗(1∶5 000),室温温育1 h,以ECL化学发光液进行显色,凝胶成像仪进行成像并检测灰度值。
1.10 统计学处理
应用SPSS 11.0软件进行统计学分析,数据以表示。两组间比较采用两独立样本资料的t检验,多组间比较采用单因素方差分析,两两多重比较方法用LSD-t检验。检验水准α=0.05,P<0.05为差异有统计学意义(双尾)。
2 结果
2.1 GSC的分离鉴定
U251细胞在含有10%FBS的MEM培养基中以单层细胞贴壁生长。生长24 h后用干细胞培养液进行分离培养,细胞以球形悬浮状态生长。免疫荧光染色发现GSC表达干细胞标志物CD133和Oct-4,表明GSC分离培养成功(图1)。
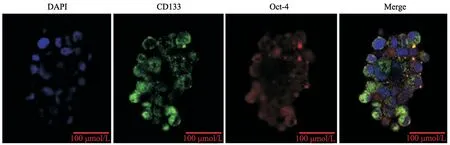
图1 GSC中CD133和Oct-4蛋白表达变化Fig.1 Changes in CD133 and Oct-4 protein expressions in GSC
2.2 各组GSC中LINC00152表达水平
各组细胞生长至对数期后以RTFQ-PCR检测LINC00152水平,结果显示,空白对照组、LV组和LV-LINC00152组GSC中LINC00152 RNA相对表达水平分别为0.32±0.02、0.33±0.03和1.56±0.12,组间总体比较存在差异(F=519.3,P<0.000 1),与LV组相比,LV-LINC00152组LINC00152 RNA相对表达水平明显上调(P<0.000 1,图2)。

图2 各组LINC00152表达水平Fig.2 Expression level of LINC00152 in each group
2.3 LINC00152抵抗TMZ诱导的GSC细胞活力降低
TMZ处理48h后,CCK-8结果 显示,空白对照组、LV 组、TMZ+LV 组和TMZ+LV-LINC00152组GSC细胞活力分别为100.0%、(98.2±9.6)%、(46.2±4.5)%和(77.3±6.8)%,组间总体比较存在差异(F=62.76,P<0.000 1),空白对照组和LV组无明显差异;与LV组相比,TMZ+LV组细胞活力明显降低(P<0.000 1);而与TMZ+LV组相比,TMZ+LV-LINC00152组细胞活力明显升高(P=0.000 1,图3)。

图3 各组细胞活力变化Fig.3 Changes in cell viability of each group
2.4 LINC00152抵抗TMZ诱导的GSC周期改变
TMZ处理48 h后,以流式细胞术检测细胞周期,结果显示,空白对照组、LV组、TMZ+LV组和TMZ+LV-LINC00152组S期GSC细胞比例分别为(9.88±2.26)%、(10.21±3.16)%、(37.28±5.12)%和(17.75±4.06)%,各组间总体比较差异明显(F=34.33,P<0.000 1),空白对照组和LV组相比无明显差异;与LV组相比,TMZ+LV组S期细胞比例明显增加(P<0.0001);而与TMZ+LV组相比,TMZ+LV-LINC00152组S期细胞比例明显降低(P=0.000 2,图4)。

图4 各组细胞周期变化Fig.4 Cell cycle changes in each group
2.5 LINC00152逆转TMZ诱导的GSC中S期相关蛋白水平
TMZ处理48 h后,Western blot检测各组P53、Cyclin A、CDC25A和CDK2蛋白水平变化,结果显示,空白对照组、LV组、TMZ+LV组和TMZ+LV-LINC00152组组间P53(F=65.23,P<0.000 1)、CyclinA(F=41.85,P=0.000 1)、CDC25A(F=34.38,P<0.000 1)、CDK2(F=52.22,P<0.000 1)蛋白水平总体差异明显。空白对照组和LV组相比无明显差异;与LV组相比,TMZ+LV组Cyclin A、CDC25A、CDK2蛋白水平明显下调(P<0.000 1),P53蛋白表达明显上调(P<0.000 1);而与TMZ+LV组相比,TMZ+LV-LINC00152组Cyclin A、CDC25A、CDK2蛋白表达明显上调(P<0.000 1),P53蛋白水平明显下调(P<0.000 1,图5)。
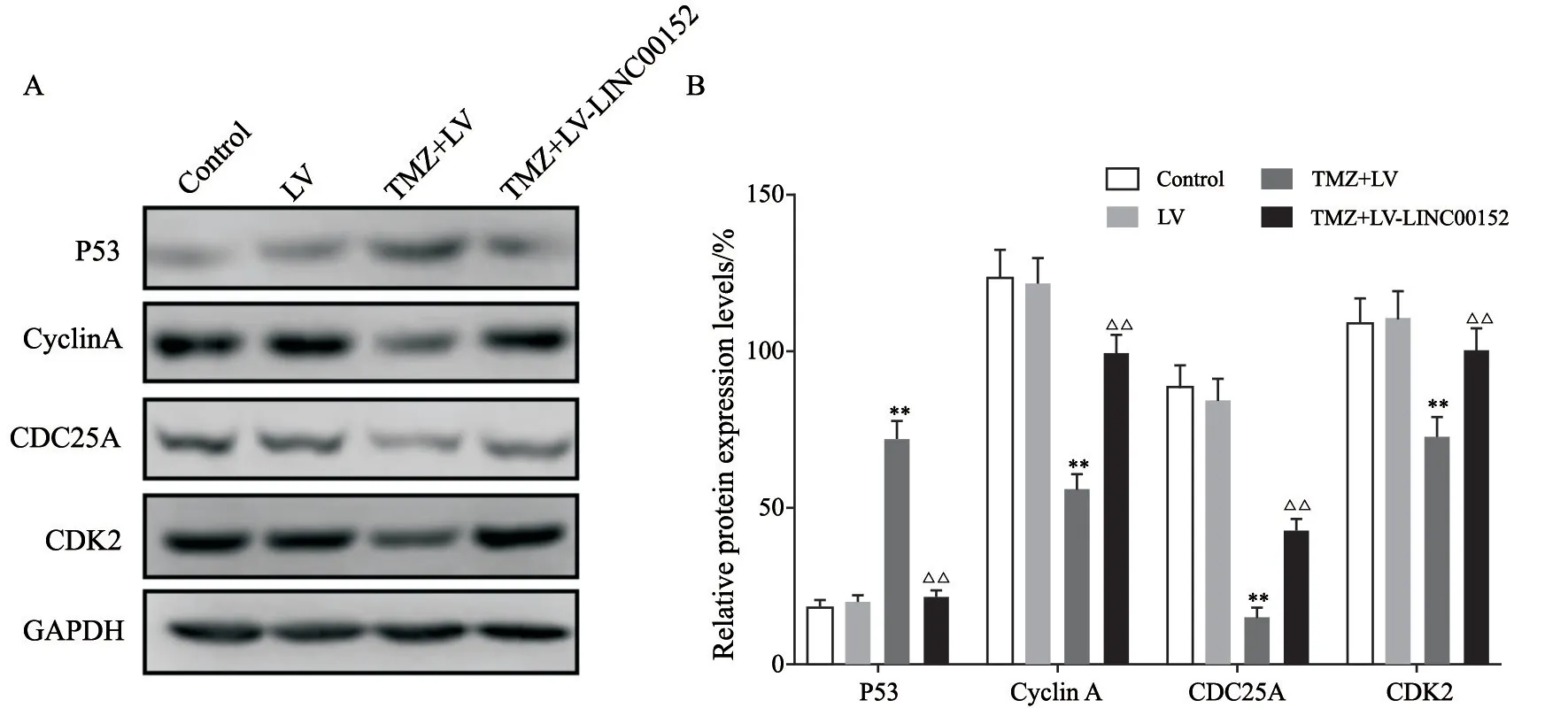
图5 各组细胞S期相关蛋白表达变化Fig.5 Changes of S-phase related protein expression in each group
3 讨 论
GSC是存在于脑胶质瘤中的一类自我更新迅速、无限增殖及具有多向分化潜能的细胞[9]。研究[10]显示,GSC与神经干细胞类似,在脑胶质瘤耐药和复发中起到关键性作用。文献[11-12]报道,lncRNA LINC00152异常表达于胶质瘤、肝癌、胃癌及结肠癌等恶性肿瘤中。最新研究[7]显示,LINC00152与脑胶质瘤临床不良预后相关,下调LINC00152基因表达可抑制脑胶质瘤细胞的体内生长,提示LINC00152在胶质瘤中可能发挥促癌效应。本研究以神经干细胞培养液培养脑胶质瘤U251细胞,分离成球生长的细胞球。免疫荧光实验发现,细胞CD133和Oct-4蛋白水平明显上调。CD133和Oct-4已被公认为干细胞标志物用于多种肿瘤干细胞研究[13]。有研究显示,CD133或Oct-4阳性表达是肿瘤细胞获得干细胞特性的标志之一,提示本研究[14-15]成功提取了GSC细胞球。
TMZ作为脑胶质瘤的一线化疗药物,能引起脑胶质瘤细胞周期阻滞和凋亡,具有确切的疗效[3],但TMZ治疗一段时候后往往会失去疗效。为观察LINC00152在TMZ诱导GSC周期阻滞中的作用,本研究以慢病毒转染法外源性上调LINC00152表达水平并以嘌呤霉素筛选稳定表达的GSC细胞株。结果发现,TMZ能诱导GSC细胞活力降低和S期阻滞,而LINC00152过表达能抑制上述效应,提示LINC00152可能通过减少S期阻滞从而抵抗TMZ诱导的GSC细胞活力降低。本研究进一步观察了S期相关蛋白的表达变化,结果显示,TMZ能诱导Cyclin A、CDC25A、CDK2蛋白表达下调以及P53蛋白表达上调,而LINC00152过表达可抑制上述效应。研究[16-17]表明,Cyclin A-CDK2是细胞S期启动DNA复制的重要复合物。另有文献[18]报道,多柔比星可诱导肝癌HepG-2细胞S期阻滞,从分子水平上发现细胞Cyclin A、CDK2及CDC25A表达下调。还有研究[19]显示,miR-155可通过上调P53蛋白表达诱导前列腺癌细胞周期阻滞,提示本研究中的TMZ可能通过下调Cyclin A、CDK2、CDC25A蛋白表达及上调P53蛋白表达,从而诱导GSC细胞S期周期阻滞,而过表达LINC00152可抑制上述效应。
综上所述,TMZ可通过下调Cyclin A、CDC25A、CDK2蛋白表达及上调P53蛋白表达,进而诱导GSC细胞S期阻滞。本研究发现,lncRNA LINC00152可抑制TMZ诱导的GSC细胞P53、Cyclin A、CDC25A、CDK2蛋白表达变化及S期阻滞,这些研究结果有望为临床治疗脑胶质瘤提供新的思路。但lncRNA LINC00152在脑胶质瘤中的生物学功能还有待于更多研究证实。
