大型单中心医院登记的7 753例肺癌手术患者生存报告:基于第8版国际肺癌TNM分期标准
2020-06-11王泽洲周昌明吴浩旋陈海泉
王泽洲,张 扬,莫 淼,袁 晶,周昌明,沈 洁,吴浩旋,李 航,叶 挺,胡 鸿,陈海泉,郑 莹
1.复旦大学附属肿瘤医院肿瘤预防部,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院胸外科,复旦大学上海医学院肿瘤学系,上海200032
肺癌是全球最常见的恶性肿瘤。据世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)的最新估计,2018年全球肺癌新发病例达209万,占全部恶性肿瘤发病的11.6%;死亡病例176万,占所有恶性肿瘤死亡的18.4%。无论是发病人数还是死亡人数均位列所有癌种首位[1]。由于人口基数的原因,中国是全球肺癌发病数量最多的国家,约占全球总量的35%。2019年发布的全国癌症登记中心数据显示,2015年中国人群肺癌新发病例数约为78.7万人,死亡约63.1万人[2]。
恶性肿瘤患者的生存资料是用于评估恶性肿瘤预防控制、诊断治疗和康复水平的重要依据之一。相对其他恶性肿瘤,肺癌的生存情况较差。据Concord-3项目估计,全球大多数国家(2010—2014年诊断的患者)的总体5年净生存率在10%~20%之间[3]。在20世纪末,由于早期诊断技术和靶向治疗等的发展,从1995—1999年到2005—2009年,中国肺癌患者的5年标化生存率提高了133.3%[4]。但近10年间,肺癌的生存情况没有得到进一步的提高。国家癌症中心对全国17个癌症登记处以人群为基础的研究报告显示,2003—2005年、2006—2008年、2009—2011年和2012—2015年诊断的肺癌患者5年相对生存率分别为16.1%、15.8%,16.8%和19.7%,并无显著性升高趋势[5]。
肿瘤登记是系统收集恶性肿瘤患者发病和生存结局的基础。复旦大学附属肿瘤医院是一所集医疗、教学、科研、预防为一体的三级甲等肿瘤专科医院,是中国以人群为基础的肿瘤登记制度的起源地[6]。医院的胸部肿瘤多学科诊疗团队为肺癌患者提供全面、规范、有机的综合医疗服务。自2009年起,医院对所有住院治疗的恶性肿瘤患者进行登记和生存随访管理,收集其复发转移情况和生存结局资料[7]。
目前国内少有报道基于医院肿瘤登记的大样本肺癌患者长期生存研究,本研究总结过去10年间治疗的7 753例肺癌手术患者的资料,分性别描述不同年龄组、吸烟史、诊断时间、肿瘤分期患者的生存率情况。通过来自真实世界的数据,反映经规范治疗后的肺癌患者的生存情况,旨在为肺癌的预防、筛查、治疗和临床决策提供证据支撑。
1 资料和方法
1.1 研究对象
本研究纳入标准:①首次治疗日期在2008年1月1日—2017年12月31日的住院行肺癌手术的患者。其中先行新辅助治疗后手术治疗的患者首次治疗时间为新辅助治疗开始时间,未行新辅助治疗直接手术的患者以本院首次肺癌手术的时间为首次治疗时间;② 原发肿瘤部位在肺部,即ICD-10编码为C34的患者。
排除标准:①未在复旦大学附属肿瘤医院行手术治疗的肺癌患者;② 仅行淋巴结活检术未行根治术的患者;③原发灶不在肺部的恶性肿瘤患者(如原发在乳腺、骨骼、消化道和泌尿生殖系统等发生肺转移);④ 鳞状上皮不典型增生、不典型腺瘤样增生等发生癌前病变;⑤ 肉芽增生等良性病变或非肺癌病变。
1.2 随访计划
患者首次治疗出院满半年后进行首次随访,5年内随访周期为半年1次,5年后随访周期为1年1次,直至死亡终止随访。
完全随访是指患者随访时长和最近1次随访记录符合随访计划,具体包括以下4种情况:①随访到死亡;② 随访满10年仍存活;③随访时长在5~10年之间且近1年内有过随访记录;④ 随访时长不满5年且在近半年内有过随访记录。
1.3 资料收集
患者随访资料通过3种方式收集,包括病史查阅、电话随访和死因数据链接。病史查阅是从患者出院1年后开始,按随访计划规定的周期,通过查阅门诊及住院病历信息了解患者是否有局部复发、远处转移、第二原发恶性肿瘤等事件,末次就诊时间记为末次随访时间;电话随访是当在随访计划规定周期内患者没有任何来院复诊记录时,由专职随访人员根据病历记录的联系方式联系患者或家属,通过电话问询了解其生存情况;死因数据链接是指通过与相关省级疾病预防控制中心肿瘤登记系统或死因登记系统进行数据链接和匹配,以获得患者死亡结局资料,包括死亡日期和原因。随访信息收集截至2019年11月30日。
1.4 研究方法
本研究纳入分析的变量包含以下内容:①患者基本信息,例如性别、年龄、是否于复旦大学附属肿瘤医院初治、首次治疗时间。② 临床信息,包括吸烟史、病理学分期资料。其中,本报告中有吸烟史定义为现在或曾经有吸烟数量超过100支,病理学分期按国际抗癌联盟(Union for International Cancer Control,UICC)/美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版肺癌TNM分期标准[8]分类,pTNM分期分为0、ⅠA、ⅠB、ⅡA、ⅡB、ⅢA、ⅢB、ⅢC和Ⅳ期。③随访信息,包括是否发生复发/转移、复发/转移时间、转移部位,是否发生第二原发恶性肿瘤及相应时间,是否死亡、死亡时间和原因,以及末次随访时间。
1.5 统计学处理
统计指标均采用观察生存率。总生存时间定义为从患者在复旦大学附属肿瘤医院首次治疗时间至终点事件全死因死亡的时间,截止统计时尚未发生终点事件及未知终点事件的患者,在末次随访时间点按删失处理。
采用Kaplan-Meier法计算1、3和5年观察生存率点估计及95% CI,并根据患者年龄组、吸烟史、诊断时间和肿瘤分期分层,分性别描述不同特征患者的总生存率。
1.6 数据质量
截至2019年11月30日,所有患者随访期间发生死亡1 417例,占18.28%;接受过至少1次随访的患者占93.6%;完全随访比例为74.7%。
2 结果
2.1 肺癌患者的基本情况
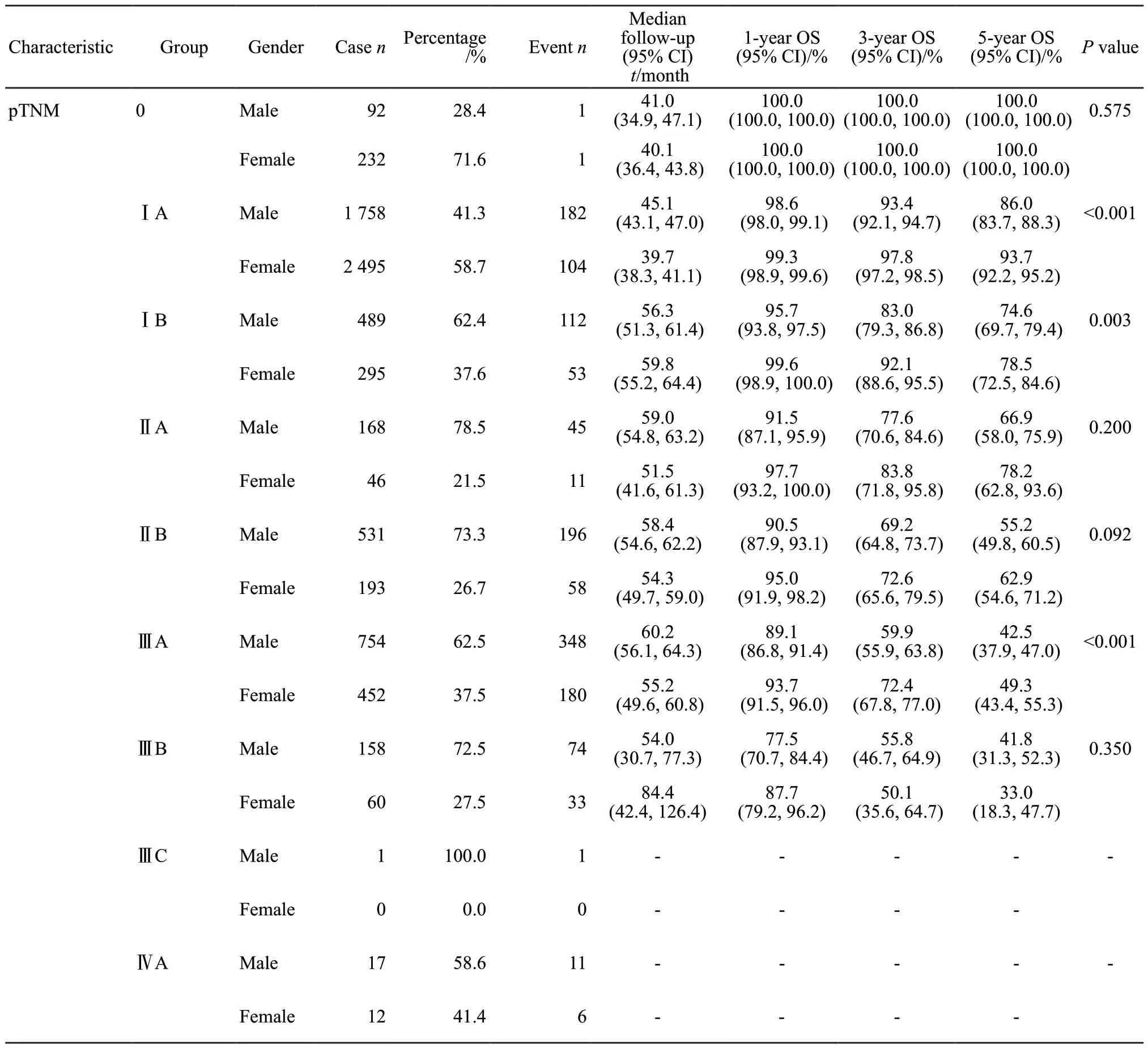
研究纳入2008—2017年期间在复旦大学附属肿瘤医院住院手术治疗的初诊肺癌患者共7 753例。平均年龄(58.9±10.6)岁,其中51.2%为男性,48.8%为女性。男性患者有吸烟史的占73.8%,女性患者有吸烟史的仅2.9%。按UICC/AJCC第8版肺癌TNM分期标准分为0、ⅠA、ⅠB、ⅡA、ⅡB、ⅢA、ⅢB、ⅢC和Ⅳ期的患者分别占4.2%、54.9%、10.1%、2.8%、9.3%、15.6%、2.8%和0.4%。2013—2017年诊治患者相较2008—2012年有显著增长。
2.2 肺癌患者的OS
男性患者中位随访时间为49.7个月,5年总生存率(overall survival,OS)为69.0%,女性中位随访时间为43.0个月,5年OS为82.9%,显著优于男性(P<0.01)。其中男性不同年龄组≤40岁、41~50岁、51~60岁、61~70岁、71~80岁患者的5年OS分别为85.3%、80.8%、75.4%、63.6%、55.7%,女性不同年龄组患者的5年OS分别为91.1%、82.7%、84.5%、82.1%、76.0%,随着年龄增长OS呈下降趋势,其中41~80岁各年龄组女性的5年OS显著高于同年龄组男性(P<0.05)。有吸烟史和无吸烟史的男性患者5年OS分别为67.1%和74.6%,而对应的女性患者5年OS分别为80.5%和81.7%,优于男性(P<0.05)。2013—2017年诊治的患者OS优于2008—2012年的患者(P<0.05)。
男性患者0、ⅠA、ⅠB、ⅡA、ⅡB、ⅢA和ⅢB期5年OS分别为100.0%、86.0%、74.6%、66.9%、55.2%、42.5%和41.8%,女性患者5年OS分别为100.0%、93.7%、78.5%、78.2%、62.9%、49.3%和33.0%。OS随分期上升呈下降趋势。其中ⅠA、ⅠB、ⅢA期女性患者OS要显著优于男性(P<0.05,表1)。

表1 2008—2017年肺癌手术患者OS(N=7 753)Tab.1 Overall survival of lung cancer surgical patients from 2008 to 2017 (N=7 753)
续表 1
3 讨 论
本研究总结了2008—2017年上海单中心医院肿瘤登记的7 753例大样本肺癌手术患者的长期OS,也是中国国内首次报告基于UICC/AJCC第8版肺癌TNM分期标准分类的大样本肺癌患者长期预后结果。通过真实世界的高质量随访数据反映中国经济发达地区近10年来肺癌的防治效果,深入分析不同人口学和病理学分期患者的生存状况,为了解中国肺癌诊疗水平及手术患者预后提供了可靠依据。
基于人群的肿瘤登记资料显示,肺癌的总体预后较差。来自美国监测、流行病学及终点事件(Surveillance,Epidemiology,and End Results,SEER)数据库的统计结果显示,2010—2016美国局部性(Localized)、区域性(Regional)和转移性(Distant)肺癌患者5年相对生存率分别为59.0%、31.7%和5.8%[9]。英国国家统计局报告的2013—2017间诊断的Ⅰ、Ⅱ、Ⅲ和Ⅳ期肺癌患者5年净生存率分别是56.6%、34.1%、12.6%和2.9%[10]。来自上海肿瘤登记处的2002—2006年肺癌患者Ⅰ、Ⅱ、Ⅲ和Ⅳ期的5年OS分别为55.5%、31.9%、12.8%和5.3%[11]。本研究结果显示,医院手术治疗的0、ⅠA、ⅠB、ⅡA、ⅡB、ⅢA和ⅢB期男性肺癌患者5年OS分别为100.0%、86.0%、74.6%、66.9%、55.2%、42.5%和41.8%,女性肺癌患者5年OS分别为100.0%、93.7%、78.5%、78.2%、62.9%、49.3%和33.0%。不论男性还是女性,对应病理学分期的5年OS均显著高于人群登记数据,提示肺癌患者通过规范治疗,可以显著改善预后。此外,本研究预后结果略高于国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)根据全球9万多个病例报道的对应预后[8],体现了中国经济发达地区较好的肺癌诊疗水平。
肺癌的早期诊断和治疗能显著提升生存率,本研究中0期患者的5年OS接近100.0%,ⅠA期患者男性5年OS超过85.0%,女性达到93.7%。但是目前人群中仅有不到20%的肺癌在早期被发现,这突显出进行高危人群筛查的必要性和重要性。两项大型低剂量螺旋计算机断层扫描(low-dose computed tomography,LDCT)肺癌筛查试验(NLST[12]和NELSON[13])已经证明在高危人群中进行定期的LDCT筛查相比胸片或不筛查可以降低20%~25%的死亡率,筛查检测到的肺癌中Ⅰ期的比例约60%。一个上海的社区肺癌早期筛查项目显示,LDCT筛查对于早期肺癌的检出率高达94.1%,比传统检查方式高74.1%[14]。肿瘤分期是影响肺癌患者生存的重要因素,如果更多患者能够获得早期发现、诊治的机会,那么肺癌的总体预后将会改善。
尽管男性的肺癌发病率和死亡率是女性的两倍,但是越来越多的研究关注到,在中国不吸烟女性也是肺癌高危人群,中国的女性肺癌患者的吸烟率与西欧国家完全不同,传统的肺癌高危人群的定义正在逐渐发生变化[15-16]。本研究中仅有2.9%的女性肺癌患者自我报告了明确的吸烟史,通过吸烟情况分层分析发现,不论是否吸烟,女性患者的OS均优于男性患者。同时针对年龄组和病理学分期的分层分析结果也不同程度地显示出在41~80岁各年龄组以及ⅠA、ⅠB、ⅢA期女性相对于男性的预后优势,进一步证明了由性别本身造成的预后差异。有研究者认为,女性激素水平与男性的差异可能是其肺癌预后的保护因素,另外可能与男女性不同的基因易感性及预后基因等因素有关[17-18]。女性早期肺腺癌的发生率高可能是导致女性非小细胞肺癌(non-small cell lung cancer,NSCLC)患者预后优于男性的原因[19],有关病理学类型的校正在本研究中暂未涉及。未来的研究应更多地关注东亚女性、不吸烟、年轻人群肺癌高发的现象,加强对病因学以及女性生存优势背后的生物学机制研究。
本研究仍有一定的局限性。首先,本研究的数据并非以人群为基础,无法计算相对生存率,不宜与以人群为基础的流行病学调查数据进行直接比较。其次,研究未纳入不宜手术的晚期肺癌患者,无法显示这部分可能预后较差的患者的生存状况。此外,2014—2017年确诊的患者随访时间未满5年,其5年生存率可能存在偏倚。最后,本研究为描述性研究,描述了不同临床或病理学特征的肺癌患者的OS,并未进行多因素校正,因此对影响生存因素的解释存在一定的局限性。未来将采用COX回归模型、倾向性评分等方法进行多因素分析,校正混杂因素,对影响肺癌生存的各个因素进行深入分析。
